氧化吸收法同步脱除燃烧烟气中SO2,NOx和CO2的化学热力学及其评价
王大淇,赵兵涛,张梓均,方童波
(上海理工大学 能源与动力工程学院,上海 200093)
空气污染对环境和人类健康的威胁越来越大,控制燃煤烟气污染物的排放成为保护大气环境的关键方法之一[1]。一般地,固定源燃烧烟气脱硫技术根据其工艺特点可以分为湿法脱硫和干法脱硫两大类。湿法脱硫主要有石灰石/石灰法、双碱法等[2]。干法脱硫主要有喷雾干燥法[3]、循环流化床干法烟气脱硫法[4]、活性炭/活性焦催化氧化吸附法等[5]。NOx的脱除方法主要包括选择性催化还原(SCR)和选择性非催化还原(SNCR)技术,但这两种技术的投资和运行成本较为昂贵[6]。此外,烟气脱碳包括吸收法、吸附法以及膜法等[7-9]。因此,在现有的湿法烟气脱硫装置基础上,开发与其结合的协同脱除技术具有广泛的应用前景[10-12]。综合而言,湿化学法以其高的捕获效率、低的再生能耗以及低的运行费用,已经成为污染物联合或同步脱除技术或工艺的首选。但是,常规SO2,NOx和CO2的梯级单独序列脱除方式限制了系统的技术经济性。研究表明,联合或同步脱除SO2和CO2将会降低17%以上的成本[13]。文献[14-20]通过热力学方法对氧化吸收SO2,NOx的方法进行了可行性分析,研究表明各类氧化吸收组合对于同步脱除硫碳氮氧化物的效果较为显著。马双忱等[21]进行了O3氧化同时脱硫脱硝的研究,摩尔比 n(O3)∶n(NO)=1∶1 时,脱硝率可达 89.6%。刘凤等[22]采用酸性NaClO2溶液脱硫脱硝,脱除效率分别达到100%和95.2%。常彦等[23]通过鼓泡反应器实验,在不同工况下对SO2,NOx的吸收效率进行了研究,研究表明,大多数氧化吸收组合的脱硫效率接近100%,脱硝效率在80%以上。罗沁澜等[24]采用鼓泡反应器实验,通过复合胺砜溶液来验证同时捕获CO2,SO2和NOx的可行性,结果表明,随着实验时间的增加,SO2和NO2的脱除率均维持在100%,CO2的脱除效率降低。
现有研究结合硫碳氮脱除的基本特点,对同步脱除的效率进行了一系列的实验和理论研究,总体上提出了有效的脱除方案以及相应的改进措施,为同步脱除硫碳氮氧化物提供了一定的指导。但是,目前的研究总体上仍存在以下问题:a. 大多数研究是在低温或高温条件下进行的,整个温度范围内的影响尚未提出指导;b. 多数研究集中在一种氧化剂下SO2和NOx的同步脱除,或者CO2和SO2的同步脱除,对于硫氮碳3种氧化物在氧化吸收液中同步脱除的报道甚少;c. 由于缺乏比较系统、有效的可行性分析,无法得出较为完整的信息对技术方案进行选择和优化。
本文是对现有研究的拓展,通过典型氧化剂H2O2,O3,NaClO2氧化 SO2和 NOx,同时采用3种工业上常用的NH3·H2O,MDEA,NaOH作为吸收剂。利用化学热力学原理,在300~370 K的温度范围内,对组合同步脱除SO2,NOx和CO2的可能性即方向和限度进行计算和分析,为进一步研究联合脱硫脱硝脱碳技术提供了理论依据。
1 研究方法
1.1 化学反应
在化学氧化吸收法同步脱除烟气污染物过程中,SO2最终被氧化成[22]。典型燃烧烟气中NO占NOx的90%以上,因此本文着重针对NO的吸收问题进行研究[25]。根据H2O2,O3,NaClO2与SO2,NO和CO2的物理化学性质,结合化学反应原理和质量守恒定律,可以写出吸收剂分别为NH3·H2O,MDEA,NaOH时,脱除SO2,NO和CO2的总化学方程式,如表1~3所示。

表1 吸收剂为NH3·H2O时的化学方程式Tab.1 Chemical formula when using NH3·H2O as an absorbent

表3 吸收剂为NaOH时的化学方程式Tab.3 Chemical formula when using NaOH as an absorbent
1.2 热力学计算方法
在一个等压变温的化学进程中,由基尔霍夫公式可知,其焓变可以用以下公式计算[26]:

式中:ΔrHm为反应焓变;ΔrHmθ为标准生成焓;ΔrCp,m为摩尔定压热容;T为热力学温度;r表示反应;m表示摩尔;θ表示标态。
上述反应中涉及到的各种物质的标准生成焓、标准吉布斯自由能、标准熵及比定压热容如表4所示。

表4 同步脱除SO2,NOx和CO2时各种物质的标准热力学参数[26-27]Tab.4 Standard thermodynamic parameters of various substances for simultaneously removing SO2, NOx and CO2
常用吉布斯自由能的变化判断化学反应的方向和限度。当ΔG<0时,反应朝正方向进行;当ΔG=0时,反应处于平衡状态;当ΔG>0时,反应朝反方向进行。吉布斯自由能的计算公式为[26]

式中:ΔrGm为吉布斯自由能变;ΔrSm为熵变;为标准熵变。
不同温度下的化学反应平衡常数计算式如下[26]:
式中:K为平衡常数;R为摩尔气体常数,大小为8.314 4 J/(mol·K)。

式中:PC为反应生成物分压,Pa为反应物分压。所有计算过程均在Matlab 2017软件平台上运算执行得到。
2 结果与讨论
2.1 焓 变
各反应的焓变随温度的变化如图1所示。在300~370 K范围内,脱硫反应的焓变不显著。但在脱硝反应中,以NaClO2溶液为氧化剂的氧化吸收剂的变化比其他组合的要大,说明温度对其脱硝反应的影响要比其他几种组合要大,但最终的可行性方向仍由吉布斯自由能决定。
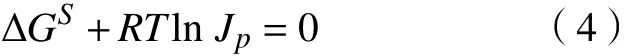

图1 温度对反应焓变的影响Fig.1 Effect of temperature on the enthalpy change
此外,图中曲线规律表明各个化学反应的焓变小于零,可以判断这些反应为放热反应。从热力学的角度来看,单纯的升高温度不利于正向反应,该结论与文献[14-15, 17]一致。
2.2 吉布斯自由能变
对于不同的温度,每个反应的吉布斯自由能变如图2所示。可以看出,其对应的吉布斯自由能变值都小于零,表明每个反应都可以自发进行,温度升高不利于SO2,NO和CO2的脱除,这一结果也与文献[14-15, 17, 28]一致。
根据化学热力学原理,吉布斯自由能越小,表明正向反应的可能性越大[29]。吉布斯自由能变的曲线表明,脱硫、脱硝化学反应程度最深相对应的氧化吸收剂组合分别为O3-NaOH,NaClO2-MDEA,脱碳化学反应最深的是以NaOH为吸收剂的氧化吸收液。此外,除氨水脱碳反应以外,所有反应的吉布斯自由能为-40 kJ/mol,表明各个反应可以进行的限度较深[24]。
2.3 平衡常数和分压
在不同温度下反应的平衡常数规律如图3所示,与部分现有的数据对比,两者的差异不明显,规律基本一致[14-15,17]。根据图中规律,当温度在300~370 K变化时,所有的平衡常数都有较高的值,这表明反应的程度很深。
图2 温度对吉布斯自由能变的影响Fig.2 Effect of temperature on the Gibbs free energy

图3 不同温度下反应的平衡常数Fig.3 Equilibrium constant of the reaction at different temperatures
由于平衡分压比较大,为了显示方便,本文将其规律用ln PT表示。不同反应的如表5所示。当反应达到平衡时,SO2,NO和CO2的分压随着温度的升高而增大。结果表明,温度升高不利于这3种气体的脱除。但是,即使温度上升至370 K,SO2,NO和CO2的分压仍然很低,说明平衡向生成反应物的方向移动的程度较大[29],转化可行性较高。从理论上表明利用这几种氧化吸收剂脱除SO2,NO和CO2是可行的。
2.4 动态加权综合评价法
通常,使用各种氧化吸收剂脱硫、脱硝和脱碳的反应程度和性能很大程度上表现在平衡常数这一指标。氧化吸收的反应程度和可行性的性能评价是在温度变化的基础上对脱硫、脱氮、脱碳性能进行的综合评价,并根据评价结果进行有效预测,制定最优方案。现行的评价方法普遍存在对指标间关系研究不够,权重取值主观性较大等问题。因此,本文采用客观性较强的动态加权综合评价法对涉及到的氧化吸收反应程度和性能进行综合评价,增大了评价结果的客观性和准确性。计算的流程如图4所示。
由于所得的平衡常数为极大型指标,平衡常数用y表示。采用归一化方法将其数据指标作极小化处理,归一化处理后的数据点用表示,相应的区间变为[0, 1],并对其数值取动态积分平均计算,温度值用x表示,所得的数值用表示,区间为[0, 1]。考虑到脱硫、脱硝、脱碳三者在本课题中的研究意义,对其权重采取均分的形式,各项权重Wi均取1/3,从而得到最终的排序结果和最优值,其综合评价指标值用S表示,最终结果如图5所示。

表 5 各个反应的 ,ln PNOT 和ln PCO2TTab.5 ln PSO2T, ln PNOT and ln PCO2T corresponding to each reaction

图4 动态加权综合评价法流程图Fig.4 Flow chart of the dynamic-weighted comprehensive evaluation method
结果显示,动态加权综合评价法很好地得出了相应的规律,从图中可以明显地看到不同组合之间的差异,综合性能排序结果为:NaClO2-MDEA>O3-NaOH>NaClO2-NaOH>O3-NH3·H2O>NaClO2-NH3·H2O>O3-MDEA>H2O2-MDEA>H2O2-NaOH>H2O2-NH3·H2O。仅仅从化学平衡角度来看,这9种氧化吸收液的脱除效果可以分为4种情况: O3-NaOH,NaClO2-NaOH和NaClO2-MDEA,3种混合溶液的脱除性能比较好,其中最好的是NaClO2-MDEA;O3-NH3·H2O,O3-MDEA和 NaClO2-NH3·H2O这3种组合脱除性能相差不大,排在第二;H2O2-NaOH和H2O2-MDEA两种混合溶液的脱除性能基本一样,排在第三;H2O2-NH3·H2O混合溶液的脱除性能最差。可以看到,与H2O2组合的混合溶液其脱除效果都不是很理想,一定程度上与其强挥发性有关,这一点有待进一步讨论和分析。综合以上排名和基础分析,从理论上讲,与其他溶液相比,NaClO2-MDEA溶液脱硫、脱硝、脱碳的能力最强。同时,相比其他几种吸收液,MDEA也具有较强的重生性,在经济性上也占有一定的优势。
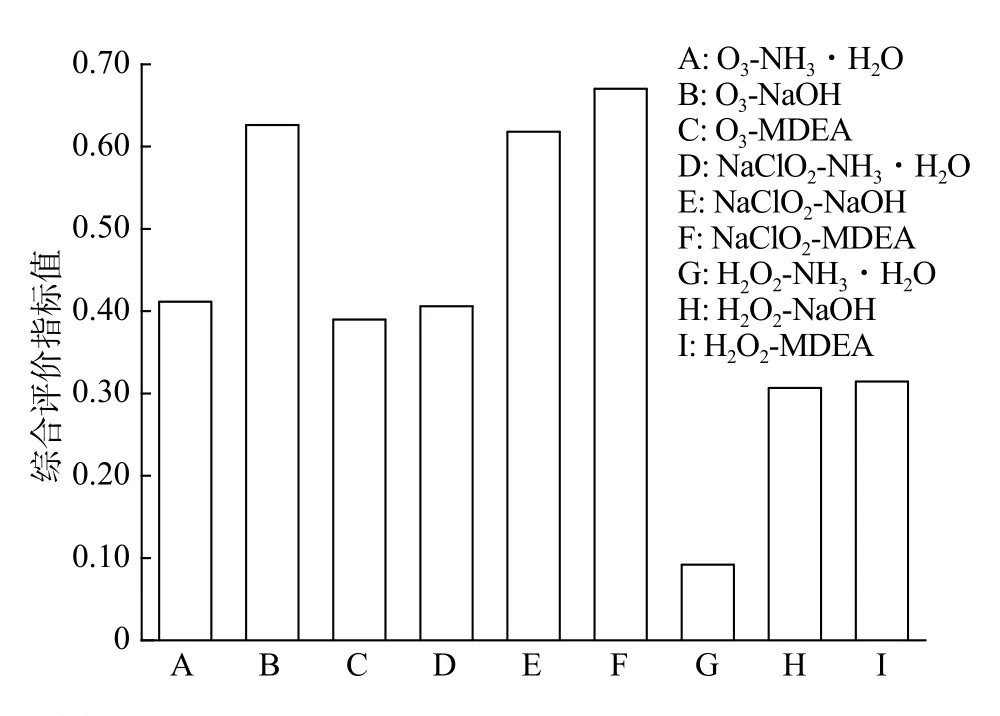
图5 氧化吸收剂脱硫、脱硝、脱碳反应的加权最优值大小Fig.5 Feasibility assessment of simultaneous desulfurization,denitrification and decarbonization based on the dynamic-weighted method
3 结 论
对9种氧化吸收策略同时捕获SO2,NOx和CO2的可行性进行了处理。化学热力学计算结果表明,同步脱除硫氮碳氧化物三者的吉布斯自由能范围分别为-1 264~-473 kJ/mol,-1 215~-663 kJ/mol和-76~-22 kJ/mol,均为负值,表明正向化学反应方向可以自发进行。
根据平衡常数的计算结果并基于动态加权综合评价法的评估,脱硫脱硝性能最好的混合溶液分别为O3-NaOH和NaClO2-MDEA,而以NaOH为吸收剂的混合溶液脱除CO2的性能最佳。就综合性而言,NaClO2/MDEA溶液的同步脱除性能最好。
虽然本文解决了同步脱硫、脱硝、脱碳的化学反应方向(热力学)与限度(化学平衡)问题,但是同步脱除的化学反应动力学(化学反应速率)的研究还有待进一步解决。

