木棉花超氧化物歧化酶分离工艺的研究
张小雪,李青容,刘敏宜,周晓思,李钰怡,谢丽玲
(汕头大学生物系,广东 汕头 515063)
超氧化物歧化酶(简称SOD)是一种广泛存在于生物体内的酸性金属酶,在pH 5.3 ~9.5 的范围内可稳定存在,对pH 不敏感,热稳定性较高,一般在70 ℃以上才会失活[1].根据现有的研究SOD 共有5 种类型,分别为Cu/Zn-SOD,Mn-SOD,Fe-SOD,Ni-SOD,Co-SOD.植物中以前三种存在形式的可能性较大,而对于后两种目前的研究还较为缺乏,只在少数的生物中发现[2].SOD 能够催化超氧阴离子,发生歧化反应,消除其毒性,在很多方面得到广泛的应用.如在化妆品行业,可作为添加剂被皮肤所吸收,具有防止皮肤衰老,抑制老年斑等作用;在临床应用方面,SOD 具有增加机体免疫力,治疗肿瘤和自身免疫症,抑制食物过敏的疗效;在农业上,适量的SOD 能够提高作物的抗逆能力[1,3-4].SOD 的来源广泛,人们可以从各种材料中进行提取,常见的包括动物血、猕猴桃、大蒜等.动物血中提取出来的SOD 可能含有致热因子,易感染病毒和其他难清洁的污染物,对人体的免疫机制和后续的分离提纯造成一定的影响,因此以动物血为原料生产的SOD 受到了很多国家和地区的抵制[2,5-7].目前利用微生物发酵进行SOD 的工业化生产也是研究的热点,但需要花费大量的时间在菌种的培养和优化上,成本较高[8].而以植物为原料进行提取同样也面临着活性较低,原料种类较少的问题[8-9].本研究则通过木棉花这种新型的原料提取SOD,具有成本低,材料来源丰富,安全性高的特点,是理想的生产原料,生产SOD 的工艺将具有广泛的市场价值.
1 材料,仪器与试剂
1.1 材料
采集新鲜的木棉花花瓣,清洗,恒温烘箱60 ℃烘干,制成粉末,200 目过筛,保存备用.
1.2 仪器与设备
FW177 型中草药粉碎机;THZ-D 型恒温烘箱;HD-1 型核酸蛋白检测仪;LGJ-10型真空冷冻干燥仪;pHS-3C 型pH 计;JY92I 型超声波细胞粉碎机;HH-2 型数显恒温水浴锅;UV-2100 型紫外可见分光光度计;TDL-5-A 型低速大容量离心机;BS224S 型电子天平;HL-2 型恒流泵等.
1.3 试剂
磷酸氢二钠,磷酸二氢钠,浓盐酸,氯仿,无水乙醇,丙酮,质量浓度为85%磷酸;Tris;EDTA-2Na;考马斯亮蓝G-250;牛血清蛋白等.
1.4 试剂的配制
(1)0.05 mol/L,pH7.8 的磷酸盐缓冲液.
(2)氯仿- 乙醇(体积比3:5)混合液.
(3)邻苯三酚法检测SOD 酶活性所需的试剂:
A 液:pH 8.2,0.1 mol/L 三羟甲基氨基甲烷一盐酸缓冲溶液.称取1.211 4 g Tris 和37.2 mg EDTA-2Na 溶于64.2 mL 0.1 mol/L 盐酸溶液中,用蒸馏水定容至100 mL;
B 液:4.5 mmol/L 邻苯三酚盐酸溶液.称取邻苯三酚56.7 mg 溶于少量10 mmol/L 盐酸溶液,并定容至100 mL.
(4)考马斯亮蓝法检测蛋白含量所需的试剂:
1 mg/mL 的标准蛋白溶液;
考马斯亮蓝G-250(0.01%)染液.
2 实验方法
2.1 提取工艺
木棉花SOD 的提取工艺如图1 所示.
2.2 单因素实验
2.2.1 料液比对木棉花SOD 酶活力的影响
称取木棉花粉末0.34 g,在超声波功率360 w,超声波处理总时间8 min①利用超声波处理的其他参数设置均为:超声处理时间3s,间隔时间3s,浸提时间9 h 的条件下,探究不同料液比1∶30,1∶40,1∶50,1∶60 g/mL 对木棉花SOD 酶活力的影响.
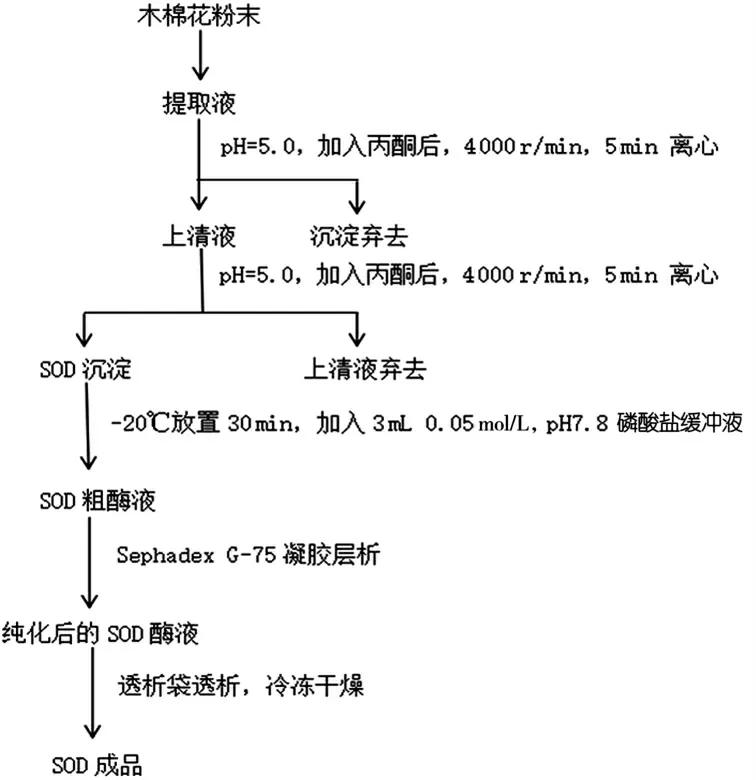
图1 木棉花SOD 提取纯化工艺流程图
2.2.2 超声波功率对木棉花SOD 酶活力的影响
称取木棉花粉末0.34 g,在料液比1∶60 g/mL,超声波处理总时间8 min,浸提时间9 h 的条件下,探究不同超声波功率180,270,360,450 w对木棉花SOD 酶活力的影响.
2.2.3 超声波处理时间对木棉花SOD 酶活力的影响
称取木棉花粉末0.34 g,在料液比1∶60 g/mL,超声波功率360 w,浸提时间8 h 的条件下,探究不同超声波处理时间4,8,12,16,20 min 对木棉花SOD 酶活力的影响.
2.2.4 浸提时间对木棉花SOD 酶活力的影响
称取木棉花粉末0.34 g,在料液比1∶60 g/mL,超声波功率360 w,超声波处理总时间8 min 的条件下,探究不同浸提时间4,6,8,10 h 对木棉花SOD 酶活力的影响.
2.2.5 正交实验
根据单因素获得的结果,选取适当的因素水平,对超声波提取木棉花SOD 的条件进行正交实验优化.
2.3 提取液的分离纯化
2.3.1 热变性法
将提取液置于水浴锅中,60 ℃恒温水浴15 min,加热过程轻轻搅拌.水浴后于4 ℃冰浴30 min,之后设置4 000 r/min、15 min 的参数进行离心、取上清,保存备用[2].
2.3.2 氯仿- 乙醇法
向提取液中加入0.25 倍体积的氯仿- 乙醇(3:5)混合液,搅拌15 min 后,离心(4 000 r/min,15 min),静置分层,取上清,保存备用.
2.3.3 分级沉淀法
(1)直接丙酮沉淀
向提取液中加入等体积的冷丙酮,搅拌15 min 后,离心(4 000 r/min,15 min),取沉淀,-20 ℃下放置30 min;取出后溶于3 mL 0.05 mol/L pH7.8 磷酸缓冲液,获得粗酶液备用.
(2)丙酮二次沉淀
向提取液中加入0.6 倍的预冷丙酮,离心(4 000 r/min,15 min),留上清备用;取沉淀,-20 ℃下放置30 min,取出后溶于3 mL 0.05 mol/L pH7.8 磷酸缓冲液,此为丙酮一次沉淀后的粗酶液.另外向上述提取的上清中加入1.2 倍的冷丙酮,进行同样的操作步骤,离心,取沉淀,冷冻,加磷酸缓冲液后得丙酮二次沉淀的粗酶液[10].由此可得一次沉淀和二次沉淀后的粗酶液,保存备用.
(3)丙酮等电点沉淀
将提取液用HCl 调节pH 至5.0,加入等体积的丙酮,搅拌均匀,离心(4 000 r/min,15 min),取上清;再调节pH 至4.0,设置同样的参数进行离心,获得SOD 沉淀,-20 ℃下放置30 min;取出后溶于3 mL 0.05 mol/L pH7.8 磷酸缓冲液[7],获得粗酶液备用.
2.4 葡聚糖凝胶柱层析
2.4.1 Sephadex G-75 的预处理
在室温下,将葡聚糖凝胶干粉浸泡于蒸馏水中24 h,并不断搅拌,以保证凝胶溶胀.
2.4.2 操作步骤
将处理好的Sephadex G-75 湿法装柱,柱床体积42 mL,利用0.05 mol/L pH7.8 磷酸缓冲液进行平衡,待核酸蛋白质紫外检测仪绘出稳定的基线即可上样,控制流速为0.5 mL/min,用同样的缓冲液进行洗脱,检测仪上每绘制一个峰便收取一管样液,尽可能地将SOD 纯化.
2.5 SOD酶活力及蛋白含量的测定
2.5.1 酶活力的测定采用微量邻苯三酚自氧化法[11]和试剂盒法
2.5.2 蛋白质含量的测定采用考马斯亮蓝法[1]
(1)蛋白质标准曲线的绘制
测定结果绘制的标准曲线如图2 所示.
(2)样品中蛋白质含量的测定
吸取1 mL 的样品,加入5 mL 的考马斯亮蓝G-250,混合均匀,静置30 min 后测定其吸光值.
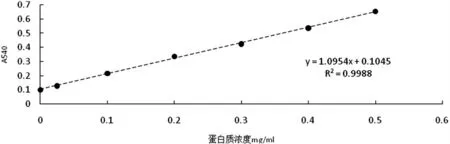
图2 蛋白质标准曲线
3 结果与分析
3.1 单因素实验结果
3.1.1 料液比对木棉花SOD 酶活力的影响
结果表明,料液比小于1∶20 g/mL 时,提取液浓稠,无法进行后续实验,因此选择料液比为1∶20 g/mL 及其以上的条件进行实验.根据结果显示,料液比为1∶20 g/mL时木棉花SOD 酶活力最强.随着料液比的增大,木棉花SOD 在强离子的条件下结构发生改变,导致活性逐渐降低[7],而且料液比过高导致比活力变低,对后续的分离纯化不利[10].因此可选择1∶20,1∶25,1∶30 g/mL 的料液比进行正交实验.
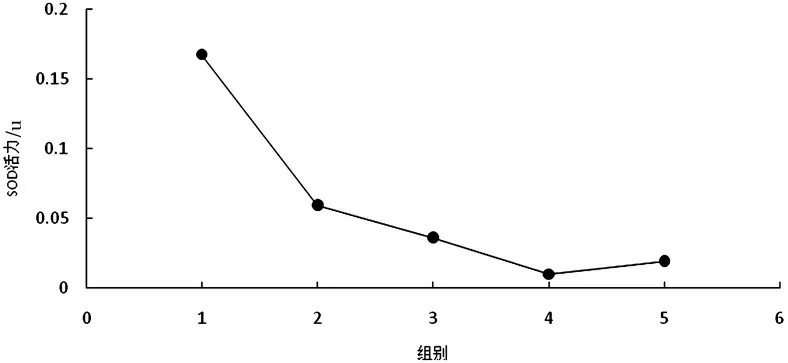
图3 料液比对木棉花SOD 活性的影响
3.1.2 超声波功率对木棉花SOD 酶活力的影响
结果如图4 所示,提取效果较好的超声波功率范围在180~270 w 左右.随着超声波的空化作用的增强,细胞被破坏,大量细胞内物质释放,有利于木棉花SOD 的溶出;而另一方面,超声波功率过大,对SOD 酶结构造成破坏,降低酶活力[7].
3.1.3 超声波处理时间对木棉花SOD 酶活力的影响
不同超声波处理时间的实验结果如图5 所示,在处理总时间8 min 之前,随着处理时间的延长,SOD 总活性逐渐提高,这是因为随着细胞破碎越彻底,更有利于SOD 的溶出[7].在8 min 之后,随着时间的延长,木棉花SOD 酶活力无明显变化,说明木棉花SOD 在8 min 时已经充分释放.最终选择7 min,8 min,9 min 三个水平做进一步的正交实验.

图4 超声波功率对木棉花SOD 活性的影响
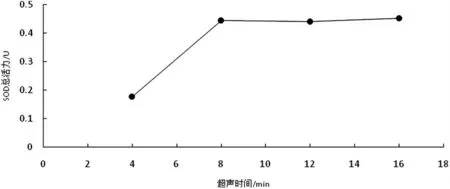
图5 超声时间对木棉花SOD 活性的影响
3.1.4 浸提时间对木棉花SOD 酶活力的影响
结果如图6 所示,不同浸提时间对实验结果的影响.在浸提时间6 h 之前,随着浸提时间的延长,SOD 总活性逐渐提高,SOD 溶出越充分;在6 h~8 h 之间,溶液中SOD的总活性保持不变;在8 h 之后,随着时间的延长,SOD 活性逐渐下降.因此选择6,7,8 h 三个水平做进一步的正交实验.
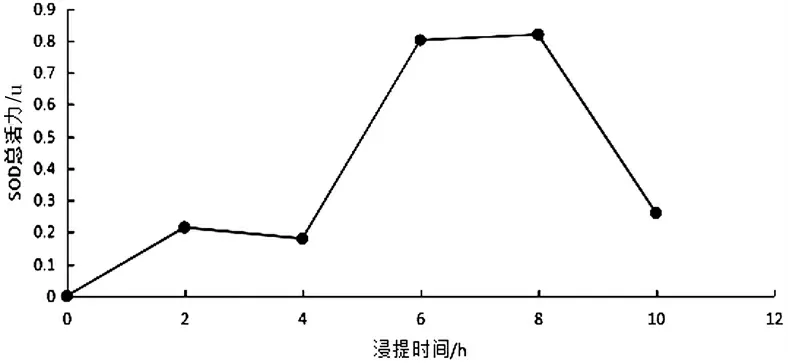
图6 浸提时间对木棉花SOD 活性的影响
3.2 正交实验
3.2.1 正交实验的因素水平
在单因素实验的基础上,设计L9(43)的正交实验.具体的设计情况如表1 所示.
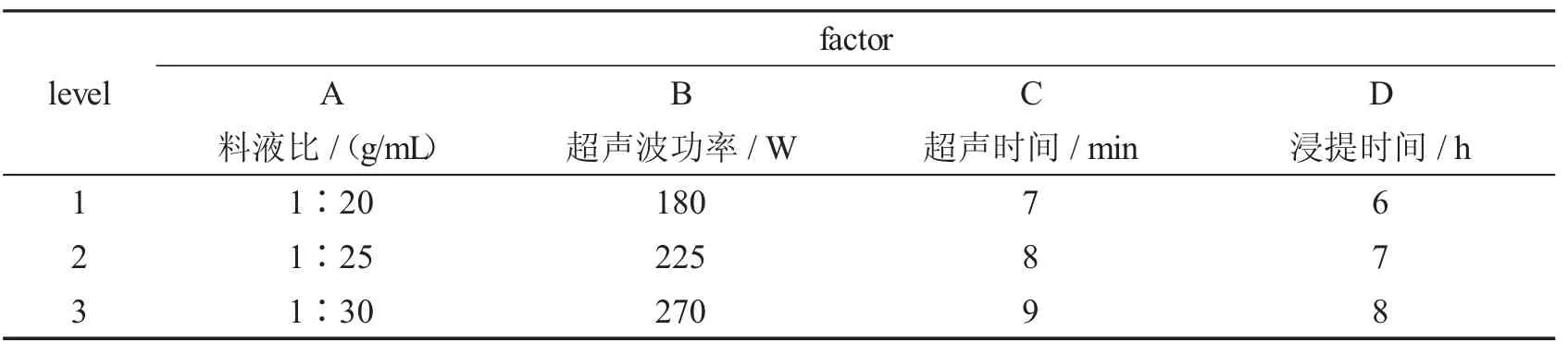
表1 正交实验设计
3.2.1 正交实验结果分析
根据单因素实验的结果,对超声波提取的条件进行正交实验,其结果如表2 所示.根据极差大小的比较可知,对于超声波提取木棉花SOD 影响因素从大到小依次是:浸提时间>超声功率>超声时间>料液比.而根据表中均值大小可得出超声波提取木棉花SOD 的最佳条件为A3B1C3D3,从方差分析(表3)的结果可知,由于各因素对木棉花SOD总活性的影响都不显著,不必再进行各因素之间的多重比较.因此,料液比为1∶30,超声波功率为180 w,超声时间9 min,浸提时间8 h 的超声波提取效果最理想.
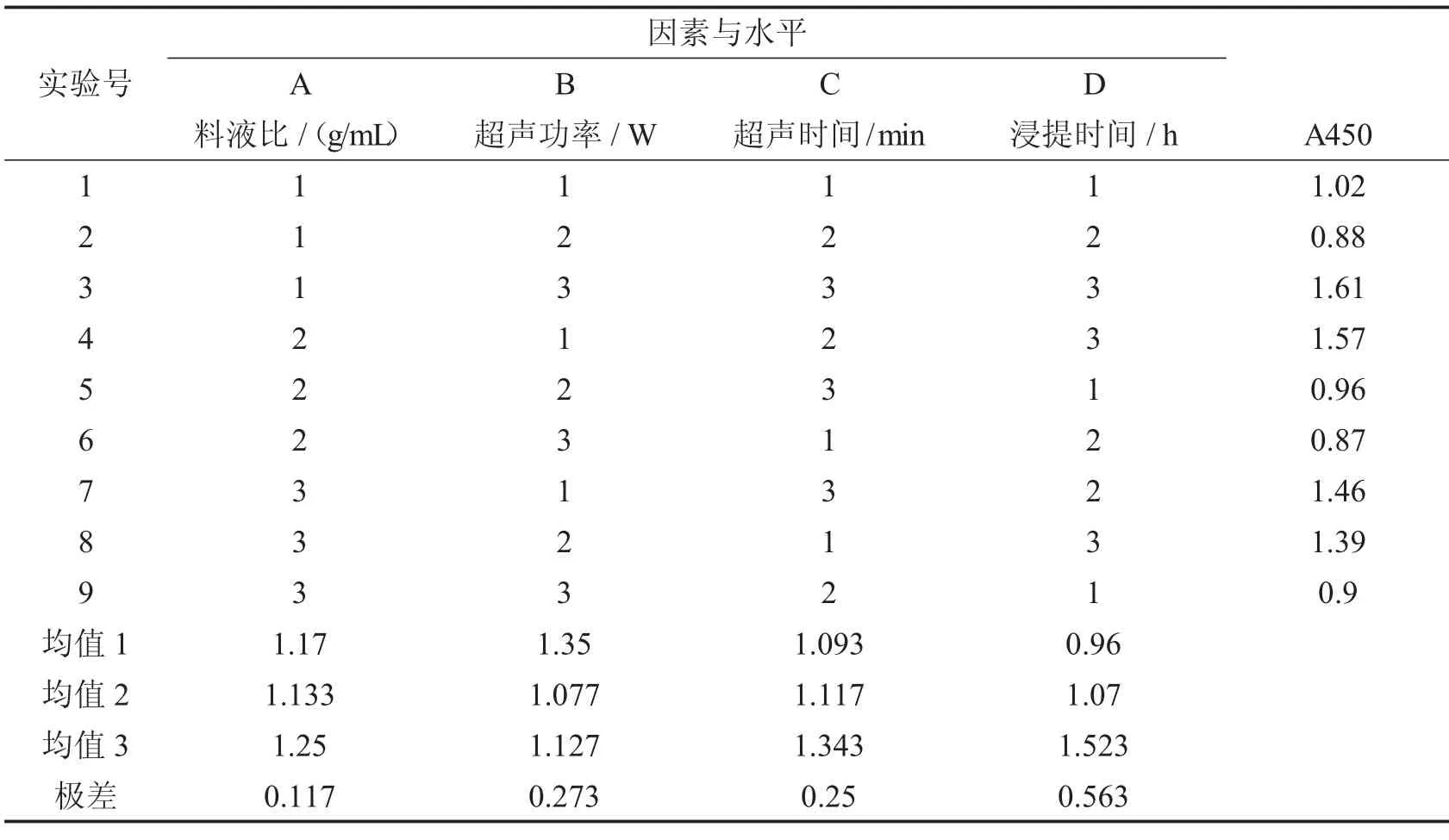
表2 正交实验的极差分析结果
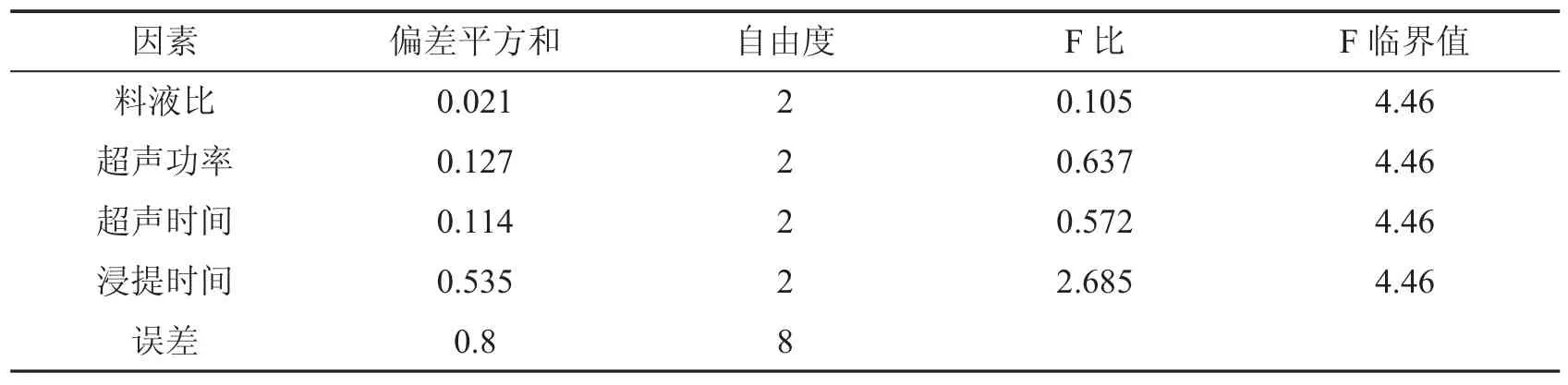
表3 F检验分析结果
3.3 两种提纯方法结合的探究
超声波提取木棉花SOD 后,为了尽可能地除去杂蛋白获得纯化的SOD,目前大多采用两种方法进行纯化,例如通过热变性结合丙酮沉淀法,或氯仿- 乙醇法结合丙酮沉淀法[1-2,12].由于本研究材料为木棉花其蛋白质含量少,通过二种不同的方法处理之后,虽然除去了一定量的杂蛋白,但是SOD 的活性损失更大,导致最终纯化倍数小于1,因此两种提纯方法结合,不适合用于木棉花SOD 的纯化,结果如表4.

表4 两种提纯方法结合的结果
3.4 SOD提纯方法的筛选
根据实验材料的情况,探究出针对该材料最合适的纯化条件.本研究结果如表5,表明利用热变性,氯仿-乙醇,丙酮沉淀三种方法均能够有效地纯化SOD,去除一定量的杂蛋白.热变性法相较于其他两种方法而言,酶活性回收率高,但是处理过后的粗酶液中仍然含有较多的杂蛋白.氯仿-乙醇法进行提纯,因氯仿毒性强,后续还需要透析处理,步骤较为繁琐[2].而丙酮沉淀法蛋白去除率高,其毒性也较小,是较为理想的提纯方法.因此,在后续提纯SOD 时采用丙酮沉淀法并进行条件优化.
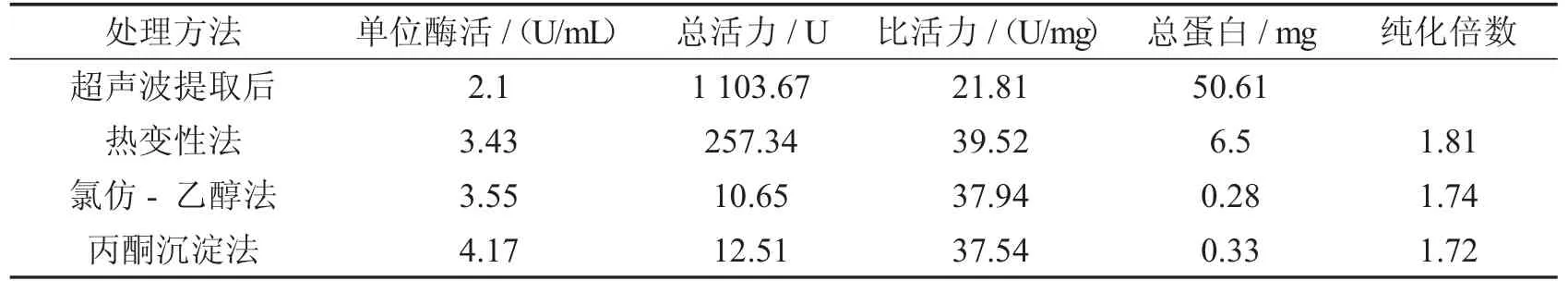
表5 SOD提纯方法的处理结果
3.5 丙酮沉淀条件的优化
丙酮沉淀法对SOD 进行纯化.首先优化纯化条件,选择合适的处理方法如表6.由于丙酮是有机溶剂,会导致蛋白质变性,处理时间一般为15 min.根据表6 表明(三种沉淀方法的实验操作见2.3.3),丙酮等电点沉淀的结果最优,纯化倍数达5.79,所以采用丙酮等电点沉淀进行纯化是最合适的方案.
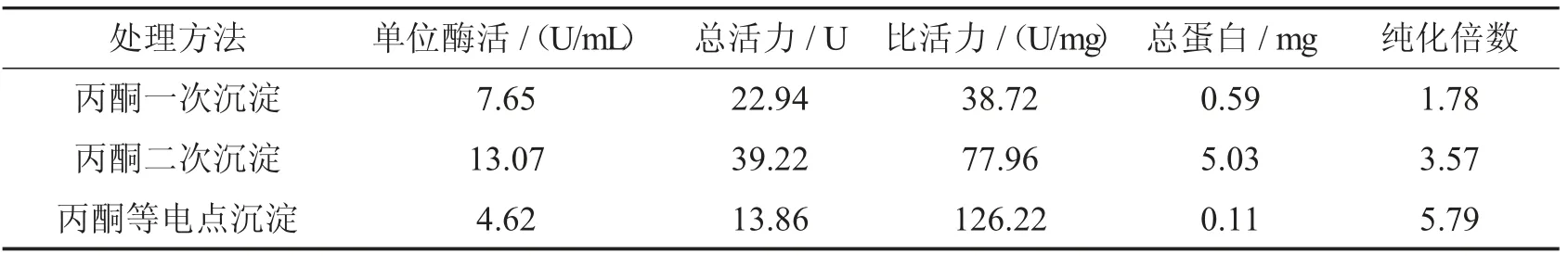
表6 丙酮沉淀条件优化的结果
3.6 确定最佳纯化条件
经上述探究,确定木棉花SOD 的提取纯化方案为:超声波处理,丙酮等电点沉淀除去杂蛋白,经SephadexG-75(洗脱曲线如图7 所示)进行纯化后,真空冷冻干燥获得成品,结果如表7 所示,纯化倍数可达18.46,因此该工艺流程能够有效地将木棉花SOD 提纯出来.
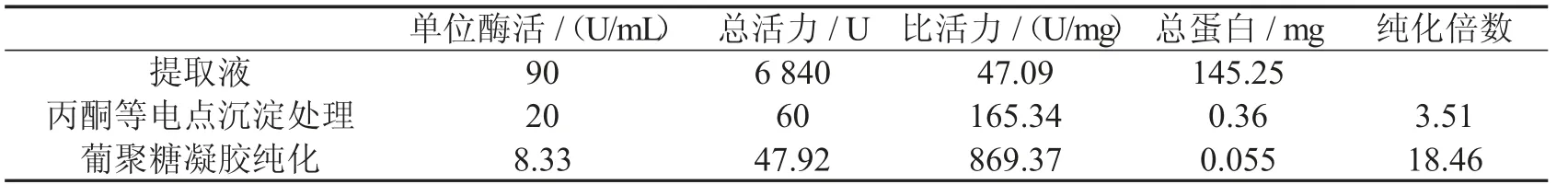
表7 最终提纯方案的结果
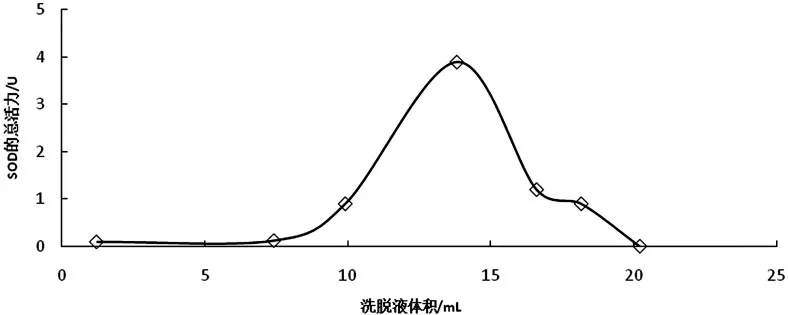
图7 葡聚糖凝胶层析的洗脱曲线
4 总结和展望
SOD 通过清除自由基在食品,化妆品,农业等方面具有广泛的应用,市场前景广阔,但能从植物中提取SOD 的原材料较少,主要包括紫草,绿豆,大蒜等.有关木棉花SOD 提取工艺的研究报道极少,因此本项目利用木棉花为原料能够为植物SOD 的提取开拓新途径[13].根据相关文献报导,木棉花SOD 的活性较高,是较为理想的提取原料[14].本项目通过正交实验确定超声波提取木棉花SOD 的最佳条件为料液比1∶30 g/mL,功率180 w,总处理时间9 min,浸提时间8 h.在提纯SOD 方面,目前采用的方法主要有:热变性法,氯仿-乙醇法,丙酮分级沉淀法.根据实验结果可知,在具体提纯过程中,需要根据实验材料的情况,选择合适的纯化方法,或者将这几种方法有效地结合起来,探究出针对该材料最合适的纯化条件.目前大多数的研究是通过二种方法结合起来充分除去杂蛋白[2,15],而对于蛋白质含量较少的植物样品,如本研究的木棉花花瓣,选用丙酮等电点沉淀进行除杂,纯化效果好,提取条件温和,适用于大规模生产.本研究致力于开发利用廉价材料生产SOD,提纯条件的优化将对进一步规模生产木棉花SOD提供理论依据.

