黄瓜花叶病毒在甜瓜种子中的带毒检测及脱毒方法研究
韩 剑,肖 力,罗 明,潘亚南,宁 轩
(1.新疆农业大学 农学院,乌鲁木齐 830052;2.新疆自治区高校农林有害生物监测与安全防控重点实验室,乌鲁木齐 830052)
中国甜瓜种植面积和总产量居世界首位。新疆是甜瓜(厚皮甜瓜)的优势产区,其味甜色美,品质独特,素有“瓜中之王”的美称,是享誉国内外的名优特产。病毒病是当前新疆甜瓜生产中的首要病害,发生普遍、流行严重,造成甜瓜含糖量降低,品质低劣,经济效益下降,很大程度上制约了甜瓜产业的发展。
国内外报道危害瓜类作物的病毒已达86种之多[1],其中在中国危害严重的主要有小西葫芦黄花叶病毒 (Zucchini yellow mosaic virus,ZYMV) 、西瓜花叶病毒 (Watermelon mosaic virus,WMV) 、CMV、甜瓜坏死斑点病毒 (Melon necrotic spot virus, MNSV)、番木瓜环斑病毒 (Papaya ringspot virus,PRSV) 、南瓜花叶病毒(Squash mosaic virus,SqMV)等[2]。2016年潘亚南等[3]对新疆吐鲁番、鄯善、昌吉哈密瓜产区病毒病进行检测,检出CMV、 WMV、 ZYMV和MNSV,其中CMV是优势毒原,检出率最高70%。李继洋等[4]运用多重RT-PCR技术检测新疆南、北疆16个地区(市)哈密瓜主栽区的病毒病发生及分布,发现WMV、CMV、ZYMV3种病毒发生普遍。古勤生[2]发现,CMV现在中国北方地区葫芦科作物病毒病样本中的检出率仅次于WMV和ZYMV,是危害葫芦科作物的主要病毒之一。
黄瓜花叶病毒(CMV)寄主广泛,能侵染85科、365属、1000种以上的单、双子叶植物,是目前世界范围内发生最普遍、分布最广、危害最严重的植物病毒之一。CMV是典型的种传病毒[5]。携带病毒的种子不仅形成带毒幼苗作为病毒病害发生的初侵染源,再经昆虫媒介的二次传播形成发病中心,引发病毒病大面积爆发。新疆是全国最大的西瓜和甜瓜制种基地,承担着多家大型跨国种业公司制种任务,带毒种子随种子调运和种质资源交流远距离传播扩散,对病毒病的发生、传播影响极大。因此,加强种子检测、采取有效的种子脱毒处理措施,从源头杜绝病原是控制种传病毒病发生蔓延和安全防控的重要举措,具有事半功倍的成效。采用干热处理、温汤浸种、辐射、化学药剂等种子处理技术具有钝化、脱除种子携带病毒的作用,是一种减轻病毒病害的经济有效的措施。日本和韩国采用种子脱毒处理技术在有效控制瓜类检疫性种传病毒黄瓜绿斑驳花叶病毒(Cucumber greenmottle mosaic virus, CGMMV)方面取得了良好的效果。张竹青[6]试验比较了8种辣椒种子处理方式对CMV、烟草花叶病毒(Tobacco mosaic virus,TMV)的防治效果。任琛荣等[7]应用多重PCR技术检测籽用西葫芦种子的CMV、ZYMV及WMV带毒情况及热处理的脱毒效果,针对不同病毒、不同种子采取的脱毒方法不同,脱毒效果各异。对新疆甜瓜种子的CMV带毒及有效脱除病毒的研究尚未见报道。
本研究采用实时荧光定量PCR技术检测甜瓜种子中的CMV带毒率,比较不同种子处理方法对种子携带CMV的脱除效果,明确脱除种子携带CMV的有效措施,为甜瓜病毒病害的安全、高效防控提供科学基础和技术支持。
1 材料与方法
1.1 材 料
1.1.1 供试甜瓜种子 ‘春潇2号’‘优密17号’‘欣丰密’‘楼兰17号’‘春秋17号’均采自新疆维吾尔自治区葡萄瓜果研究所甜瓜试验地,‘春秋17号’采自五家渠102团病毒病发生病田。将采集的不同品种甜瓜内的种子剖出,自然阴干后,保存于4 ℃冰箱中,冷藏期10~12个月。
1.1.2 试剂 TRNzol总RNA提取试剂、Quant cDNA第1链合成试剂盒、普通琼脂糖凝胶DNA回收试剂盒(TIANgel Midi Purification Kit)、质粒小提试剂盒(TIANprep Mini Plasmid Kit)、氨苄青霉素、X-gal、IPTG等购于北京天根生化科技有限公司。pEASY-T1连接试剂盒与Trans-T1感受态细胞购于北京全式金生物科技有限公司。限制性内切酶EcoR Ⅰ为Promega公司产品。Maxima SYBR Green/ROX qPCR Master Mix购于Thermo公司。
1.2 方 法
1.2.1 CMV的SYBR Green Real-time PCR 定量检测体系 利用已建立和优化的CMV SYBRGreen Real-time PCR检测体系。CMV正向引物序列(5′→3′):AGTCCGTAAAGTTCCTGC,反向引物序列(5′→3′)TCATGTCGCCAATATCA,目标片段180 bp。反应体系(20 μL):Maxima SYBR Green/ROX qPCR Master Mix(2×)10 μL;引物各0.4 μL(10 μmol/L);模板1 μL;补足ddH2O至20 μL。反应条件为:50 ℃预热 2 min;95 ℃预变性4 min;95 ℃变性30 s, 60 ℃退火30 s,72 ℃延伸1 min,共40个循环。
1.2.2 CMV定量检测标准曲线的建立 以构建的CMV-CP基因阳性克隆质粒(质粒质量浓度测定为155.16 ng/μL,相应的拷贝数为7.87×1011拷贝/μL)的10×梯度稀释液(100~109)为模板进行SYBR Green实时荧光定量PCR反应扩增,观察其溶解曲线。根据质粒拷贝数的对数和循环数(Ct值)之间的动力学曲线,得到定量检测的标准曲线方程。
对建立的标准曲线做重复性检测。以CMV-CP基因阳性克隆质粒的稀释液为模板,进行3次重复性试验扩增,根据Ct值的变异系数来检验所建立体系的重复性和稳定性。
1.2.3 甜瓜种子、胚芽和种苗的带毒检测 甜瓜种子、胚芽和种苗总RNA 的提取和cDNA的合成:种子,各品种均取30粒种子,无菌水浸泡过夜后带种皮提取总RNA。胚芽,取待测甜瓜品种各30粒浸泡后,置于灭菌培养皿中(皿底铺有滤纸保湿,28 ℃催芽,待胚芽长出1~1.5 cm时,取胚芽提取总RNA。种苗,将甜瓜种子催芽后播种于装有高温灭菌土壤的花盆中,培养于防虫温室中。幼苗生长至3~4片真叶时,取叶片提取总RNA。每个品种测定30株幼苗。
采用TRNzol试剂盒提取总RNA。同时提取已检测感染CMV和健康的甜瓜叶片总RNA分别作为阳性和阴性对照。利用Quant cDNA第1链合成试剂盒对提取的总RNA进行反转录获得cDNA。
带毒率和带毒量检测:以提取的甜瓜种子RNA反转录cDNA为模板,利用所建立的CMV SYBR Green实时荧光定量PCR检测体系对甜瓜种子带毒情况进行检测,同时设置感病和健康甜瓜叶片样品cDNA分别为阳性和阴性对照,以超纯去离子水为空白对照。
统计带毒率:带毒率=(检出病毒种子数/抽检种子总数)×100%
将检出阳性样品的Ct均值代入标准方程,计算种子带毒量。
1.2.4 甜瓜种子脱毒处理 对检测出携带CMV的种子,分别通过以下5种方法进行处理(各处理30粒种子),重复3次。
(1)干热处理:在65 ℃条件下,热风处理甜瓜种子48 h;(2)湿热处理:将待脱毒处理的甜瓜种子放在沸水(100 ℃)中(沸水体积大约为种子体积的5倍),快速振荡使其在沸水中冷却;(3)温汤处理:用55 ℃的温水浸种40 min;(4)干热+湿热处理:先将甜瓜种子在65 ℃条件下热风处理48 h,之后将种子浸于5倍于种子体积的沸水中,快速振荡使其冷却;(5)干热+10%Na3PO4处理:在65 ℃条件下,热风处理种子48 h,之后用10%的Na3PO4溶液浸种40 min。
1.2.5 种子及种苗脱毒效果检测 种子脱毒检测:不同处理种子总RNA的提取及cDNA的合成方法同“1.2.3”。采用CMV SYBR Green实时荧光定量PCR检测体系对处理种子进行带毒量检测,计算脱毒率。以未经热处理及室温灭菌水浸泡的种子为对照。
脱毒率=(1-处理后的带毒量/处理前种子带毒量)×100%。
种子幼苗脱毒检测:对干热处理和干热+Na3PO4处理后的种子幼苗进行脱毒效果检测。将干热处理和干热+Na3PO4处理后的种子先进行催芽,待出芽后分别播种于塑料育苗钵中,育苗基质为灭菌土,人工气候箱中常规培养。幼苗生长至3叶1心时检测叶片带毒量,方法同“1.2.5”。
1.2.6 脱毒处理种子发芽试验 处理后种子先用流水洗净,然后冷水浸泡4 h,将种子取出放入培养皿中发芽,培养皿垫一层滤纸,加适量灭菌水,加盖放在恒温培养箱中发芽,发芽温度为 28 ℃,第3天统计发芽数,计算发芽势,第7天统计发芽数,计算发芽率,发芽的标准为种子露白。不作处理的种子用冷水浸泡4 h作为对照。
1.3 数据分析
试验数据用EXCEL 2016和SPSS 22.0 软件分析,比较各处理间的差异显著性。
2 结果与分析
2.1 CMV Real-time PCR定量检测标准曲线的建立
以CMV-CP阳性重组质粒不同质量浓度所对应的拷贝数的对数值为横坐标,循环数(Ct值)为纵坐标构建CMV SYBR Green实时荧光定量PCR标准曲线(图1)。由图1可以看出,CMV阳性质粒模板不同质量浓度对应的拷贝数的log值与Ct値之间具有良好的线性关系,得到CMV标准曲线方程y=-3.987 2x+54.128(R2= 0.998 7),可用于对供试样品病毒含量的定量分析。
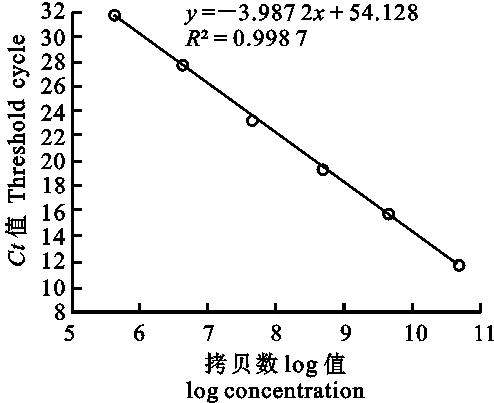
图1 CMV定量检测标准曲线Fig.1 Standard curve of CMV quantitative detection

表1 实时荧光定量PCR对样品的重复性检测Table 1 Repetitive detection of same samples by Real-time PCR
对建立的标准曲线做重复性检测(表1),对CMV-CP基因阳性克隆质粒同一稀释液模板的3次扩增Ct值误差不到1个循环,Ct值变异系数(CV)为1.52%。结果表明,本研究所建立的CMV实时荧光定量PCR检测体系的重复性较好,能够保证不同样品间检测结果的可靠性和稳定性。
2.2 对甜瓜种子、胚芽和种苗中CMV带毒检测
对供试甜瓜种子、胚芽和种苗中CMV带毒状况进行定量检测,结果见表2。不同品种的甜瓜种子、胚芽和种苗中CMV带毒率、带毒量差异较大。种子带毒率为80%~96.6%,带毒量为 6.62×104~5.47×107拷贝/粒。其中‘优密17号’‘楼兰17号’和‘欣丰密’带毒率均高达 96.6%,‘春潇2号’带毒率相对较低,但带毒量最高。胚芽带毒率为5.0%~25.0%,带毒量为 3.78×104~1.00×106拷贝/粒。‘优密17号’胚芽带毒率和带毒量均为最高,‘欣丰密’则为最低。种苗带毒率0~6.6%,带毒量0~4.59×104拷贝/粒,‘春秋17号’种苗带毒率和带毒量均为最高,而‘优密17号’种苗中未检出阳性株。
检测结果表明,CMV在甜瓜种子、胚芽和种苗中的带毒率和带毒量差异显著。种子的CMV带毒率(均值92%)和带毒量(均值9.74×106拷贝/粒)均为最高,其次是胚芽,带毒率(均值 13.00%)和带毒量(均值1.16×105拷贝/粒)显著减少;种苗为最低,其带毒率(传毒率)为 3.30%(均值),带毒量为4.18×104拷贝/粒(均值)。
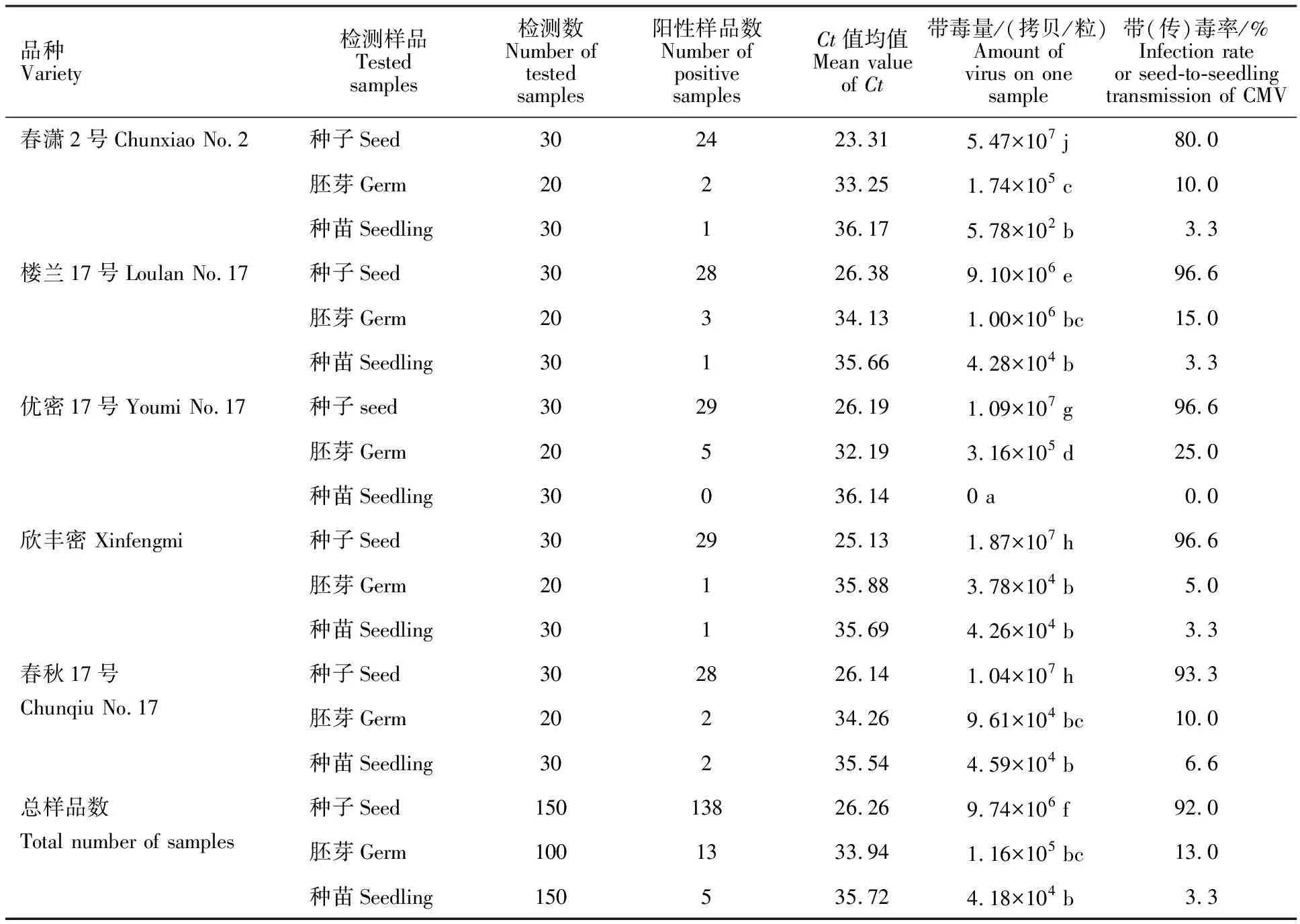
表2 实时荧光定量PCR对甜瓜种子、胚芽和种苗中CMV病毒的检测结果Table 2 Detection results of CMV in seeds,plumule and seedlings of melon by real-time PCR assay
注:同列不同字母表示经ANOVA检验在P<0.05水平差异显著,下同。
Note:Data with different letters in the same column indicate significant difference atP<0.05 level by ANOVA test,the same below.
2.3 对甜瓜种子中CMV的脱除效果
分别采用干热、湿热、温汤、干热+湿热及干热+10%Na3PO4处理CMV带毒量较高的‘春潇2号’甜瓜种子。由表3可见,各处理方法均能在一定程度上降低种子带毒量,脱毒率为 49.77%~98.93%,不同处理的脱毒效果差异较大。干热、湿热、干热+湿热和干热+10%Na3PO4处理甜瓜种子的效果较好,脱毒率均达到了96%以上,显著优于温汤处理(P<0.05),干热处理可达98.93%,脱毒效果最佳。温汤处理的脱毒效果最差,脱毒率仅为49.77%。
干热和干热+10%Na3PO4处理后的种子脱毒率均可达98%以上(表3)。进一步检测其种子处理后对种苗的脱毒率,结果见表4,未经处理的种苗带毒率为4.44%,但干热处理其幼苗传毒率可达3.33%,带毒量4.57×105copies/g 鲜质量,而种子经干热+10%Na3PO4处理后,其幼苗中检测不出病毒,可完全脱除病毒。
2.4 脱毒处理对种子发芽率和发芽势的影响
对脱毒处理后的甜瓜种子,测定其发芽率和发芽势的变化,结果如图2所示。除温汤处理外,其他处理的种子发芽率和发芽势均高于对照组,对种子发芽有一定的促进作用。干热+湿热和干热+10%Na3PO4处理能明显提高种子的发芽率,对种子的发芽势影响不大。温汤处理对种子发芽有一定的抑制作用,降低了种子的发芽率和发芽势。
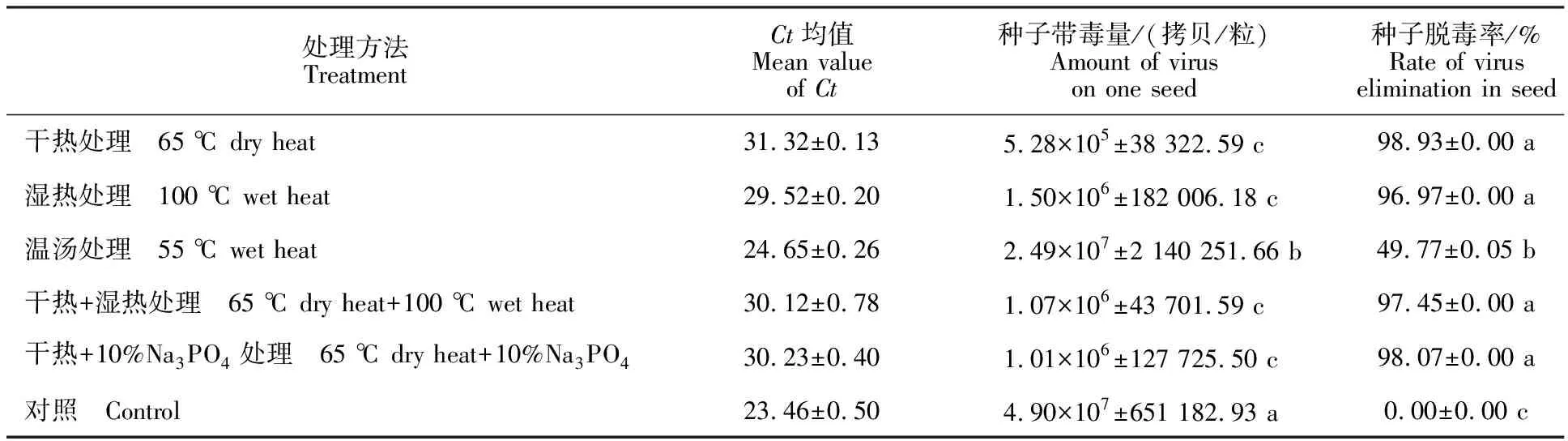
表3 不同处理对甜瓜种子中CMV脱毒效果的影响Table 3 Effect of different treatments on elimination CMV in melon seeds
注:数据为3次重复试验的“平均数±标准差”。
Note: Data represent “mean ± SD”.
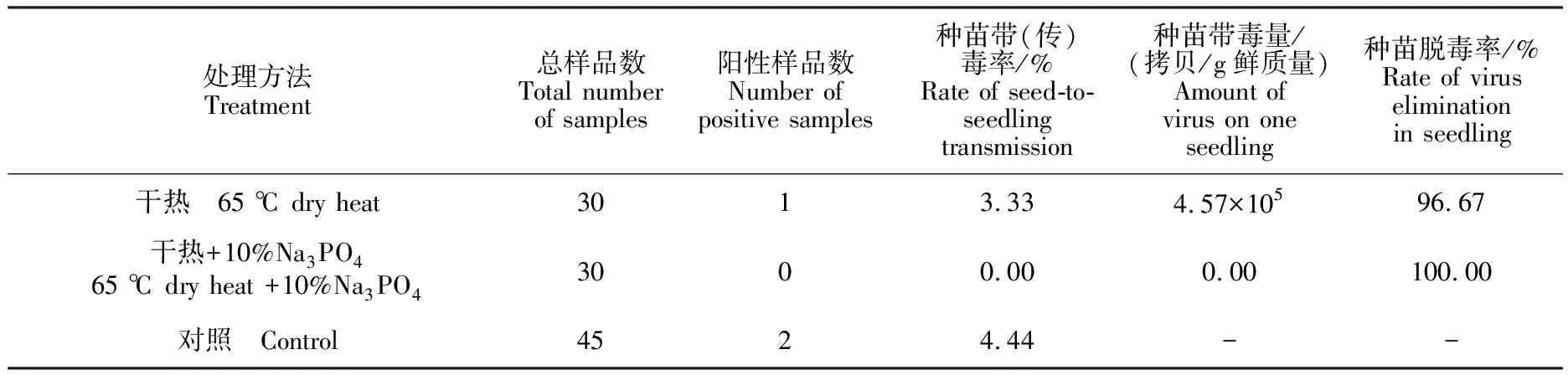
表4 不同处理对种苗中CMV病毒脱除效果的影响Table 4 Effect of different treatments on elimination CMV in melon seedlings
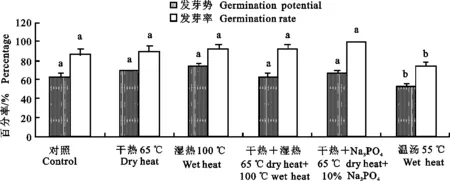
图上不同字母表示差异显著(P<0.05) Different lowercase letters indicate significant difference(P<0.05)
3 讨 论
3.1 甜瓜种子中CMV的带毒率和传毒率
本研究采用Real-time PCR技术对甜瓜种子CMV的携带情况进行定量检测,结果表明,供试甜瓜种子均能检出CMV,其带毒率(均值92%)和带毒量(均值9.43×104拷贝/粒)均较高,不同品种有一定差异。携带病毒的种子能否形成感染病毒的幼苗造成病毒在田间传播的初侵染源受多种因素的影响。研究认为,种子传播病毒不仅受病毒本身、带毒量、带毒部位的影响,还与作物品种、感病时间、环境条件以及病毒-植物互作有关[8]。Akhtar等[9]试验发现,CMV侵染辣椒后检测辣椒种子表皮带毒率为53%~83%,而生长试验检测传毒率平均为10%~14%,种子表皮带毒率比种子传毒率高很多,主要以种皮带毒为主。研究表明,大多数病毒在种皮或胚乳带毒通常不能通过种子传毒,只有病毒在母株幼苗期和授粉前侵染进入种胚,产生的带毒种子才具有种传特性[10],因此将种胚与种皮分开后进行检测,方能获得准确的种传率。本研究通过检测甜瓜整粒种子、发芽种子的胚芽和种苗的CMV带毒状况,发现胚芽的带毒率(均值13.00%)、带毒量(3.04×103拷贝/粒)都远低于种子,表明CMV主要存在于甜瓜种子的种皮上。供试的甜瓜种苗传毒率为 0~6.6%(均值4.4%),其胚芽带毒率、带毒量与种苗传毒率具有一定的相关性。但也有例外,如‘优密17号’的胚芽带毒率(25%)、带毒量 ( 7.86×103拷贝/粒)均为最高,但在种苗中却并未检出带毒病株。据报道,黑眼豇豆花叶病毒唯有当其侵染寄主胚轴组织时,才能导致种子传毒[11]。同一病毒在植物的不同品种中的传毒情况也不同,CMV能通过野生黄瓜种子传毒,却不能通过栽培品种的黄瓜种子传毒[12],可见病毒的侵染、存在部位与种传率的关系较为复杂。在本研究中,CMV主要是通过甜瓜种子的胚芽、胚轴或其他部位传毒,可否通过甜瓜种皮传毒,‘优密17号’是否能种传CMV等均需经反复试验证实。
不少研究表明,大多数种传病毒的传毒率不高。本研究测定的5个品种的甜瓜种子对CMV的平均传毒率为3.3%,不同品种种子的传毒率存在差异。任琛荣等[7]检测籽用西葫芦种子幼苗的CMV传毒率,7个品种种子的CMV的平均传毒率为67.1%,‘绿丰9号’(92%)最高,而‘粒丰9号’最低(50%),远高于甜瓜种子的CMV传毒率。这种差异可能是由于CMV感染寄主时期不同从而引起种子感染病毒的程度和部位的不同,也可能与CMV毒株的株系不同有关。此外,有试验发现,感染CGMMV黄瓜种子收获后1个月检测种传率为8%,但种子保存5个月后种传率降低到0.1%[13]。本研究中的甜瓜种子保存已近1 a,可能也会影响其传毒率改变。研究结果均说明不同寄主对同种病毒的传毒率不同,同一病毒的不同分离物对同种寄主传毒率也会改变。
3.2 甜瓜种子中CMV的脱毒方法及效果评价
种子处理方式主要包括温汤浸种、微波处理、干热空气处理和化学药剂处理等[14]。Rast等[15]利用热空气处理、干热处理、10%磷酸钠处理带有辣椒花叶病毒(Capsicum mosaic virus,CaMV)的辣椒种子,76 ℃处理3 d并贮存3个月后,可有效灭活种子中的病毒,但严重影响种子萌发。用热空气处理(74 ℃处理48 h或80 ℃处理24 h)番茄种子,消除其携带的柏平缕瓜花叶病毒(Pepino mosaic virus,PepMV),能基本灭活病毒,而在钝化病毒的同时,也影响到了种子萌发[16]。因此,在种子脱毒处理中,如何确定钝化病毒的技术指标,做到既能最大限度地钝化病毒,又不降低种子的发芽活力是一个关键问题。
目前,常用的种子脱毒效果的检测方法主要有种植幼苗症状观察、再对显症幼苗结合PCR检测验证等,较费时耗力,还容易受季节、培养条件的限制,也还不能排除一些带毒种子不形成显症幼苗的假阴性现象,存在稳定性差、只能定性检测及灵敏度有限等缺点,不能对处理后的种子中的病毒进行精确定量,因此,无法精准确定钝化病毒的技术指标。本研究采用5种方法对甜瓜种子进行脱毒处理,利用SYBR Green实时荧光定量PCR检测技术对处理后的甜瓜种子中CMV病毒进行定量检测。结果表明,各种处理方法均能在一定程度上降低种子带毒量,脱毒率为 49.77%~ 98.93%,不同处理的脱毒效果有较大差异。干热、干热+湿热和干热+10%Na3PO4处理都可达到97%以上的脱毒率,且都能明显提高种子的发芽率,对发芽势影响不大。其中干热处理效果最佳。温汤处理不仅脱毒效果较差,还对种子发芽有一定的抑制作用。任琛荣通过相对定量法测定了不同温度条件下湿热和干热处理对西葫芦种子携带病毒的钝化效果,试验结果表明40 ℃湿热处理24 h、70 ℃干热处理72 h条件下脱除CMV效果最好(96%),但种子的发芽率和发芽势降低。本试验脱毒效果最佳的干热处理条件(65 ℃,48 h)与任琛荣不同,其结果各异。可见,针对不同种的葫芦科种子携带相同种类病毒的试验处理条件存在较大差异,其最佳脱除处理条件均需经过严格的试验才能确定。
降低种传病毒危害的关键是减低种苗的传毒率,以减少病毒初侵染源。本研究发现,干热处理后的甜瓜种子幼苗传毒率可达4.44%,而干热+10%Na3PO4处理的种子幼苗中检测不出病毒,表明该方法能更有效去除种胚内的病毒,降低幼苗传毒率,具有最佳的脱毒效果。

