2-氨基-5-芳基-1,3,4-噻二唑的合成及抑菌活性研究
王德志,冯吉利,陈淑伟,麻妙锋
(1.西北农林科技大学 化学与药学院,陕西杨凌 712100;2.西北农林科技大学 生命科学学院,陕西杨凌 712100)
1,3,4-噻二唑是含有“-N=C=S”结构骨架的五元杂环化合物(图1),其衍生物良好的理化性质和高效低毒的生物活性被广泛地应用于农药和医药领域[1-8]。早在20世纪70年代日本武田制药公司(Takeda)就发现,2-氨基-1,3,4-噻二唑 (敌枯唑,ATDA,图1) 对由黄单孢杆菌引起的植物病害有很好的防治效果。中国自主研制的杀菌剂2-氨基-5-巯基-1,3,4-噻二唑铜 (噻菌铜,thiodiazole-copper,图1) 以其低毒广谱的特性,被广泛应用于粮食作物、果蔬等细菌性病害的防治[9-11]。目前,以 l,3,4-噻二唑基团作为基本活性结构骨架,通过在2-位或5-位引入其他活性基团,期望实现2个活性分子的活性叠加和优化。这种活性基团拼接法对噻二唑类化合物的开发和应用以及新型药物的合成都具有一定的指导意义,文献关于含有砜、亚砜、硫醚、磺胺等含硫基团以及噁二唑等杂环的 l,3,4-噻二唑类衍生物的生物活性报道较多,而含氟原子及其他芳香杂环的生物活性尤其是农用抑菌活性的文献相对较少[12-15]。为了扩展1,3,4-噻二唑类衍生物的抑菌谱,本文利用芳香醛和氨基硫脲为起始原料进行反应,在5-位引入具有代表性的含氟、呋喃和噻吩基团的2-氨基-1,3,4-噻二唑类衍生物,并以5种重要的植物病原真菌为靶标对目标化合物进行抑菌活性的初步研究,希望通过改变5-位基团的类型,筛选出具有更广谱和更高抑菌活性的化合物。
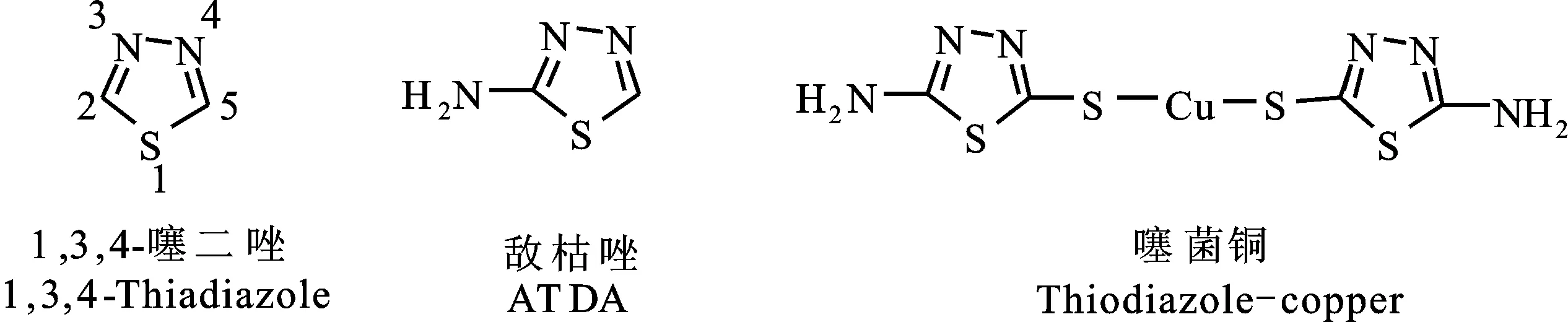
图1 1,3,4-噻二唑结构及含有此结构单元的药用化合物Fig.1 Structural unit of 1,3,4-thiadiazole and pharmacologically compounds containing 1,3,4-thiadiazole units
1 材料与方法
1.1 仪器与试剂
仪器:Bruker Avance 型核磁共振谱仪 (TMS 为内标,1H NMR 为 500 MHz、13C NMR 为 125 MHz,美国 Bruker 公司生产);SGW○RX-4B 型显微熔点仪;Thermo LCQ Fleet 型电喷雾电离低分辨质谱仪(LC-ESI-MS)。
材料与试剂:GF254型薄层层析硅胶、200~300 目柱层析硅胶均为青岛海洋化工厂生产;所用试剂苯甲醛、邻氟苯甲醛、对氟苯甲醛、间氟苯甲醛、2-呋喃甲醛、2-噻吩甲醛、氨基硫脲,一水合柠檬酸,二水合柠檬酸钠,六水合三氯化铁等均为 AR 级国产试剂,使用前经常规处理。
1.2 供试病原真菌与培养基
供试病原真菌:马铃薯干腐病菌 (Fusariumcoeruleum)、小麦赤霉病菌 (Fusariumgraminearum)、番茄灰霉病菌 (Botrytiscinerea)、白菜黑斑病菌 (Alternariabrassicae)、烟草赤星病菌 (Alternariaalternate)。
培养基及其配制:选用 PDA 培养基。其配方为:去皮马铃薯 200 g、葡萄糖 20 g、琼脂 20 g、蒸馏水 1 000 mL。配制时取 200 g 去皮马铃薯,切碎煮沸 20 min,趁热过滤后取滤液,加入其余组分定容至 1 000 mL,pH 为自然状态,121 ℃高温灭菌 20 min。
1.3 目标化合物合成路线
目标化合物的合成如图 2 所示。
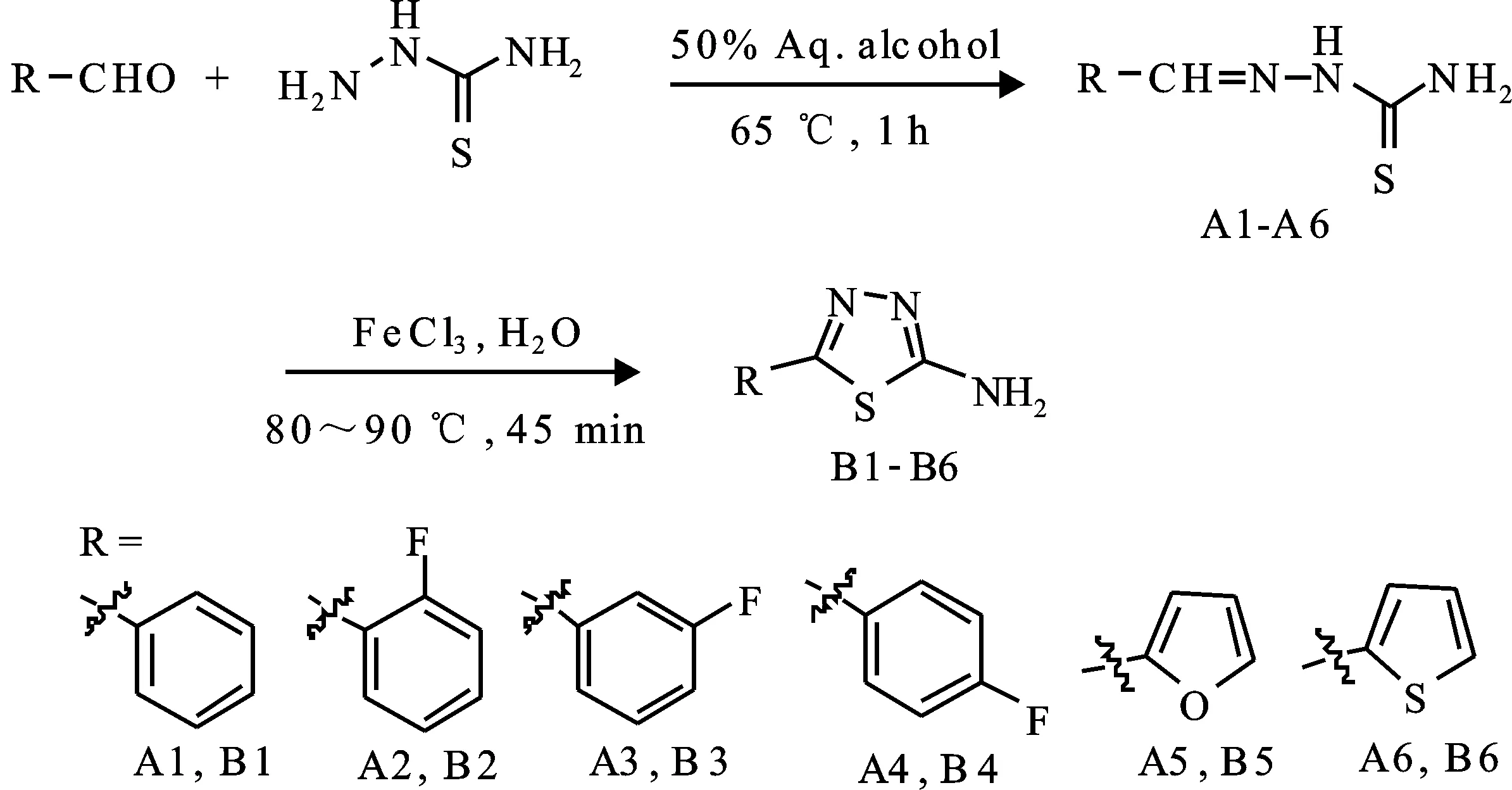
图2 2-氨基-5芳基-1,3,4-噻二唑类化合物的合成路线Fig.2 Synthetic route of 2-amino-5-aryl-1,3,4-thiadiazole derivatives
1.4 目标化合物合成步骤
1.4.1 中间体芳醛缩氨基硫脲(A1-A6)的合成 将氨基硫脲(25 mmol,2.28 g)加入到 40 mL 的蒸馏水中,加热至全溶,然后加入苯甲醛(25 mmol,2.7 mL)的乙醇溶液(40 mL),65 ℃ 搅拌回流反应 1 h,待反应完全后,静置冷却至室温直至白色晶体析出完全,抽滤。粗产物用 160 mLφ= 70% 乙醇溶液重结晶,得白色针状晶体苯甲醛缩氨基硫脲(A1),产率 95 %[16-17]。
A2-A6 的试验步骤与 A1 完全相同,产率 78%~92%。
1.4.2 目标化合物 2-氨基-5-芳基-1,3,4-噻二唑(B1-B6)的合成 将苯甲醛缩氨基硫脲(20 mmol,3.58 g)和 FeCl3· 6H2O(60 mmol,16.2 g)依次加入到 200 mL 蒸馏水中,然后再加入一水合柠檬酸(44 mmol,9.24 g),二水合柠檬酸钠 (20 mmol,5.88 g),加热搅拌全溶后于 80 ℃ 继续回流 45 min 至反应完全。将反应液冷却至室温,用φ=10% 的氨水中和至完全生成沉淀,抽滤。粗产物用φ= 75 % 乙醇重结晶得白色固体 2-氨基-5-苯基-1,3,4-噻二唑(B1)。产率 78%[16-17]。
B2-B6 的试验步骤与 B1 完全相同,产率 65%~72%。
1.5 目标化合物抑菌活性测定
采用生长速率法[18-19]测定目标化合物 B1-B6 对 5 种供试植物病原真菌的抑菌活性。首先将目标化合物配制成质量浓度为 100 μg·mL-1带药 PDA 培养基,然后倒入高温灭菌的培养皿中,待培养基凝固后,接种供试菌饼 (直径 5 mm),每个处理设 3 个重复,25 ℃ 培养 3 d,用十字交叉法量取菌落扩展直径,计算抑制率。试验以噻菌灵为阳性对照,二甲亚砜为阴性对照。
抑制率 =(阴性对照组菌落直径-处理组菌落直径)/ 阴性对照组菌落直径×100%
对抑菌活性较好的化合物进行抑菌作用的毒力测定,设置质量浓度梯度为:100、50、25、12.5、6.25 μg·mL-1。以目标化合物质量浓度常用对数为横坐标 (x),抑制率的机率值为纵坐标(y),利用 SPSS 19.0 软件分析数据求得毒力回归方程和有效中浓EC50值。
2 结果与分析
2.1 化合物的合成与结构表征
首先利用芳香醛与氨基硫脲反应生成芳香醛缩氨基硫脲,再以FeCl3为氧化剂,在φ= 50% 乙醇水溶液中进行氧化成环。反应过程中加入柠檬酸-柠檬酸钠缓冲溶液,使得反应条件温和,时间较短。最后滴加氨水调节溶液pH促使产物沉淀完全,提高产率。对化合物 A1-A6和B1-B6 分别进行1H NMR与13C NMR分析,证明产物的化学结构,结果如下:
A1:苯甲醛缩氨基硫脲,白色固体,产率 95%,熔点(mp)160~161 ℃。1H NMR (CD3OD)δ8.00 (s,1H,CH=N),7.76~7.75 (m,2H,ArH),7.42~7.41 (m,3H,ArH);13C NMR (CD3OD)δ178.6 (C=S),143.9 (CH=N),134.0 (ArC),129.9 (ArC),128.4 (ArC),127.1 (ArC);LC-ESI-MS:m/z试验值180.00 [M+1]+,理论值 179.05 [M]+。
A2:2-氟苯甲醛缩氨基硫脲,白色固体,产率 92%,mp 179~180 ℃。1H NMR (CD3OD)δ8.25 (s,1H,CH=N),8.07 (t,J=7.3 Hz,1H,ArH),7.44~7.43 (m,1H,ArH),7.23 (t,J=7.4 Hz,1H,ArH),7.16 (t,J=9.5 Hz,1H,ArH);13C NMR (CD3OD)δ178.9 (C=S),161.6 (d,J=250.9 Hz,ArC),136.4 (d,J=5.3 Hz,CH=N),131.6 (d,J=8.4 Hz,ArC),126.4 (d,J=2.3 Hz,ArC),124.3 (d,J=3.5 Hz,ArC),121.7 (d,J=9.8 Hz,ArC),115.4 (d,J=21.2 Hz,ArC);LC-ESI-MS:m/z试验值 198.06 [M+1]+,理论值 197.04 [M]+。
A3:3-氟苯甲醛缩氨基硫脲,白色固体,产率 90%,mp 191~192 ℃。1H NMR (CD3OD)δ7.98 (s,1H,CH=N),7.60 (d,J=9.9 Hz,1H,ArH),7.52~7.51 (m,1H,ArH),7.46~7.41 (m,1H,ArH),7.15 (t,J=8.3 Hz,1H,ArH);13C NMR (CD3OD)δ178.9 (C=S),163.1 (d,J=244.9 Hz,ArC),142.2 (d,J=2.8 Hz,CH=N),136.6 (d,J=8.0 Hz,ArC),130.2 (d,J=8.2 Hz,ArC),123.5 (d,J=2.6 Hz,ArC),116.5 (d,J=21.9 Hz,ArC),112.7 (d,J=23.1 Hz,ArC);LC-ESI-MS:m/z试验值198.05 [M+1]+,理论值197.04 [M]+。
A4:4-氟苯甲醛缩氨基硫脲,白色固体,产率 90%,mp 192~194 ℃。1H NMR (CD3OD)δ7.99 (s,1H,CH=N),7.80 (t,J=7.0 Hz,1H,ArH),7.16 (t,J=8.3 Hz,1H,ArH);13C NMR (CD3OD)δ178.6 (C=S),163.9 (d,J=249.2 Hz,ArC),142.6 (CH=N),130.5 (d,J=2.9 Hz,ArC),129.2 (d,J=8.5 Hz,ArC),115.4 (d,J=22.3 Hz,ArC);LC-ESI-MS:m/z试验值198.00 [M+1]+,理论值197.04 [M]+。
A5:2-呋喃甲醛缩氨基硫脲,淡棕色,产率 80%,mp 152~153 ℃。1H NMR (CD3OD)δ7.89 (s,1H,CH=N),7.66 (s,1H,ArH),6.87 (s,1H,ArH),6.58 (s,1H,ArH);13C NMR (CD3OD)δ178.5 (C=S),149.5 (CH=N),144.7 (ArC),133.3 (ArC),113.1 (ArC),111.7 (ArC);LC-ESI-MS:m/z试验值170.00 [M+1]+,理论值 169.03 [M]+。
A6:2-噻吩甲醛缩氨基硫脲,米黄色,产率 78%,mp 189~191 ℃。1H NMR (CD3OD)δ8.18 (s,1H,CH=N),7.53 (s,1H,ArH),7.38 (s,1H,ArH),7.11 (s,1H,ArH);13C NMR (CD3OD)δ178.2 (C=S),156.5 (CH=N),138.6 (ArC),130.5 (ArC),128.3 (ArC),127.3 (ArC);LC-ESI-MS:m/z试验值185.97 [M+1]+,理论值 185.01 [M]+。
B1:2-氨基-5-苯基-1,3,4-噻二唑,白色固体,产率 78%,mp 225~227 ℃。1H NMR (DMSO-d6)δ7.76 (d,J=7.1 Hz,2H,ArH),7.49~ 7.43 (m,3H,ArH),7.41 (s,2H,NH2);13C NMR (DMSO-d6)δ169.0 (C=N),156.9 (C=N),131.5 (ArC),130.0 (ArC),129.6 (ArC),126.8 (ArC);LC-ESI-MS:m/z试验值 178.11 [M+1]+,理论值 177.04 [M]+。
B2:2-氨基-5-(2-氟苯基)-1,3,4-噻二唑,白色固体,产率 75%,mp 226~228 ℃。1H NMR (DMSO-d6)δ8.11~8.08 (m,1H,ArH),7.53~7.49 (m,1H,ArH),7.46 (s,2H,NH2), 7.40~7.33 (m,2H,ArH);13C NMR (DMSO-d6)δ170.4 (d,J=4.1 Hz,C=N),158.4 (d,J=248.4 Hz,ArC),148.9 (d,J=7.8 Hz,C=N),131.8 (d,J=8.6 Hz,ArC),128.2 (d,J=2.4 Hz,ArC),125.6 (d,J=2.9 Hz,ArC), 119.2 (d,J=12.2 Hz,ArC),116.8 (d,J=21.7 Hz,ArC);LC-ESI-MS:m/z试验值 196.00 [M+1]+,理论值195.03 [M]+。
B3:2-氨基-5-(3-氟苯基)-1,3,4-噻二唑,白色固体,产率 72%,mp 229~231 ℃。1H NMR (DMSO-d6)δ7.61~7.58 (m,2H,ArH),7.54~7.51 (m,3H,ArH,NH2),7.29~7.27 (m,2H,ArH);13C NMR (DMSO-d6)δ169.5 (C=N),162.8 (d,J=244.3 Hz,ArC),155.5 (C=N),133.7 (d,J=8.6 Hz,ArC),131.8 (d,J=8.4 Hz,ArC),123.1 (d,J=2.5 Hz,ArC), 116.8 (d,J=21.1 Hz,ArC),113.0 (d,J=23.6 Hz,ArC);LC-ESI-MS:m/z试验值196.04 [M+1]+,理论值195.03 [M]+。
B4:2-氨基-5-(4-氟苯基)-1,3,4-噻二唑,白色固体,产率 75%,mp 244~245 ℃。1H NMR (DMSO-d6)δ7.81 (t,J=6.8 Hz,2H,ArH),7.40 (s,2H,NH2),7.31 (t,J=8.7 Hz,2H,ArH);13C NMR (DMSO-d6)δ169.1 (C=N),163.1 (d,J=246.9 Hz,ArC),155.7 (C=N),128.9 (d,J=8.6 Hz,ArC),128.1 (d,J=3.1 Hz,ArC),116.6 (d,J=22.2 Hz,ArC);LC-ESI-MS:m/z试验值196.06 [M+1]+,理论值 195.03 [M]+。
B5:2-氨基-5-(2-呋喃)-1,3,4-噻二唑,淡黄色固体,产率 70%,mp 224~226 ℃。1H NMR (DMSO-d6)δ7.83 (s,1H,ArH),7.42 (s,2H,NH2),6.94 (s,1H,ArH),6.66 (s,1H,ArH);13C NMR (DMSO-d6)δ168.5 (C=N),147.5 (C=N),146.1 (ArC),144.7 (ArC),112.7 (ArC),109.4 (ArC);LC-ESI-MS:m/z试验值167.99 [M+1]+,理论值 167.02 [M]+。
B6:2-氨基-5-(2-噻吩)-1,3,4-噻二唑,淡棕色固体,产率 65%,mp 203~206 ℃。1H NMR (DMSO-d6)δ7.63 (d,J=4.5 Hz,1H,ArH),7.40 (s,3H,ArH,NH2),7.13 (s,1H,ArH);13C NMR (DMSO-d6)δ168.6 (C=N),151.1 (C=N),133.8 (ArC),128.4 (ArC),128.05 (ArC),128.02 (ArC);LC-ESI-MS:m/z试验值 184.03 [M+1]+,理论值 182.99 [M]+。
2.2 目标化合物的抑菌活性分析
在质量浓度为 100 μg·mL-1时,目标化合物 B1-B6 对 5 种供试真菌马铃薯干腐病菌、小麦赤霉病菌、番茄灰霉病菌、白菜黑斑病菌、烟草赤星病菌的抑菌活性如表 1 所示。由表 1 可以看出,6 个化合物对5 种供试真菌均有一定的抑菌活性,且对小麦赤霉病菌和番茄灰霉病菌的抑菌活性要高于其他 3 种供试病原真菌,其中化合物 B4 对小麦赤霉病菌的抑菌率为85.7%,对番茄灰霉病菌的抑菌率为89.9%。但所有化合物的抑菌活性均远低于商用杀菌剂噻菌灵。
表1 质量浓度为 100 μg·mL-1 时目标化合物 B1-B6 对 5 种病原真菌菌落生长的抑制率Table 1 Preliminary inhibition rate of compounds B1-B6 against the tested five pathogenic fungi at 100 μg·mL-1 %
注:不同供试样品对同一病原真菌间抑菌活性的显著性差异用不同小写字母表示 (P<0.05)。
Note:Different lowercase letters indicate significant difference between the inhibition of different compounds in the same tested fungus(P<0.05).
进一步对目标化合物的结构与抑菌活性相关性进行分析,当 2-氨基-5-芳基-1,3,4-噻二唑的 5-位连接有苯基(B1)或氟取代苯基(B2-B4)时,化合物 B4 除对烟草赤星病菌的抑菌活性与化合物 B3 无显著性差异外,其对其他 4 种供试病原真菌的抑菌活性均高于化合物 B1-B3,说明当苯环对位上连接有氟取代基时对化合物抑菌活性的影响高于邻位和间位,这可能是由于对氟苯基的引入在一定程度上调节了分子原有骨架的物理或化学特性,以此提高了化合物的抑菌活性。当5-位连接有呋喃环(B5)或噻吩环(B6)时,化合物 B6 对5种供试病原真菌的抑菌活性均高于化合物 B5,说明噻吩环的引入对化合物抑菌活性的影响大于呋喃环,但明显低于对氟苯基的影响。
由于目标化合物 B1-B4 对小麦赤霉病菌和番茄灰霉病菌的抑菌活性较好,本试验进一步研究了4个化合物对这2种供试病原真菌抑菌活性的室内毒力作用,结果见表2。
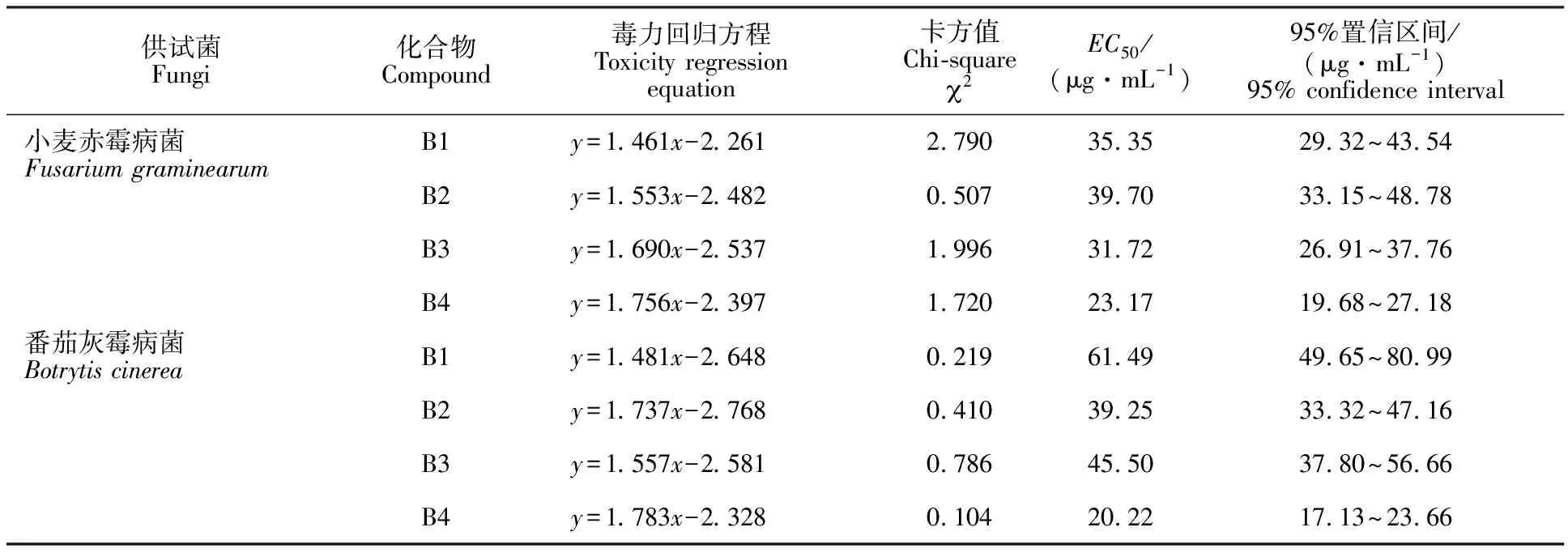
表2 目标化合物 B1-B4 对 2 种病原真菌的毒力测定结果Table 2 Toxicity activities of compounds B1-B4 against two phytopathogens
由表2可以看出,化合物 B4 对小麦赤霉病菌和番茄灰霉病菌EC50值分别为23.17和 20.22 μg·mL-1,与化合物 B1-B3 的EC50值相比较,其毒力最强,对这2种病原真菌的抑菌效果最好。且化合物 B4 对小麦赤霉病菌和番茄灰霉病菌毒力回归方程的斜率最大,说明这2种病原真菌对化合物 B4 的反应灵敏度最高,即随着试验用药浓度的增加,抑菌率明显增大。
3 结论与讨论
本研究基于 l,3,4-噻二唑活性结构骨架的特点,以芳香醛和氨基硫脲为原料,经两步合成路线对其 5-位进行结构修饰,合成了 6 个 2-氨基-5-芳基-1,3,4-噻二唑类化合物,采用1H NMR 与13C NMR确定其结构。通过对化合物的离体抑菌试验,表明 6 个化合物对 5 种供试病原真菌均具有一定的抑菌活性,且对小麦赤霉病菌和番茄灰霉病菌的抑菌活性要高于其他 3 种供试病原真菌。分析目标化合物的结构与活性相关性可知,当 2-氨基-5-芳基-1,3,4-噻二唑的 5-位连接有对氟苯基时对化合物抑菌活性的贡献优于其他取代基,其对小麦赤霉病菌和番茄灰霉病菌的EC50值分别为 23.17 和 20.22 μg·mL-1。由于本试验仅针对供试植物病原真菌进行了室内离体抑菌活性的研究,并未进行盆栽和小区试验,其田间抑菌试验数据是否与室内活性试验测定结果一致,有待进一步验证。此外,该化合物对供试的植物病原真菌的抑菌机理尚不清晰,尚需后期进行深入研究。

