棉花黄萎病生防菌的筛选及挥发性抑菌物质检测
刘元元,庞学兵,李 国,刘珊珊,余彬彬,王爱英
(石河子大学 生命科学学院,农业生物技术重点实验室,新疆石河子 832000)
棉花黄萎病素有“棉花癌症”之称[1],在世界各植棉地区均有报道。作为土传性真菌病害且具有寄主范围广、传播途径多、致病机理复杂、变异性强、防治难度大等特点,使黄萎病成为棉花主要病害之一[2-3]。随着全球变暖趋势的不断加重,土壤上层温度会不断提高,势必导致黄萎菌生活周期延长,对全球作物的危害性也会不断加重[4-5]。目前,棉花黄萎菌的防治主要有化学防治、轮耕倒茬、非化学农药熏蒸等方法,由于传统轮耕倒方法的局限性及化学防治污染大等问题,轮耕倒茬和化学防治逐渐被摒弃,生物防治因具低成本、污染性小、可持续发展等特点逐渐被人们所重视[6]。
生物防治多使用植物根际细菌和植物内生细菌:内生细菌数量庞大,在与植物协同进化过程中形成多种互利共生关系,通过拮抗、竞争、诱导植物抗病性、促进植物生长,起到抑制病原菌侵害的作用;根际细菌在植物根部形成微生物菌膜,抢占生态位使植物免受病原菌侵害。内生细菌和根际细菌都具有定殖率高、对寄主植物危害小等特点适合做生物防治剂。目前,已有许多关于植物内生细菌和根际细菌用于防治植物病虫害的报道。如Mazzola等[7]在根际土壤分离得到的荧光假单胞菌(Pseudomonasfluorescens)SS10菌株对风信子根腐病、瓜果腐霉病和辣椒疫霉病等有良好的防治效果,从柑橘中分离的萎蔫短小杆菌(Curtobacteriumflaccumfaciens)可以提高柑橘对叶缘焦枯病菌的拮抗作用[8]。其中,芽胞杆菌具有繁殖能力强、种群数量大、抗逆能力强、抑菌谱广泛、能产生多种挥发性抗菌物质等特点,成为良好的生物防治资源[9]。曹君等[10]发现枯草芽孢杆菌BS菌株对棉花枯萎病的抑菌率在70%以上;李宝庆等[11]发现枯草芽孢杆菌BAB-1产生的挥发性物质能够抑制番茄灰霉菌的生长;据文献[12]报道,从一株芽孢杆菌分离得到多种挥发性物质,它们能抑制核盘菌菌丝的生长和菌核的生成;也有报道[13-14]称,苏云金芽胞杆菌和短小芽孢杆菌能产生多种对芒果炭疽病具有抑制作用的挥发性物质。
芽孢杆菌挥发性物质对多种病原菌有拮抗作用,而对黄萎菌抑制的研究鲜见报道。本研究从棉花、玉米、向日葵根际分离植物根际细菌63株,苦豆子植株内分离得到2株内生细菌N2和N4,经初筛、复筛及分子鉴定得到对黄萎菌具有强烈抑制作用的根际芽孢杆菌X4和内生芽孢杆菌N4;通过对黄萎菌菌丝形态、孢子萌发、微菌核萌发及毒素分泌能力的抑制效果来综合评价2株拮抗菌的生防能力;利用GC-MS分析发酵液中挥发性成分,并验证挥发性物质对黄萎菌抑制效果,为生物防治提供新的拮抗资源。
1 材料与方法
1.1 试验材料
1.1.1供试菌株 棉花黄萎菌:石河子大学生物技术重点实验室分离得到的大丽轮枝菌VD-278,生理型为非落叶型,培养类型为丝核型菌株。
棉花黄萎菌孢子液的制备参见文献[15]。
拮抗菌:从棉花、玉米、向日葵根际土壤中分离得到63株细菌,从苦豆子植株内部分离得到2株内生菌N2和N4。
1.1.2培养基 LB培养基:蛋白胨10g、酵母提取物5g、NaCl10g、琼脂20g、蒸馏水定容至1000mL,pH7.0。
PDA固体培养基:称取洗净去皮马铃薯200g切成1cm3小块,加蒸馏水煮到玻璃棒戳破,立即用8层纱布过滤得到滤液,加蔗糖20g、琼脂20g,蒸馏水定容至1000mL,pH7.0。
PDA液体培养基:称取洗净去皮马铃薯200g,蒸馏水煮10~20min,立即用8层纱布过滤得到滤液,加蔗糖20g,蒸馏水定容至1000mL,pH7.0。
1.2 研究方法
1.2.1 拮抗菌分离与筛选 准确称取植物根际土壤10 g,放入已装有90 mL无菌水的锥形瓶中[16],28 ℃、180 r/min恒温振荡培养30 min,于超净工作台中吸取100 μL土壤菌悬液,加入900 μL无菌水,并依次稀释至10-4、10-5和10-6,平板涂布法涂布在LB固体培养基上,分离得到植物根际单菌落,纯化单菌株。
苦豆子植株用自来水清洗干净,茎秆截成 2~3 cm小段,体积分数φ=75%的酒精中浸泡消毒30 s,1 g/L的升汞溶液消毒8 min无菌水漂洗3~5次,用无菌研钵研磨成匀浆并稀释成10-4、10-5和10-6,平板涂布法涂布在LB固体培养基上分离纯化得到苦豆子内生单菌株。
采用平板共培养法筛选拮抗菌,在棉花黄萎菌菌落边缘用打孔器打取直径为5 mm的菌饼,置于PDA平板正中央。在距中心菌饼4 cm的4个对角接种供试菌株,对照组仅接种棉花黄萎菌菌饼,25 ℃恒温培养箱中培养8~10 d,采用十字交叉法测量并计算抑菌率[17-18],按照下式计算抑菌直径和抑制率:
菌落直径=测量菌落直径-0.5
抑菌直径=对照病原菌直径-与拮抗菌对峙的病原菌直径
抑制率=(对照菌落直径-处理菌落直径)/(对照菌落直径-0.5)×100%
采用培养皿对扣法检验拮抗菌挥发性物质的抑菌能力,每个处理重复3次。
1.2.2 拮抗菌分子鉴定 CTAB法提取细菌总DNA,引物采用细菌鉴定通用引物。27f:5′-AGAGTTTGTCCTGGCTCAG-3′,1492r:5′-CGGTTACCTTGTTACGACTT-3′[19],以细菌总DNA为模板扩增。PCR反应条件:95 ℃预变性5 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸1 min,循环30次;72 ℃延伸7 min。PCR产物经电泳检测,目的条带纯化后送华大公司测序。序列提交到NCBI进行BLAST,用软件MEGA 5.05以邻位法构建系统发育树,进行系统进化 分析。
1.2.3 拮抗菌对棉花黄萎菌菌丝生长、孢子萌发、微菌核萌发的影响 采用平板共培养法将棉花黄萎菌和拮抗菌N4和X4接种在PDA固体培养基上,25 ℃培养10 d,挑取黄萎菌菌落边缘靠近拮抗菌的菌丝,于显微镜下观察菌丝生长状况。
将防治效果较好的生防菌株N4和X4进行摇瓶发酵后过滤除菌,得到的发酵滤液与黄萎菌孢子悬液(2×103cfu/mL)按照体积比1∶1混合,置于25 ℃摇床振荡培养24~48 h,待未被生防菌胁迫处理的黄萎菌孢子萌发率超过80%后,在40倍显微镜下观察孢子萌发情况[20],以PDA液体培养液与孢子悬浮液的等体积混合液为对照,每处理重复3次。
用无菌水冲洗生长15 d左右的黄萎菌平板 5~7次,在微菌核致密处用5 mm打孔器打孔,将打下的菌饼转移至无菌研钵中,研磨至匀浆,用移液器转移至1.5 mL离心管中,47 ℃水浴5 min,12 000 r/min离心5 min,弃上清,收集沉淀,即为微菌核,在PDA固体平板上分别加200 μL发酵72 h的X4及N4发酵滤液,用涂布器涂匀,每个培养皿中接种20枚菌核,5 d后观察微菌核的萌发情况,以添加等量的PDA液体为对照,每个处理重复3次。
1.2.4 拮抗菌无菌发酵液对棉花黄萎菌毒素分泌的影响 将N4及X4的无菌发酵液各10 mL,分别在90 mL PDA液体培养基里培养,以不加N4和X4的无菌发酵液的100 mL PDA培养基为CK,采用5 mm 孔径的打孔器打取新鲜黄萎菌菌落边缘菌丝,接种至上述两种培养基中。180 r/min、25 ℃的摇床中培养7 d后,8层无菌纱布过滤去除菌体,用 0.45 μm滤膜过滤[21],采用考马斯亮蓝法检测滤液中蛋白质的质量浓度[22],每个处理重复3次。
1.2.5 拮抗菌挥发性抑菌物质GC-MS检测 菌株X4和N4挥发性物质的检测采用乙酸乙酯萃取法[23]。
挥发性活性物质用GC/MS联用仪进行检测。分析条件为:上样提取液20~30 mL,柱温50 ℃(保留2 min),以5 ℃ /min升温至280 ℃,保持2 min;气化室温度为250 ℃;载气为高纯He,载气流量为1.0 mL/min,进样量为1 μL;分流比为40∶1;离子源为EI源,离子温度230 ℃;四级杆温度为150 ℃;电子能量为70 eV;发射电流34.6 mA;倍增器电压2 047 V;接口温度 280 ℃;溶剂延迟3 min;质量为10~550 u[24],每个处理重复3次。
1.2.6 纯品抑菌效果检测 将挥发性物质纯品试剂稀释不同浓度,采用琼脂扩散法[25]检测其抑菌效果,每个处理重复3次。
1.2.7 数据处理 对试验数据采用 SPSS 22.0软件进行统计分析。
2 结果与分析
2.1 拮抗菌的初筛
从棉花、玉米、向日葵根际及苦豆子植株内分离出共65株菌,检测对棉花黄萎菌具有拮抗活性的菌株共有15株,占供试菌株的27.80%,其中从棉花根际分离得到的菌株A3和H1对黄萎菌的抑制率分别为56.64%和55.94%。从向日葵根际分离得到的菌株X4对黄萎菌的抑制率为67.83%,从苦豆子植株内分离得到的菌株N4对黄萎菌的抑制率为65.03%(表1)。
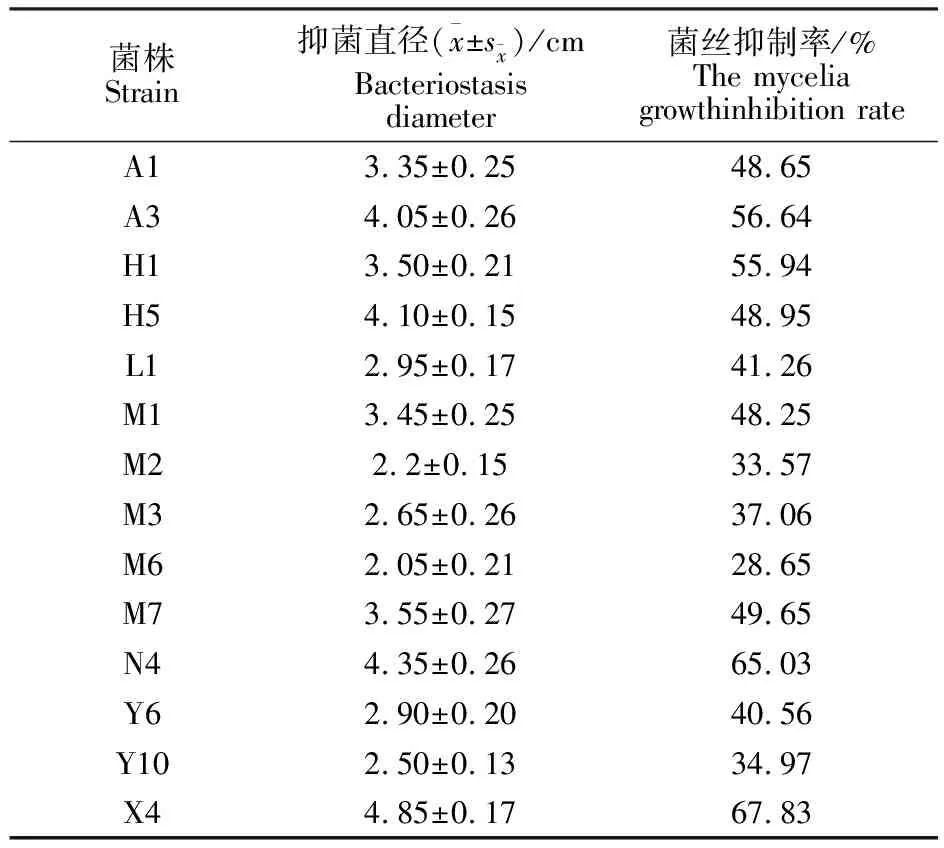
表1 拮抗菌株对棉花黄萎菌的抑制效果Table 1 Inhibitory effects of the antagonistic strains on the growth of Verticillium dahliae
2.2 拮抗菌复筛
将初筛得到的抑菌率大于50% 的4株菌A3、H1、X4T和N4进行复筛,4株菌经发酵离心后用0.22 μm滤膜过滤除菌,用发酵滤液对黄萎菌做抑菌试验。结果表明,菌株A3、X4和N4的无菌发酵液对棉花黄萎菌孢子的萌发有抑制作用,菌株H1对黄萎菌孢子萌发没有抑制作用。其中菌株X4和N4对黄萎菌孢子萌发抑制效果最强,抑菌圈分别达到3.37和3.77 cm(图1)。
2.3 挥发性物质抑菌活性测定
棉花黄萎菌和接种拮抗菌培养皿对扣共培养15 d,对照组黄萎菌菌落直径为5.85 cm,经拮抗菌X4及N4挥发性物质处理的黄萎菌菌落直径分别为3.35 cm与3.70 cm,抑制率分别为 42.74%与36.75%,而且黄萎菌菌落形态发生变化,经处理后的黄萎菌基本不产微菌核,由丝核型转变成菌丝型(图2)。
2.4 拮抗菌分子鉴定
经测序分析,菌株X4与N4的16S rDNA序列长度分别为1 402 bp和 1 398 bp,分别将测序结果输入NCBI 网站 GenBank中的16S rDNA数据库进行在线Blast,结果表明,菌株X4与莫哈韦芽胞杆菌Bacillusmojavensisstrain ifo 15718同源性最高,达99.5%;菌株N4与芽孢杆菌Bacillussp. KNUC8108同源性达99.8%。因此,鉴定菌株X4和N4均属于芽孢杆菌属(Bacillussp.)(图3)。
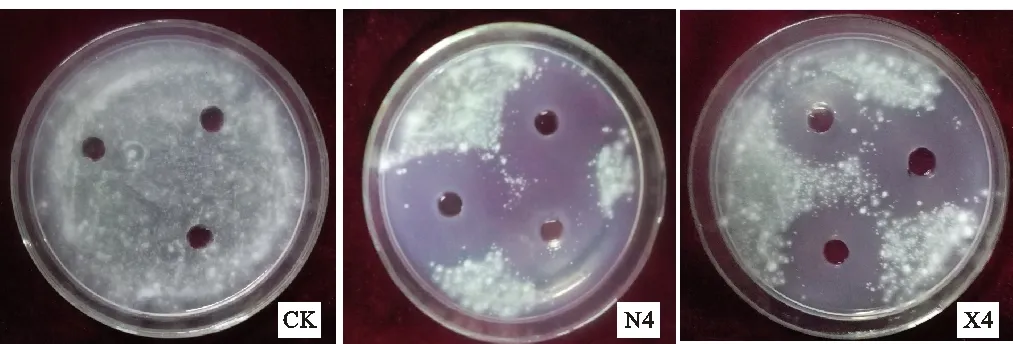
图1 拮抗菌N4和X4对棉花黄萎菌的抑菌效果Fig.1 Inhibitory effects of the strain N4 and X4 on the growth of Verticillium dahliae

图2 拮抗菌挥发性物质对黄萎菌菌落形态的影响Fig.2 The effects of volatile substances from antagonistic bacteria against Verticilliumd ahliaeoncolony morphology
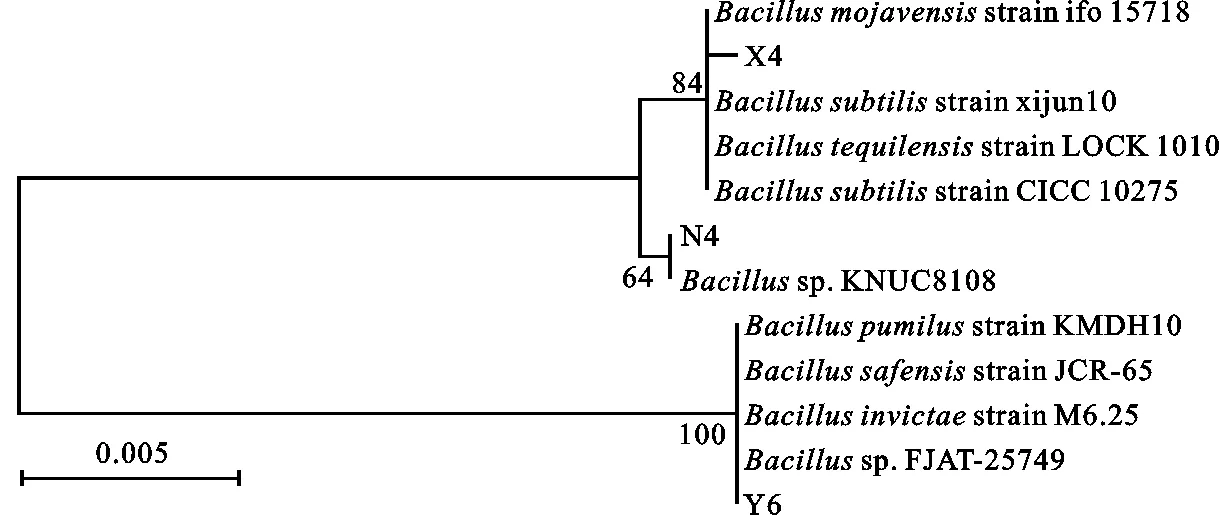
图3 拮抗菌 16S rDNA系统发育树Fig.3 Phylogenetictree of 16S rDNA among antagonistic bacteria
2.5 拮抗菌对棉花黄萎菌菌丝、孢子以及微菌核萌发的影响
拮抗菌X4和N4分别于棉花黄萎菌平板共培养法共培养7 d,挑取黄萎菌菌丝镜检,发现黄萎菌菌丝均发生不同程度的畸变。经拮抗菌X4抑制后的棉花黄萎菌菌丝变短且异常弯曲,经拮抗菌N4抑制后的黄萎菌菌丝彭大且出现明显的溶壁现象(图4-A)。拮抗菌X4及N4无菌发酵液处理24 h后对黄萎菌孢子镜检,对照组黄萎菌孢子萌发率为88.00%,而经拮抗菌X4和N4发酵滤液处理后黄萎菌孢子萌发率仅为14.60% 和14.00%。研究结果表明,拮抗菌X4和N4对黄萎菌孢子的萌发有强烈抑制作用,抑制率分别达83.41%和84.09%(图4-B)。将黄萎菌微菌核接种到涂布有拮抗菌发酵液的PDA培养基上共培养5 d后,对照组黄萎菌微菌核萌发率为100%,经拮抗菌X4和N4处理后黄萎菌微菌核不萌发,抑制率为100%(图4-C)。
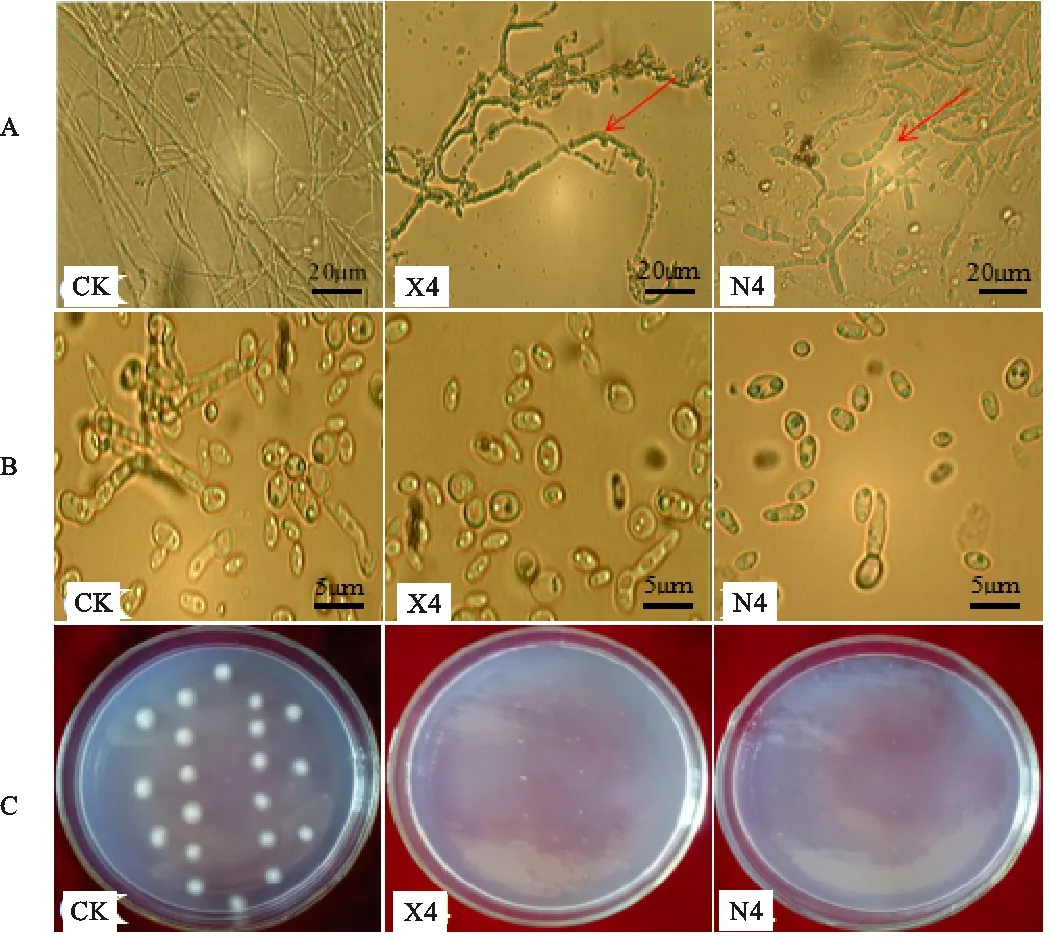
A.拮抗菌X4和N4无菌发酵液抑制黄萎菌菌丝镜检图 The growth of hyphae morphology treated with the aseptic fermentation broth bacteria;B.拮抗菌X4和N4无菌发酵液抑制黄萎菌孢子萌发镜检图 The germination of spore treated with the aseptic fermentation broth;C.拮抗菌X4和N4无菌发酵液抑制黄萎菌微菌核萌发效果图 The germination of microsclerotium treated with the aseptic fermentation broth
图4 拮抗菌X4和N4处理后黄萎菌菌丝、孢子及微菌核萌发情况
Fig.4 Effects of two antagonistic strain X4,N4 on hyphae morphology,spore
and microsclerotium germination ofVerticilliumwilt
2.6 拮抗菌对黄萎菌毒素分泌的影响
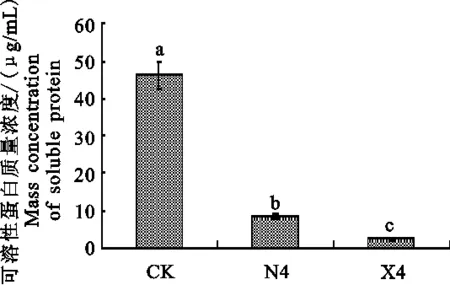
经拮抗菌X4和N4无菌发酵液处理的黄萎菌产毒力蛋白的能力显著降低,X4处理后黄萎菌产毒力蛋白仅为对照的4.53%,抑制率为 95.47%,N4处理后黄萎菌产毒力蛋白仅为对照的17.01%,抑制率为82.99%。说明拮抗菌X4和N4对黄萎菌产毒力蛋白能力有显著抑制作用(图 5)。
2.7 GC-MS结果分析
通过GC-MS在菌株X4的无菌发酵液的乙酸乙酯萃取物中共检测出16种挥发性物质,质量分数最高的为醇类物质,其中2,3-丁二醇质量分数为80.80%,3-己醇质量分数1.31%;其次为有机酸,其中异丁酸质量分数5.30%,3-甲基丁酸质量分数1.49%,2-甲基乙酸质量分数 4.09%,还包括一些脂类、烷类和酚类等物质(表2)。
通过GC-MS在菌株N4的无菌发酵液乙酸乙酯萃取物中共检测出11种挥发性物质,质量分数最高的为醇类物质,其中2,3-丁二醇质量分数为94.56%,1-乙氧基-2-丙醇为0.26%,2-庚醇为 0.14%;其次为有机酸,其中异丁酸为1.26%,3-甲基丁酸为0.42%,2-甲基丁酸为1.1%;还包括一些脂类等物质(表3)。
2.8 挥发性纯品物质抑菌检测
购置挥发性物质2,3-丁二醇、3-甲基丁酸、2-甲基丁酸和异丁酸,分别将其稀释5、50、150、500倍检测对黄萎菌的抑制效果。
结果表明:2,3-丁二醇没有抑菌活性,2-甲基丁酸、3-甲基丁酸和异丁酸对棉花黄萎菌有较强的抑菌活性,其中2-甲基丁酸对黄萎菌的抑制作用最强,在稀释5倍后,其抑菌圈达7.4 cm,这3种物质在稀释500倍后基本对黄萎菌不产生抑制作用(图6)。
柱形图上不同小写字母表示差异显著(P<0.05) Different lowercase letters on the column chart indicate significant differences among different column(P<0.05)
图5 拮抗菌对黄萎菌胞泌蛋白分泌的影响
Fig.5 The effects of antagonistic bacteria against theprotein secretion ofVerticiliumdahliae

表2 芽孢杆菌菌株X4挥发性物质成分检测分析Table 2 Analysis of volatile constituents from Bacillus strain X4
注:“-”表示该物质已检出,可以查询到对应的英文名称,但因没有相对应的中文名,故用“-”代替。下表同。
Note:“-” means that the compound has been detected in the table, and the corresponding English name can be found, but because there is no corresponding Chinese name,“-” is used instead of the Chinese name.The same below.

表3 芽孢杆菌菌株N4挥发性物质成分检测分析Table 3 Analysis of volatile constituents from Bacillus strain N4
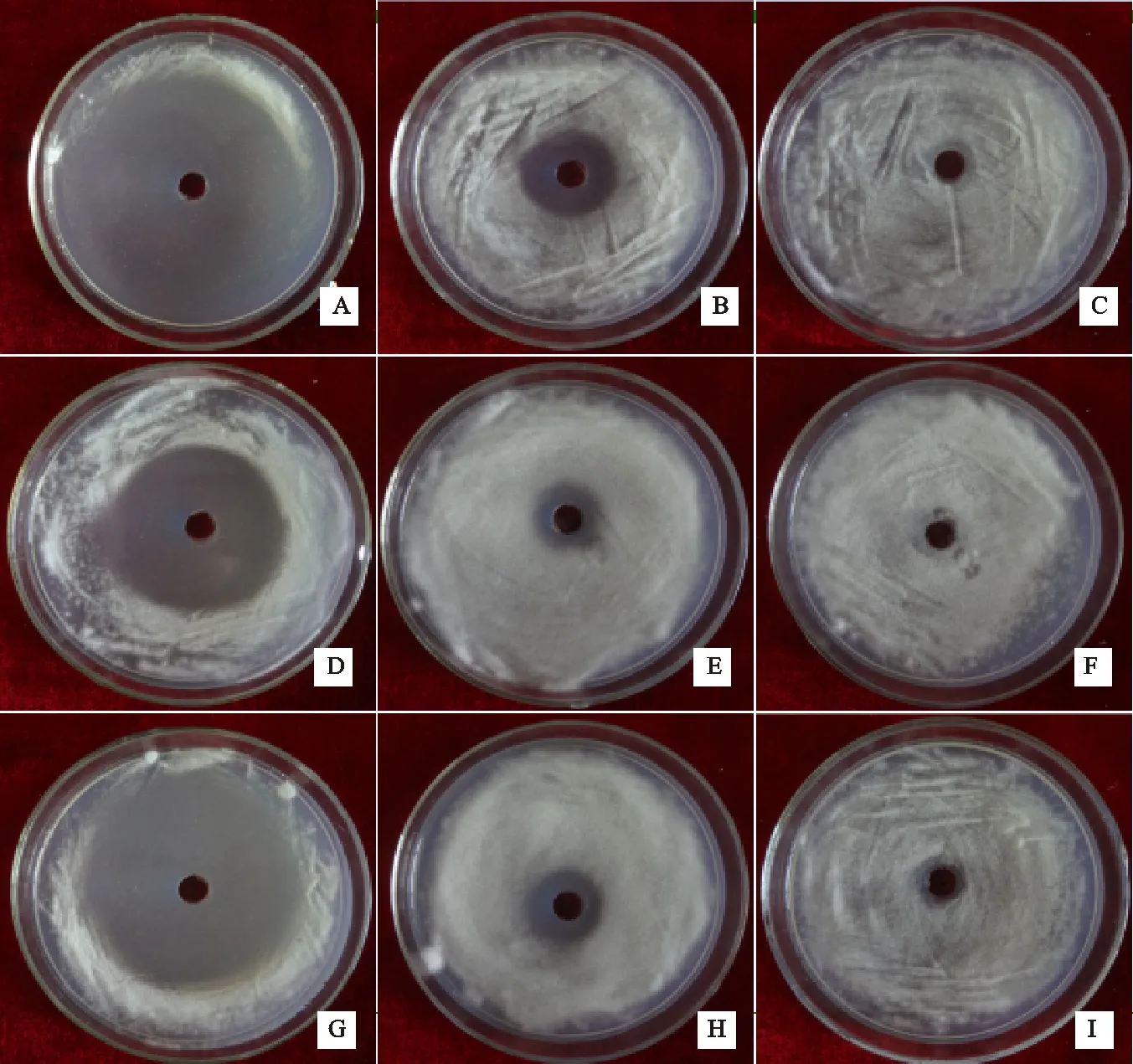
A、B、C分别为2-甲基丁酸稀释5、50、150倍的抑菌效果 A, B, and C represent antibacterial effect of 2-methyl-butyric aciddiluted into 5,50 and 150 times respectively;D、E、F分别为3-甲基丁酸稀释5、50、150倍的抑菌效果 D, E and F represent antibacterial effect of isovaleric aciddiluted into 5, 50 and 150 times respectively;G、H、I分别为异丁酸稀释5、50、150倍的抑菌效果 G, H and I represent antibacterial effect of isobutyric aciddiluted into 5, 50 and 150 times respectively
图6 挥发性物质的抑菌效果
Fig.6 Inhibitory effect of volatile reagents onVerticiliumdahliae
3 讨 论
内生拮抗芽孢杆菌的分离筛选是棉花黄萎病生物防治的重要来源之一,多从棉花根系内和茎秆中分离得到[26-28]。苦豆子植株内存在大量的内生菌,芽孢杆菌最多且均对黄萎菌具有拮抗作用[29]。本研究中的菌株N4是从苦豆子植株内分离得到,其拮抗性均优于棉花植株根际微生物的拮抗芽孢杆菌。苦豆子内存在高拮抗性芽孢杆菌可能是拮抗黄萎病的原因之一。本试验筛选的高拮抗性根际拮抗菌X4是防治棉花黄萎病的重要微生物资源。
最近的研究表明,大多数拮抗菌产生的挥发性物质可能是对病原菌发挥抑制作用的主要原因,而非传统认为的非挥发性抑菌物质[30]。研究发现大部分拮抗细菌可以产生多种挥发性物质[31],部分挥发性物质对病原菌具有拮抗作用[32-33]。Rybakova等[34]认为,拮抗菌代谢产生的这些挥发性抑菌物质才是抑制病原菌的主要原因,其抑制机理是基于病原菌对拮抗菌产生的挥发性抑菌物质的反应,挥发性物质可以作为一种化学信号分子作用于病原菌,导致病原菌细胞代谢紊乱死亡或者通过形成休眠体抵御来自拮抗菌的压力。具有拮抗作用的挥发性物质可以作为拮抗菌、寄主植物以及病原菌三者之间相互作用的重要信号分子,拮抗菌通过抑制病原菌生长繁殖,直接或者间接增加寄主植物的生物量,增强植物的抗病性以及对非生物胁迫的耐受性[35]。
本研究通过培养皿对扣试验发现,芽孢杆菌X4和N4的分泌挥发性物质对黄萎菌也具有强烈的抑制作用,且导致黄萎菌的菌落形态产生变化,证明拮抗菌挥发性物质也具有抑菌效果。据报道[36],多粘类芽孢杆菌Sb-1产生的挥发性物质2-壬酮、2-甲基-1-丁醇、十六烷醛对尖孢镰刀菌具有拮抗作用;蜡状芽胞杆菌产生的挥发性抗菌物质AFVs可抑制绿色木霉的活性[37];Candidaintermedia产生的挥发性抗菌物质2-壬酮可抑制草莓采后灰霉病菌的活性[38]。拮抗菌X4和N4产生的挥发性物质经GC-MS检测分析,X4检测到16挥发性物质,N4检测到11种挥发性物质。2,3-丁二醇、3-甲基丁酸、异丁酸2株菌均可产生,2-甲基丁酸只有N4能产生,2,3-丁二醇质量分数最高,分别占挥2株菌挥发性物质的 83.27%和93.97%。挥发性物质的抑菌试验表明,质量分数最多的2,3-丁二醇没有抑菌活性,2-甲基丁酸、3-甲基丁酸以及异丁酸属于有机酸类具有刺鼻难闻的味道,对黄萎菌均有较强抑菌活性。这3种挥发性物质对黄萎菌具有抑制作用是首次发现,其抑菌作用可能是由PH导致或者挥发性物质作为小的信号分子调节黄萎菌的生长繁殖。研究表明,植物根际分离的菌株X4和苦豆子内生菌N4都产生具有较强抑菌活性的2-甲基丁酸、3-甲基丁酸以及异丁酸等挥发性物质,说明2株菌都是棉花黄萎菌潜在的生防菌资源,可为生防菌剂的研发提供优良菌种。农业生产上可以从微生物代谢物中分离纯化或人工化学合成这几种抑菌物质用于农作物病虫害防治,为防治黄萎菌提供新的办法。目前,关于这3种挥发性物质对黄萎菌的抑制效果尚未见报道,关于其抑菌机理还有待进一步研究。

