蚜虫及大麦黄矮病毒诱导小麦对后期禾谷缢管蚜酶活性的影响
亢菊侠,杨 洋,孟琳钦
(1.杨凌职业技术学院 生物工程分院,陕西杨凌 712100;2.西北农林科技大学 植物保护学院,陕西杨凌 712100)
植物病毒-介体昆虫-寄主植物三者之间存在着明显的互作关系,植物病毒的侵染会影响植物体内多种生理活动,涉及光合作用、植物防御反应、能量传递等[1];介体昆虫取食植物韧皮部汁液时,尽管仅对植物表皮造成微小的创伤,然而所分泌的唾液却可能破坏植物细胞的结构并且诱导植物激活复杂的防御反应[2]。寄主植物的这些变化,影响着后期介体昆虫的行为、生物学特征和体内生理生化代谢,是介体昆虫种群动态变化和植物病毒病流行的主要决定因子[3]。相关研究得到了广泛的关注。
对介体昆虫来说,植物病毒是一种外来物质,昆虫取食携带植物病毒的植物后,会产生防御或者调节反应。解毒酶和保护酶是昆虫体内两类重要酶系,在对抗逆境及维持昆虫正常的生理生化代谢方面具有重要作用,常被用来作为评价昆虫生理适应性的指标[4]。Xu等[5]报道了褐飞虱在水稻黑条矮缩病毒(RBSDV)病株上取食1代后,雌性成虫体内的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)活性分别比取食健康稻株褐飞虱提高了51. 84%和59. 29%,过氧化物酶(POD)也具有相同的变化趋势。陈晨等[6]进一步研究取食感染RBSDV水稻不同时间后,褐飞虱和白背飞虱体内3种保护酶活性的变化,表明白背飞虱和褐飞虱成虫及若虫体内SOD、CAT、POD的活性随取食时间延长而增加。曹增等[7]研究取食感染番茄黄化曲叶病毒(TYLCV)的番茄后,烟粉虱的生理防御反应,发现烟粉虱体内谷胱甘肽S-转移酶(GSTs)和羧酸酯酶(CarE)活性先显著上升后显著下降,取食72 h后,三大保护酶SOD、POD、CAT的活性显著升高;取食30 d后,保护酶活性持续显著高于取食72 h及对照。上述试验获得感染植物病毒的植物时,都需要前期介体昆虫进行取食传毒,由于未设置无毒介体昆虫前期取食组试验,无法真正厘清是植物病毒的影响还是前期介体自身取食行为的影响,因此应进行进一步的研究。
大麦黄矮病毒(Barley yellow dwarf virus,简称BYDV),可以侵染100多种禾本作物,它引起的小麦黄矮病是一种世界性的病害,在全球各个国家均有发生。1960年,中国首次在陕西和甘肃发现小麦黄矮病,是中国北方麦区危害最重、发生最广的病毒病之一,为目前流行最广的四大病害之一,一般年份减产5%左右,流行年份减产30%以上[8]。大麦黄矮病毒按照蚜虫的传播特性、反映类型与寄主范围等生物学特性可以划分出不同的株系,周广和等[8]已鉴定出GAV、PAV、GPV 和RMV 4 种株系,其中PAV由禾谷缢管蚜和麦长管蚜传播。近些年,通过田间调查,中国PAV株系逐渐增多。前人研究发现,介体蚜虫取食感染大麦黄矮病小麦后,对其生长发育与繁殖、取食行为及寄主选择性均有积极的影响[9],但这些影响的生理生化机制尚不明确。
为了厘清前期介体取食和植物病毒对后来蚜虫体内生理生化的影响,本研究以BYDV-PAV作为测试病毒,以其介体禾谷缢管蚜作为测试蚜虫。以取食健康小麦作为对照组,以取食前期受到无毒蚜虫危害的小麦作为蚜虫诱导组,以取食前期受到有毒蚜虫危害(通过RT-PCR鉴定,小麦成功感染BYDV-PAV病毒)作为蚜虫和病毒诱导组,通过比较上述3种处理蚜虫体内保护酶与解毒酶的活性差异,从而揭示BYDV-PAV及前期介体取食诱导对禾谷缢管蚜影响的生化机制,从而完善病毒与昆虫互作的内在机制,并为BYDV与禾谷缢管蚜的防治提供参考。
1 材料与方法
1.1 供试材料
1.1.1 小麦种植 小麦品种为‘矮抗58’,由西北农林科技大学农学院陕西省作物杂种优势研究与利用重点实验室惠赠。播种前用清水浸泡小麦种子24 h,用一次性纸杯作为花盆,放入花盆体积2/3 的育苗基质,撒入浸泡好的小麦种子,每盆种4~5 颗种子,待小麦长出后只留3 株小麦,然后在其上再覆盖1/3 的育苗基质,用喷壶喷水至浸透育苗基质,用顶端带有纱网的透明塑料笼罩罩住,放入人工气候箱(温度25 ℃,相对湿度60%,光周期16L∶8D,下同)培育,待小麦长至一心一叶期备用。
1.1.2 供试毒源 BYDV-PAV毒源来自杨凌农场(34°17′48.5″N ,108°04′34.9″E)。采集到的显症小麦,利用RT-PCR 技术对其进行BYDV常见的3种株系鉴定[10-12](BYDV-PAV 引物为PAV-F:GTACAAGGCAAATGGCACGAC,PAV-R:GTTCTGCCTGTTTCCCAGCAT;BYDV-GAV引物为 GAV-F:ATGAATTCAGTAGGCCGTAGAAAT,GAV-R:CTATTTGGGAGTCATGTTGGCAAC;BYDV-GPV引物为 GPV-F:ATGAGTACGGTCGCCTTAGAA,GPV-R:TT- CGTCAAGCGTAACTGT;阳性对照由西北农林科技大学植物病毒学实验室吴云峰教授馈赠),将扩增产物测序,BALST比对后,确认仅含PAV 株系。由实验室长期饲养的无毒禾谷缢管蚜作为介体,蚜虫获毒后,转移到盆栽小麦(‘矮抗58’)上,在人工气候箱内上长期饲养。蚜虫和小麦每隔2~3 代均进行BYDV上述3种株系检测,确保蚜虫和小麦仅感染大麦黄矮病毒PAV 株系。
1.1.3 供试蚜虫 供试禾谷缢管蚜单头采自西北农林科技大学北校区麦田(34°17′18.8″N , 108°04′06.0″E),在室内人工气候箱内培养10 代以上。形成单克隆系。并进行RT-PCR 鉴定,其体内不含BYDV 任何株系,确保为无毒禾谷缢管蚜 备用。
1.1.4 酶活测定试剂 过氧化物酶(POD)试剂盒,过氧化氢酶(CAT)试剂盒,超氧化物歧化酶(SOD)试剂盒,酸性磷酸酶(ACP)测试盒,碱性磷酸酶(AKP)测试盒,乙酰胆碱酯酶(AchE)测试盒,均为南京建成生物工程研究所生产。
1.1.5 试验仪器 infiniteM200全波长酶标仪,瑞士Tecan公司;BIC-300人工气候箱,上海博迅实业有限公司医疗设备厂;DK-98-II A电热恒温水浴锅,天津市泰斯特仪器有限公司。
1.2 方 法
1.2.1 试验设计 用直径9 cm、高8 cm的花盆种植4~5粒小麦种子,用顶端带有纱网的透明塑料笼罩罩住,放入人工气候箱,待小麦长到一心一叶期,保留3株。接入15头(每株5头)携带PAV株系禾谷缢管蚜3龄若蚜作为病毒和蚜虫诱导组;接入15头无毒禾谷缢管蚜3龄若蚜作为蚜虫诱导组,不接蚜虫的小麦作为对照组。每个处理重复3次。72 h后,剔除前期所接蚜虫,接入30头24 h内初生的无毒禾谷缢管蚜若蚜,待长至成蚜后,将30头成蚜收集在无菌1.5 mL离心管内,速冻于液氮后,放入-80 ℃冰箱保存。同时收集病毒和蚜虫诱导组花盆中的3株小麦叶片,进行RT-PCR鉴定, 确保3株小麦均感染BYDV-PAV病毒,收集到的蚜虫才能进行下一步酶活测定。蚜虫诱导组和对照组中的植物亦进行同样操作,确保小麦体内不感染病毒。
1.2.2 酶原液制备及酶活测定 将待测蚜虫从-80 ℃冰箱取出称量,按质量∶体积=1∶9的比例加入无菌9 g/L的生理盐水冰浴研磨,研磨成匀浆液后于4 ℃、2 500 r/min离心10 min,取上清即为酶原液。所有酶活性测定均按照南京建成酶活试剂盒的方法进行。
1.3 数据分析
采用SPSS 21.0 软件对酶活数据进行单因素方差分析,并采用 S-N-K 法进行差异显著性测验。采用SigmaPlot 10.0软件作图。
2 结果与分析
2.1 蚜虫及大麦黄矮病毒诱导对禾谷缢管蚜保护酶活性的影响
2.1.1 POD活性的变化 与取食健康小麦(对照组)相比,取食前期受无毒禾谷缢管蚜危害小麦(蚜虫诱导组)和取食前期感染BYDV-PAV小麦(病毒和蚜虫诱导组)禾谷缢管蚜体内POD 活性均显著升高(P=0.000和P=0.046),上升幅度分别达到206.9%和49.3%;而与蚜虫诱导组相比,病毒和蚜虫诱导组禾谷缢管蚜体内POD 活性显著下降(P=0.000),下降幅度达51.3%。说明前期蚜虫的取食行为可诱导小麦抗性,使得后期蚜虫体内的POD活性显著升高,但PAV病毒存在时,可显著降低这种影响 (图1-A)。
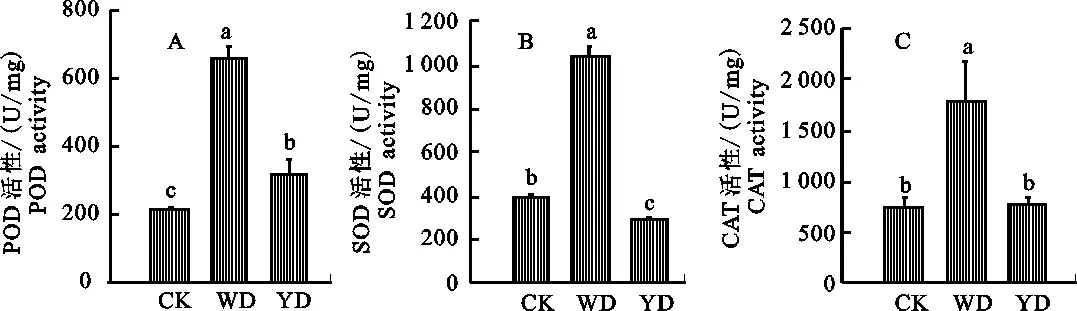
CK.对照组 Control group;WD.蚜虫诱导组 Previous non-infection aphids induction group;YD.病毒和蚜虫诱导组 Previous BYDV-infection aphids induction group;数据为“平均值±标准误” The data was “mean±SE”;误差棒上不同大写字母表示用S-N-K法检验P<0.05水平差异显著性,下同 Different uppercase letters on the error bars indicate significant difference atP<0.05 level by S-N-K test,the same below
图1 蚜虫及大麦黄矮病毒诱导下禾谷缢管蚜体内保护酶POD(A)、SOD(B)和CAT(C)的活性
Fig.1 Protective enzymes POD (A),SOD (B) and CAT(C) activities
ofRhopalosiphumpadiunder different treatments
2.1.2 SOD活性变化 与取食健康小麦(对照组)相比,取食前期受无毒禾谷缢管蚜危害小麦(蚜虫诱导组)禾谷缢管蚜体内SOD活性显著升高(P=0.000),上升幅度达到161.7%,而取食前期感染BYDV-PAV小麦(病毒和蚜虫诱导组)禾谷缢管蚜体内SOD活性显著下降差异(P= 0.015),下降幅度达27.8%;而与蚜虫诱导组相比,病毒和蚜虫诱导组禾谷缢管蚜体内SOD活性显著下降(P=0.000),下降幅度达72.4%。说明前期蚜虫的取食行为可诱导小麦抗性,使得后期蚜虫体内的SOD活性显著升高,且PAV病毒可显著降后期蚜虫体内SOD的活性 (图1-B) 。
2.1.3 CAT活性的变化 与取食健康小麦(对照组)相比,取食前期受无毒禾谷缢管蚜危害小麦(蚜虫诱导组)禾谷缢管蚜体内CAT活性显著升高(P=0.010),上升幅度达到138.9%,而取食前期感染BYDV-PAV小麦(病毒和蚜虫诱导组)禾谷缢管蚜体内CAT活性无显著差异(P= 0.972);而与蚜虫诱导组相比,病毒和蚜虫诱导组禾谷缢管蚜体内CAT活性显著下降(P= 0.010),下降幅度达57.5%。说明前期蚜虫的取食行为可诱导小麦抗性,使得后期蚜虫体内的CAT活性显著升高,但PAV病毒存在时,可显著降低这种影响 (图1-C)。
2.2 蚜虫及大麦黄矮病毒诱导对禾谷缢管蚜解毒酶活性的影响
2.2.1 ACP活性的变化 与取食健康小麦(对照组)相比,取食前期受无毒禾谷缢管蚜危害小麦(蚜虫诱导组)禾谷缢管蚜体内ACP活性显著升高(P=0.000),上升幅度达到190.8%,而取食前期感染BYDV-PAV小麦(病毒和蚜虫诱导组)禾谷缢管蚜体内ACP活性显著下降差异(P= 0.031),下降幅度达34.3%;而与蚜虫诱导组相比,病毒和蚜虫诱导组禾谷缢管蚜体内ACP活性显著下降(P=0.000),下降幅度达77.4%。说明前期蚜虫的取食行为可诱导小麦抗性,使得后期蚜虫体内的ACP活性显著升高,且PAV病毒可显著降后期蚜虫体内ACP的活性 (图2-A) 。
2.2.2 AKP活性的变化 与取食健康小麦(对照组)相比,取食前期受无毒禾谷缢管蚜危害小麦(蚜虫诱导组)禾谷缢管蚜体内AKP活性显著升高(P=0.000),上升幅度达到138.9%,而取食前期感染BYDV-PAV小麦(病毒和蚜虫诱导组)禾谷缢管蚜体内AKP活性无显著差异(P= 0.170);而与蚜虫诱导组相比,病毒和蚜虫诱导组禾谷缢管蚜体内AKP活性显著下降(P= 0.000),下降幅度达78.5%。说明前期蚜虫的取食行为可诱导小麦抗性,使得后期蚜虫体内的CAT活性显著升高,但BYDV-PAV存在时,可显著降低这种影响 (图2-B)。
2.2.3 AchE活性变化 与取食健康小麦(对照组)相比,取食前期受无毒禾谷缢管蚜危害小麦(蚜虫诱导组)和取食前期感染BYDV-PAV小麦(病毒和蚜虫诱导组)禾谷缢管蚜体内AchE活性均无显著差异(P>0.05)。说明前期蚜虫的取食行为和PAV均不影响后期蚜虫体内的AchE活性(图2-C)。
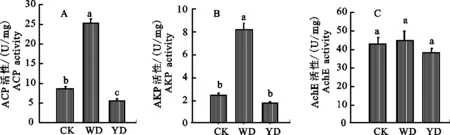
图2 蚜虫及大麦黄矮病毒诱导下禾谷缢管蚜体内解毒酶ACP(A)、AKP(B)和AchE(C)的活性Fig.2 Detoxifying enzymes ACP(A),AKP (B)and AchE(C) activities of Rhopalosiphum padi under different treatments
3 讨 论
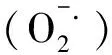
本研究结果表明,与取食健康植物相比,取食前期受到有毒蚜虫危害的小麦后,禾谷缢管蚜体内保护酶SOD显著降低,反应取食感染植物病毒的小麦导致禾谷缢管蚜体内有害物质H2O2减少释放,说明其体内抗氧化能力大于取食健康小麦的蚜虫,因此其适合度高于取食健康小麦的蚜虫[17]。Luan等[20]发现B型烟粉虱在感染番茄黄化曲叶病毒的烟草上取食后,体内解毒酶活性显著降低,认为昆虫能够通过降低解毒酶活性来减少能量消耗,由此增加其在带毒寄主植物上的适合度。本研究也发现禾谷缢管蚜取食有毒小麦后,体内解毒酶ACP也显著降低,与上述报道一致。Hu等[9]研究结果显示,取食BYDV感染的小麦对蚜虫的生长发育与繁殖有促进作用,本试验从一定程度上解释了上述结果产生的原因。但本研究结果与前人在南方水稻黑条矮缩病与褐飞虱/白背飞虱、烟粉虱与黄化曲叶病毒互作研究结果具有一定差异[6-7]。这可能是由于不同类型植物病毒与介体昆虫互作关系具有不同的生理生化机制造成的。
李军等[21]研究了前期蚜虫危害后,后期蚜虫的发育历期、体质量差和相对日均体质量增长量的变化,发现对后期蚜虫生长发育有显著的抑制作用。本研究结果显示,与取食健康植物相比,取食前期受到无毒蚜虫危害的小麦后,禾谷缢管蚜体内保护酶SOD、POD、CAT及解毒酶ACP、AKP活性均显著升高,说明前期蚜虫取食诱导了小麦的抗性,导致后期禾谷缢管蚜体内抗氧化能力小于取食健康小麦的蚜虫,并且通过升高解毒酶活性来诱导对植物的抗性,因此降低了其在前期蚜虫危害后的寄主植物上的适合度。本试验从一个侧面解释了李军等[21]结果产生的原因。同时,与取食前期受到无毒蚜虫危害的小麦相比,取食前期受到有毒蚜虫危害的小麦后,禾谷缢管蚜体内保护酶SOD、POD、CAT及解毒酶ACP、AKP活性均显著降低,说明小麦感染植物病毒可以克服蚜虫危害造成的酶活性上升,使之更好地在带毒植物上生存。
在长期的进化过程中,植物病毒—介体昆虫—寄主植物三者间形成了复杂的互作关系,本试验仅从实验室条件下,对昆虫体内的保护酶和解毒酶活性进行了研究。在大田中,由于还受到温度、湿度等物理条件,以及其他生物的影响,因此要进行室外试验,增加试验的可信度。另外非常有必要在此基础上对保护酶和解毒酶的基因表达量进行分析,并进一步利用转录组学方法进行研究,从而明确介体昆虫对植物病毒和前期昆虫取食更深层的基因适应机制。

