苏木乙酸乙酯提取液对动脉粥样硬化小鼠ASK1-JNK信号通路及胶原蛋白水平的影响*
李鑫峰 杨建飞 王 倩 周亚滨△
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.黑龙江中医药大学附属第一医院,黑龙江哈尔滨 150040;3.南京中医药大学附属盐城市中医院,江苏 盐城 224000)
急性冠脉综合征(ACS)是以冠状动脉内粥样斑块破裂,继而诱导不完全或完全闭塞性血栓形成,从而引起一系列的急性、重症心肌缺血综合征[1]。易损斑块是指有破裂倾向的不稳定性斑块,其作为ACS的重要危险因素之一,早期有效干预能够减少心血管事件的发生、降低临床死亡率。斑块内纤维帽是血液和脂质成分的血液屏障,其完整性和厚度决定着粥样硬化斑块的稳定性,而胶原纤维作为纤维帽的主要成分之一,其含量直接影响着纤维帽的状态[2]。因此,调控胶原代谢能够有效维持斑块的稳定性。基质金属蛋白酶-9(MMP-9)是MMPs家族的一员,作为细胞外基质降解过程中重要的蛋白水解酶,能够分解纤维帽中的胶原纤维,削弱纤维帽,从而降低斑块的稳定性[3]。
本课题组前期研究发现,苏木乙酸乙酯提取液(SAEE)能够改善动脉粥样硬化大鼠腹主动脉的组织形态和内皮细胞功能,并且降低MMP-9的含量,从而起到抗动脉粥样硬化的作用[4]。此外,SAEE还具有显著的抗炎作用,能够降低动脉粥样硬化大鼠血清超敏C反应蛋白的表达,发挥抗动脉粥样硬化的作用[5]。因此,本研究以ApoE-/-小鼠为模型,通过观察炎性因子肿瘤坏死因子-α(TNF-α)、凋亡信号调节激酶1-c-Jun氨基端激酶(ASK1-JNK)信号通路中关键蛋白及下游Ⅰ型胶原(COL-Ⅰ)及Ⅲ型胶原(COL-Ⅲ)胶原的表达,进一步明确SAEE抗动脉粥样硬化的作用机制。
1 材料与方法
1.1 实验动物
50只雄性ApoE-/-小鼠(品系C57B/6J),10周龄,体质量18~21 g,由黑龙江中医药大学动物实验中心提供,动物合格证号:SCXK(黑)2015003。饲养条件:二级,室温21~24℃,湿度46%~51%,自由饮水,光照时间 7∶00~19∶00,整个实验过程符合《实验动物管理和使用指南》[6]中的有关规定。
1.2 试剂与仪器
1)试剂:总胆固醇(TC)、甘油三酯(TAG)、高密度脂蛋白(HDL-C)、低密度脂蛋白(LDL-C)、TNF-α 试剂盒 (南京建成生物工程研究所);一抗:兔抗大鼠TNF-α、p-ASK1 (Thr 845)、ASK1、p-JNK (T 183)、JNK、P4H、COL-I及 COL-Ⅲ和 β-actin 单克隆抗体(万类生物科技有限公司),二抗:HRP标记的山羊抗兔IGG抗体(碧云天生物科技有限公司)。2)仪器:酶标仪 (美国BIO-RAD公司),DYCZ-24K电泳仪、DYCZ-24EN电泳槽 (北京六一生物科技公司);Tanon 2500全自动数码凝胶图像分析系统(上海天能公司)。
1.3 药物制备
将苏木生药制成40目的粗粉,乙醇经浸泡、加热、回流、过滤,合并后的滤液水浴蒸干,制成乙醇提取干粉。双蒸水混悬乙醇提取干粉,经乙酸乙酯萃取,所得溶液为乙酸乙酯提取物。
1.4 分组与造模
ApoE-/-小鼠随机分为空白对照组、模型组、SAEE低剂量组、SAEE中剂量组和SAEE高剂量组,每组10只。空白对照组给予普通饲料喂养,其余4组给予高脂饲料喂养 (83.5%普通饲料,8%牛油,7.5%蛋黄粉,1%胆固醇),喂养4周后,随机抽取1只小鼠解剖观察胸主动脉,光镜下发现斑块为造模成功。造模成功后各组开始药物干预。
1.5 药物干预
SAEE低剂量组、SAEE中剂量组和SAEE高剂量组分别给予 1.15、2.30、3.45 g/(kg·d) 的 SAEE 溶液灌胃治疗,空白对照组和模型组则给予等体积(0.2 mL)的蒸馏水灌胃,喂养6周。
1.6 样本采集及检测
末次给药结束后,所有小鼠禁食12 h,用20%乌拉坦腹腔注射麻醉,摘取眼球取血,3 000 r/min离心10 min,分离血清,并剥离主动脉弓,待测。
1.6.1 ELISA法检测 采用ELISA法分别检测各组小鼠血清 TC、TAG、HDL-C、LDL-C、TNF-α 的水平,具体操作参照试剂盒说明书。
1.6.2 Western blotting法检测 主动脉粥样斑块中TNF-α、ASK1、p-JNK、JNK、P4H、COL-I及 COL-Ⅲ蛋白的含量检测。取适量主动脉弓组织于液氮中研碎,RIPA裂解后匀浆,12 000 r/min离心10 min,BCA法检测蛋白浓度。SDS-PAGE电泳,转膜,封闭1.5 h,加入 TNF-α、p-ASK1、ASK1、p-JNK、JNK、P4H、COL-I及 COL-Ⅲ和 β-actin 一抗(1∶500 稀释),孵育过夜,洗涤,加入 HRP标记的二抗(1∶1 000稀释),孵育 1.5 h,洗涤,显色,扫描,Quantity One软件分析,β-actin作为内参,以比值结果表示蛋白的相对含量。
1.6.3 Realtime-PCR法检测 主动脉粥样斑块中TNF-α、ASK1、JNK、P4H、COL-I及 COL-Ⅲ mRNA 的表达检测。取适量主动脉弓组织,采用Trizole匀浆制备总RNA,逆转录成cRNA进行PCR扩增反应。应用Primer Prim 6.0软件设计并合成PCR引物。引物序列分别为 TNF-α 上游:5′-TTCTCATTCCTGCTCGTGG-3′, 下游:5′-TTTGGTGGTTCGCCTCCT-3′(203 bp);ASK1 上游:5′-AACCCAGTTGAGGCTGTAGCG-3′,下游:5′-ACATGAT GCAGTACGAGGTCAC-3′(98 bp);JNK 上游:5′-TGATGACGCCTTACGTGGTA-3′,下游:5′-GGCAAACCATTTCTCCCATA-3′(40 bp);P4H 上游:5′-GAGTGAGTTGGAGAATCTGGTCC-3′, 下游:5′-CAATTGTTAGGTATCCTGGAGACG-3′(198bp);COL-I 上游:5′-TGTTCGTGGTTCTCAGGGTAG-3′,下游 :5′-TTGTCGTACCAGGGTTCTTTC-3′(245 bp);COL-Ⅲ上游:5′-ATGGTGGCTTTCAGTTCAGC-3′,下游:5′-TGGGGTTTCAG AGAGTTTGG-3′(425 bp);βactin 上 游 :5′-TGTTGCCCTAGACTTCGAGCA-3′,下游:5′-GGACCCAGGAAGGAAGGCT-3′(155 bp)。总反应体系为 SYBR Premix Ex TaqTM10 μL,反应条件为:94 ℃ 2 min,94 ℃ 15 s,55 ℃ 15 s,69 ℃ 15 s, 共 40个循环进行扩增。采用 β-actin作为内参照,2-ΔΔCT法计算组间倍数。
1.7 统计学处理
2 结 果
2.1 各组小鼠血脂水平比较 见表1。模型组小鼠TC、TAG、LDL较空白对照组显著升高,HDL显著降低,差异具有统计学意义(P<0.01);SAEE各剂量组均能够显著降低动脉粥样硬化小鼠TC、TAG、LDL水平,升高HDL水平,其中以SAEE高剂量组效果最显著,差异具有统计学意义(P<0.01),其中SAEE中、高剂量组与SAEE低剂量组比较,差异均具有统计学意义(P<0.01),SAEE高剂量组与SAEE中剂量组比较,差异具有统计学意义(P<0.05)。
表1 各组小鼠血脂水平比较(mmol/L,±s)
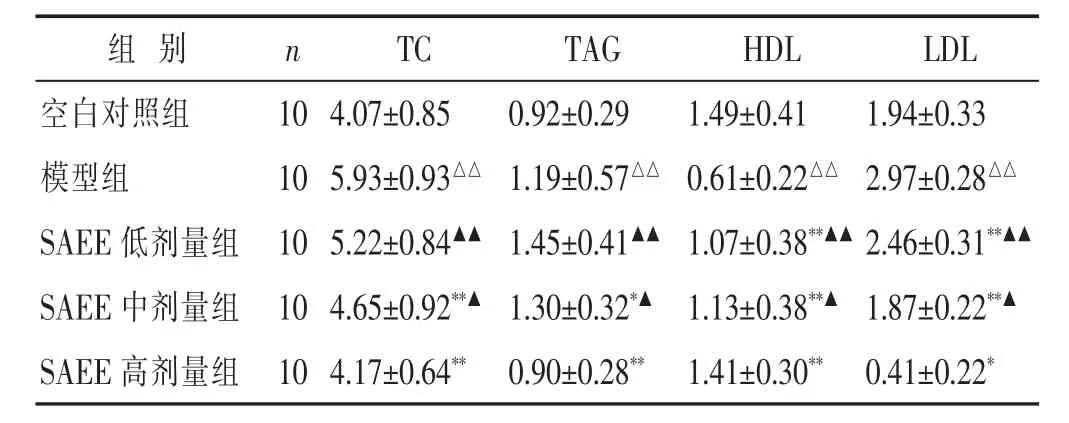
表1 各组小鼠血脂水平比较(mmol/L,±s)
与模型组比较,*P<0.05,**P<0.01;与空白对照组比较,△P<0.05,△△P<0.01;与 SAEE 高剂量组比较,▲P<0.05,▲▲P<0.01。 下同
组 别 n TC TAG HDL LDL 4.07±0.85 0.92±0.29 1.49±0.41 1.94±0.33 5.93±0.93△△ 1.19±0.57△△ 0.61±0.22△△ 2.97±0.28△△SAEE 低剂量组 10 5.22±0.84▲▲ 1.45±0.41▲▲ 1.07±0.38**▲▲ 2.46±0.31**▲▲SAEE 中剂量组 10 4.65±0.92**▲ 1.30±0.32*▲ 1.13±0.38**▲ 1.87±0.22**▲空白对照组 10模型组 10 SAEE高剂量组 104.17±0.64** 0.90±0.28** 1.41±0.30** 0.41±0.22*
2.2 各组小鼠TNF-α蛋白及mRNA表达比较 见表2,图1。模型组小鼠血清及组织中 TNF-α蛋白及mRNA的表达显著增高,与空白对照组比较,差异具有显著统计学意义 (P<0.01);SAEE各剂量均能显著降低动脉粥样硬化小鼠TNF-α蛋白及mRNA的表达,与模型组比较,差异均具有统计学意义(P<0.05或P<0.01),其中SAEE中、高剂量与SAEE低剂量组比较,差异均具有统计学意义(P<0.05或P<0.01),SAEE高剂量组与SAEE中剂量组比较,差异具有统计学意义(P<0.05)。
表2 各组小鼠TNF-α蛋白及mRNA表达比较(±s)
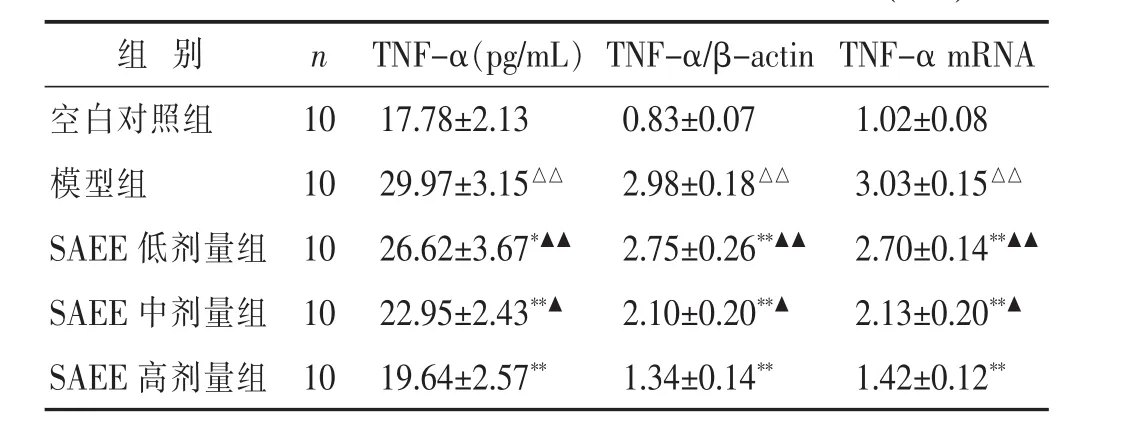
表2 各组小鼠TNF-α蛋白及mRNA表达比较(±s)
组 别 n TNF-α(pg/mL)TNF-α/β-actin TNF-α mRNA 17.78±2.13 0.83±0.07 1.02±0.08 29.97±3.15△△ 2.98±0.18△△ 3.03±0.15△△SAEE 低剂量组 10 26.62±3.67*▲▲ 2.75±0.26**▲▲ 2.70±0.14**▲▲SAEE 中剂量组 10 22.95±2.43**▲ 2.10±0.20**▲ 2.13±0.20**▲空白对照组 10模型组 10 SAEE高剂量组 1019.64±2.57** 1.34±0.14** 1.42±0.12**
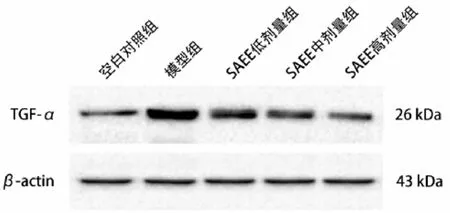
图1 各组小鼠组织中TNF-α蛋白表达电泳条带
2.3 各组小鼠ASK1-JNK信号通路及胶原蛋白表达比较 见表3,表4,图2。模型组小鼠p-ASK1、p-JNK蛋白的水平较空白对照组显著升高,P4H、COL-Ⅰ、COL-Ⅲ蛋白的水平和COL-Ⅰ/COL-Ⅲ的比值显著降低,差异均具有统计学意义(P<0.01),ASK1和JNK蛋白的水平与空白对照组比较,差异无统计学意义(P>0.05);SAEE中、高剂量组均能显著降低p-ASK1、p-JNK蛋白的水平,升高P4H、COL-Ⅰ、COL-Ⅲ蛋白的水平和COL-Ⅰ/COL-Ⅲ的比值,与模型组比较,差异均具有统计学意义(P<0.01),其中SAEE中、高剂量组与SAEE低剂量组比较,差异均具有统计学意义(P<0.05或P<0.01),SAEE高剂量组与SAEE中剂量组比较,差异具有统计学意义(P<0.05);而SAEE各剂量组中ASK1和JNK蛋白的水平与模型组比较,差异均无统计学意义(P>0.05)。
表3 各组小鼠ASK1-JNK信号通路及胶原蛋白表达比较(±s)
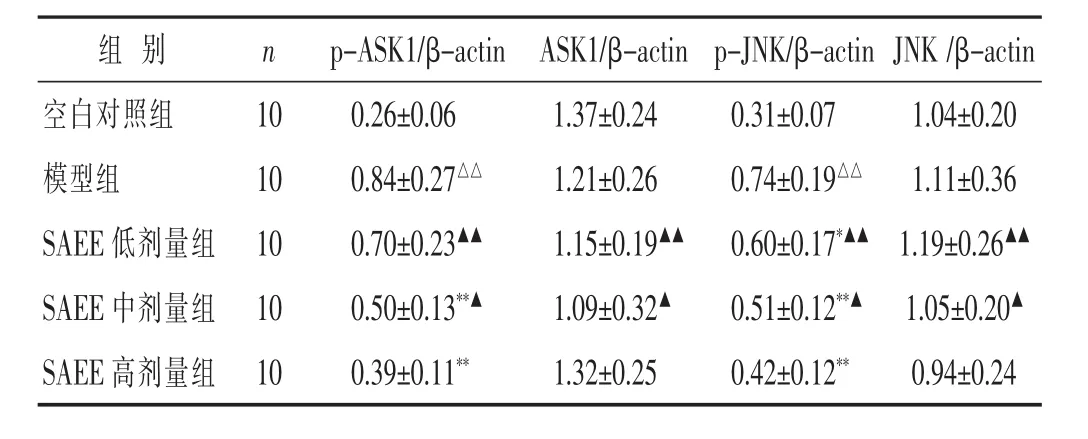
表3 各组小鼠ASK1-JNK信号通路及胶原蛋白表达比较(±s)
组 别 n p-ASK1/β-actin ASK1/β-actin p-JNK/β-actin JNK/β-actin 0.26±0.06 1.37±0.24 0.31±0.07 1.04±0.20 0.84±0.27△△ 1.21±0.26 0.74±0.19△△ 1.11±0.36 SAEE 低剂量组 10 0.70±0.23▲▲ 1.15±0.19▲▲ 0.60±0.17*▲▲ 1.19±0.26▲▲SAEE 中剂量组 10 0.50±0.13**▲ 1.09±0.32▲ 0.51±0.12**▲ 1.05±0.20▲空白对照组 10模型组 10 SAEE高剂量组 100.39±0.11** 1.32±0.25 0.42±0.12** 0.94±0.24
表4 各组小鼠ASK1-JNK信号通路及胶原蛋白表达比较(±s)
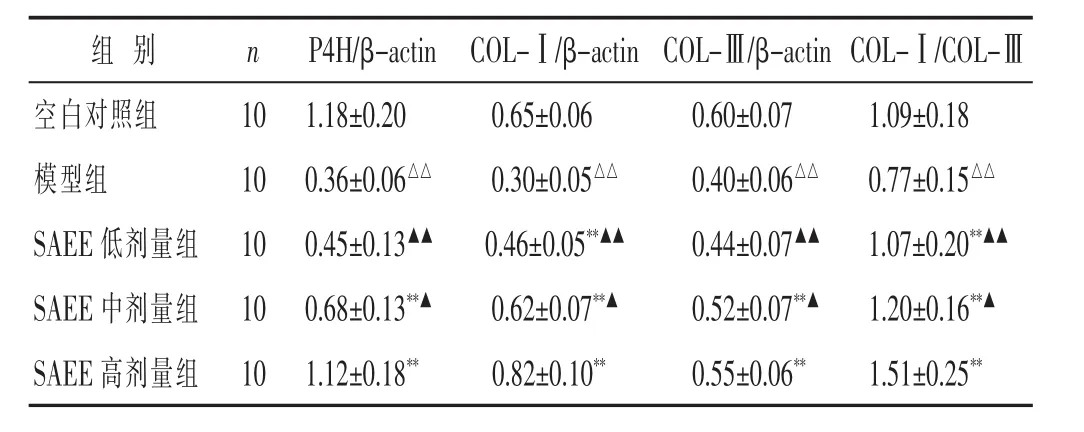
表4 各组小鼠ASK1-JNK信号通路及胶原蛋白表达比较(±s)
组 别 n P4H/β-actin COL-Ⅰ/β-actin COL-Ⅲ/β-actin COL-Ⅰ/COL-Ⅲ1.18±0.20 0.65±0.06 0.60±0.07 1.09±0.18 0.36±0.06△△ 0.30±0.05△△ 0.40±0.06△△ 0.77±0.15△△SAEE 低剂量组 10 0.45±0.13▲▲ 0.46±0.05**▲▲ 0.44±0.07▲▲ 1.07±0.20**▲▲SAEE 中剂量组 10 0.68±0.13**▲ 0.62±0.07**▲ 0.52±0.07**▲ 1.20±0.16**▲空白对照组 10模型组 10 SAEE高剂量组 101.12±0.18** 0.82±0.10** 0.55±0.06** 1.51±0.25**
2.4 各组小鼠ASK1-JNK信号通路及胶原mRNA的表达 见表5。造模后,模型组小鼠ASK1和JNK mRNA的水平较空白对照组显著升高,P4H、COL-Ⅰ、COL-ⅢmRNA的水平和COL-Ⅰ/COL-Ⅲ的比值显著降低,差异均具有统计学意义(P<0.01);SAEE各剂量组均能够降低动脉粥样硬化小鼠ASK1和JNK mRNA的水平,升高P4H、COL-Ⅰ、COL-ⅢmRNA的水平和COL-Ⅰ/COL-Ⅲ的比值,其中以SAEE高剂量组效果最佳,差异具有显著统计学意义(P<0.01),其中SAEE中、高剂量组与SAEE低剂量组比较,差异均具有统计学意义(P<0.05或P<0.01),SAEE高剂量组与SAEE中剂量组比较,差异具有统计学意义(P<0.05)。
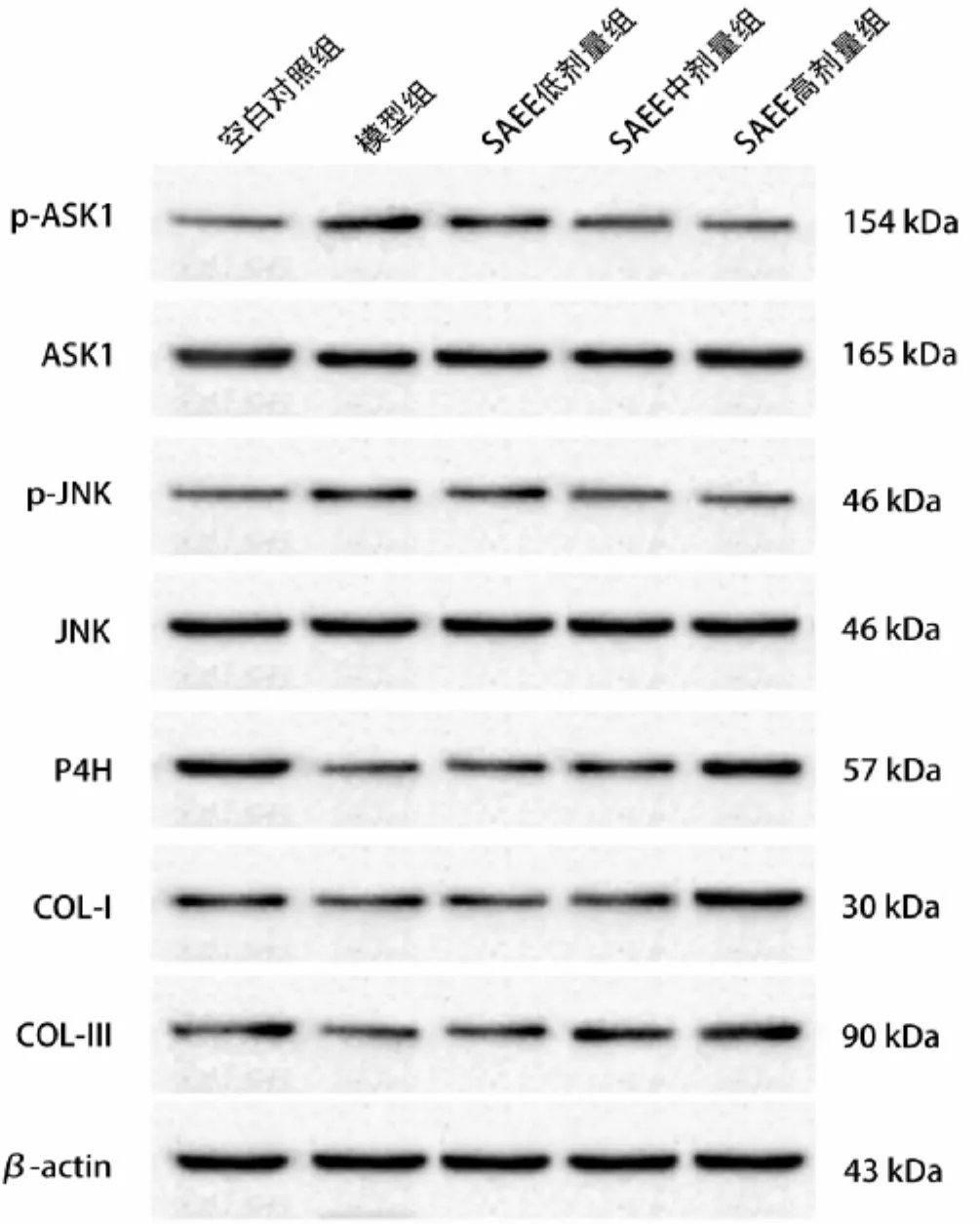
图2 各组小鼠组织中ASK1-JNK信号通路及胶原蛋白表达
表5 各组小鼠ASK1-JNK信号通路及胶原mRNA表达比较(±s)

表5 各组小鼠ASK1-JNK信号通路及胶原mRNA表达比较(±s)
组 别 n ASK1 JNK P4H COL-ⅠCOL-Ⅲ COL-Ⅰ/COL-Ⅲ0.92±0.05 1.15±0.13 0.73±0.07△△ 0.90±0.17△△SAEE 低剂量组 10 2.27±0.29▲▲ 2.18±0.40**▲▲ 0.60±0.08▲▲ 0.69±0.08▲▲ 0.72±0.07▲▲ 0.98±0.16▲▲SAEE 中剂量组 10 1.71±0.33**▲ 1.75±0.15**▲ 0.62±0.11*▲ 1.22±0.11**▲ 0.84±0.06**▲ 1.47±0.22**▲空白对照组 10模型组 10 0.97±0.08 0.94±0.11 1.07±0.18 2.55±0.57△△ 2.77±047△△ 0.48±0.05△△1.07±0.13 0.64±0.07△△SAEE高剂量组 101.48±0.22**1.26±0.18** 0.94±0.13**1.60±0.15**0.93±0.14** 1.75±0.28**
3 讨 论
冠状动脉粥样硬化性心脏病是由脂质代谢异常引起的以冠状动脉局灶性粥样斑块形成为病理特征的一类慢性免疫炎症性疾病,是目前我国最常见的心血管疾病之一[7]。ACS作为冠心病急性发病的主要类型,其不仅致残率高、并发症多,而且病死率高,严重威胁着人们的健康。据《中国心血管病报告2014》显示,我国ACS的发病率呈现逐年增加的趋势,其中城市地区急性心肌梗死的死亡率约为51.45/10万,而且由心血管疾病导致的死亡占城乡居民总死亡原因的首位[8]。因此,寻找一种安全、高效的治疗方案,及时防控粥样斑块的进展,改善ACS患者的预后、延长患者的生命,具有重要的意义。
目前认为冠状动脉内不稳定斑块的破裂和血栓的形成是ACS患者猝死的主要原因,而斑块的破裂多发生于纤维帽厚度小于100 μm的边缘处。调查研究显示,仅有20%的急性心肌梗死是由冠状动脉内狭窄超过70%的斑块破裂处,而超过70%的急性心肌梗死发生于狭窄小于50%的斑块破裂处,由此可见,斑块的稳定性较病变范围和狭窄程度,更能反映ACS发生的风险[9]。TNF-α是一种介导免疫反应和炎症反应的前炎性因子,不仅能够调节脂质的代谢,还能够通过刺激血管平滑肌细胞的增殖和细胞表型的改变,促进动脉粥样硬化的形成[10]。同时,TNF-α还可能通过刺激血管平滑肌细胞中MMP-9的表达,促进细胞外基质的降解,加速血管壁的重构、斑块的破裂和血栓的形成,导致 ACS 的发病[11]。
ASK1和JNK均为细胞丝裂原活化蛋白激酶(MAPK)家族成员,已被证实与动脉粥样硬化和术后再狭窄密切相关[12]。作为c-Jun氨基端激酶/p38丝裂原活化蛋白激酶(JNK/p38 MAPK)级联蛋白上游重要的激活因子,ASK1几乎能被所有的炎性因子激活,如TNF-α、IL-1等[13]。JNK信号通路作为MAPK重要的通路之一,能够通过促进细胞凋亡的发生,参与AS的发生。JNK包含双磷酸化功能区,活化的JNK能够与转录子c-Jun和ATF2的氨基末端结合,使发生磷酸化。研究发现在高脂喂养的模型动物颈动脉粥样硬化斑块的基底部和纤维帽中,JNK蛋白的表达明显增高,而通过喂养JNK抑制剂能够显著抑制动脉粥样硬化斑块的形成[14]。同时,通过敲除巨噬细胞的JNK基因,能够明显抑制脂质的摄取及粥样硬化斑块的泡沫化形成[15]。
P4H是胶原合成的限速酶,由两个α亚基和两个β亚基构成的四聚体,P4H能够通过羟化X-Pro-Gly序列上脯氨酸的残基形成羟基脯氨酸,在胶原的合成中起着重要的作用[16]。胶原是细胞外基质的主要成分,主要由内皮细胞和平滑肌细胞所分泌,对维持血管壁的通透性和完整性具有重要的意义。如前所述,纤维帽的完整是动脉粥样硬化斑块稳定性的重要标志,而纤维帽的破裂是细胞外基质降解和合成失调造成。COL-Ⅰ和COL-Ⅲ作为纤维帽的主要构成成分,与血管内纤维帽的形成、结缔组织斑块的形成密切相关[17]。COL-Ⅰ主要存在于稳定成熟的血管壁中层而COL-Ⅲ多见于增生活跃的不成熟血管,因此COL-Ⅰ的含量决定着斑块的稳定性,而COL-Ⅰ/COL-Ⅲ的比值间接反映了 AS 斑块的稳定性[18]。
我们的研究结果发现,SAEE能够显著降低动脉粥样硬化小鼠TC、TAG、LDL的水平,升高HDL的水平,说明SAEE具有显著的调脂功效;同时,SAEE能够显著降低动脉粥样硬化小鼠TNF-α蛋白及mRNA的表达,从而抑制体内的炎症反应。之前有研究发现,TNF-α能够通过激活ASK1-JNK信号通路,从而抑制平滑肌细胞中P4Hα1的表达,促进胶原的降解[19]。本研究中我们发现SAEE能够抑制ASK1-JNK信号通路中p-ASK1、p-JNK的磷酸化水平,进而促进下游P4H的表达,增加COL-Ⅰ、COL-Ⅲ的表达和COL-Ⅰ/COL-Ⅲ的比值,达到稳定斑块的目的,同时Realtime-PCR的结果进一步验证了我们的结果。
综上所述,SAEE能够通过抑制炎症反应,进而抑制ASK1-JNK信号通路的活化,促进胶原的表达,达到调控体内的血脂水平、稳定斑块的目的。

