活性污泥饲料对刺参养殖水质、消化率、营养组分和消化酶的影响
■王路平 吴 垠 姜大为 赵 静 李多慧 程 远
(1.大连市现代农业生产发展服务中心大连市水产研究所,辽宁大连116085;2.大连汇新钛设备开发有限公司,辽宁大连116039;3.近海(大连)生态发展有限公司,辽宁大连116085)
刺参(Apostichopus japonicus)自然分布于我国黄海、渤海海域,具有很高的营养价值[1]。辽宁是我国重要的刺参养殖主产区,2015 年全省刺参经济产值达120 亿元,约占渔业经济总产值8.1%[2]。随着刺参养殖产业的不断发展,优质饵料的供应需求逐渐加大,刺参饵料的主要原材料为鼠尾藻、马尾藻、大叶藻等大型海水藻类,但是近年来藻类资源量逐渐匮乏,很难满足刺参饵料市场的需求。目前很多学者开展了刺参饵料和营养学的研究[3-5],但是对刺参饵料原材料的开发还不够深入。刺参一般生活在岩礁底的浅海,营底栖生活,有研究表明刺参可以利用其他动物的残饵、粪便进行摄食[6-7]。活性污泥是室内工厂化大菱鲆养殖产生的代谢废物和残饵,通过生物包细菌降解处理的固体代谢物,含有一定量的粗蛋白质、粗脂肪和糖类等营养物质,可以满足刺参生长的营养需要。目前还没有刺参对活性污泥消化和吸收方面的研究。本实验通过在海参商品饲料中添加不同比例的活性污泥,研究活性污泥对刺参养殖水质、营养物质的消化能力、体壁营养组分和肠道消化酶活力的影响,为提高养殖鱼类污物的重复利用,开发适口性强、易于消化吸收的饲料原料提供理论依据。
1 材料与方法
1.1 刺参来源及规格
实验刺参取自大连金州三十里堡养殖场,平均体重为(0.97±0.09)g,挑选大小相似的健康个体进行分组实验。
1.2 活性污泥来源和饲料设计
材料取自全封闭循环水养殖大菱鲆的生物包中固体代谢物,本实验分别命名为污泥和活性污泥。污泥是在集污槽中直接收集的没有经过生物处理的大菱鲆粪便和残饵颗粒物等,活性污泥是大菱鲆养殖中的代谢物经过生物包中细菌降解处理后的脱落固体物。
实验饲料配制的基本成分为海参商品饲料、污泥、活性污泥,按照污泥和活性污泥在饲料中所占比例设置实验梯度。在实验饲料中适量添加鱼粉和沸石粉,使实验组蛋白质和脂肪与对照组海参商品饲料营养成分尽量保持一致。实验分为一个对照组和五个实验组,每组设三个重复。A组为对照组,B组为污泥实验组,C、D、E、F组为活性污泥实验组。各组饲料的配比如表1。

表1 实验饲料组成和营养水平(%)
根据以上各组饲料组成,我们将混合饲料涂在波纹板上投喂,并且适量添加粘合剂增加饲料附板的粘力。涂板投喂可以减少饲料在水中的溶失,便于研究海参的摄食情况。
1.3 日常管理及操作
养殖槽规格为50 cm×40 cm×80 cm,槽内弱充气。海水取自大连黑石礁海域经过沙滤沉淀处理,槽内养殖水温(14±1) ℃,pH 值7.9~8.4,盐度30~32。每天早晨按照刺参体重的8%投放饲料板,投喂前清除粪便和残饵并全量换水。养殖室内避光处理,白天光照小于600 Lx。
1.4 样品测定与分析方法
1.4.1 水质指标
从投入饲料开始每隔3 h测刺参养殖槽内水样的pH 值、溶解氧、氨氮、亚硝酸盐指标,每隔6 h 测定活性磷酸盐和化学耗氧量指标。溶解氧采用碘量法测定;pH值使用PHS-25型pH计测定;化学耗氧量采用碱性高锰酸钾法测定;氨氮采用次溴酸盐氧化法测定;亚硝酸盐采用重氮偶氮比色法测定;活性磷酸盐采用磷钼蓝比色法测定。
1.4.2 饲料消化率
60 d养殖实验中每隔15 d记为一个周期,共四个周期。按饲料重量的0.5%加入三氧化二铬,投喂饲料后采集粪便,分别测定饲料和粪便中Cr2O3的含量(SC/T 1089—2006)。

式中:B——饲料中Cr2O3的含量;
B′——粪便中Cr2O3的含量。

式中:B——饲料中Cr2O3的含量;
B′——粪便中Cr2O3的含量;
A——饲料中营养物质的含量;
A′——粪便中营养物质的含量。
1.4.3 刺参营养组分分析
在实验第30 d和60 d从各组随机取出刺参并立即解剖,去除体内石灰环、肠等器官,去离子水冲洗体壁后装入干净的聚乙烯干燥袋封口于-80 ℃低温保存备用。水分含量采用105 ℃常温加热干燥法(GB/T 6435—1986)测定;灰分含量采用马福炉焚烧法(GB/T 6438—1994)测定;粗蛋白质含量采用凯氏定氮法(GB/T 6432—1994)测定;粗脂肪采用索氏抽提法(GB/T 6433—1994)测定;总糖含量采用硫酸-酚法测定。
1.4.4 肠组织粗酶提取液制备和活力测定
在实验第30 d和60 d从各组随机取出刺参,刺参停食72 h排空食物残渣后,采集刺参肠组织,使用玻璃匀浆器在冰盘中研磨肠组织,并用磷酸盐缓冲溶液稀释10 倍制成匀浆液。将匀浆液在4 ℃下5 000 r/min离心20 min,取上清液作为粗酶提取液。
蛋白酶活力采用福林-酚法测定(国标QB/T 1803—93),在37 ℃下每分钟水解酪素产生1 μg酪氨酸为一个酶活力单位;淀粉酶活力采用淀粉-碘显色法测定,在37 ℃下30 min内100 ml酶液中的淀粉酶完全水解淀粉10 mg为一个酶活力单位;纤维素酶活力采用3,5-二硝基水杨酸法测定,在37 ℃下每分钟催化纤维素水解生成1 μg葡萄糖的酶量为一个酶活力单位;可溶性蛋白含量采用考马斯亮蓝法测定,计算各组织酶比活力,即单位质量蛋白所含酶活力单位数。
1.4.5 数据计算及处理
数据均以“平均值±标准差”表示,用SPSS13.0软件进行单因素方差分析, 用Duncan′s多重比较法进行各组间平均值的差异显著性比较,以P<0.05为差异显著。
2 结果
2.1 饲料对刺参24 h水质指标的影响
2.1.1 pH值变化(见图1)
由图1可知,六个实验组在饲料投喂的24 h内变化趋势大致相同。刚投喂饲料时各组pH 值在7.65~7.74 之间。在3 h 之后除了污泥组(pH 值7.76)增长较慢外,其他各组升高幅度较明显,在7.91~7.93 之间。在随后的15 h 内各组呈升高趋势但是涨幅并不明显,pH 值在7.78~7.93 之间。在最后的3 h 各组pH值均有下降,至24 h各组pH值在7.74~7.85之间。

图1 不同饲料组24 h pH值变化
2.1.2 溶解氧变化(见图2)

图2 不同饲料组24 h溶解氧变化
由图2 可知,饲料在投喂初始各组溶解氧含量在8.71~9.26 mg/l 之间,在前12 h 内各组溶解氧含量基本保持一致在8.71~9.52 mg/l之间浮动。在以后12 h内污泥组溶解氧含量开始下降,至21 h时污泥组下降至最低点,达到7.84 mg/l,从图2 可知溶解氧含量比其他组都低。其余各组溶解氧含量变化比较平稳,在8.72~9.94 mg/l之间浮动。
2.1.3 亚硝酸盐浓度变化(见图3)
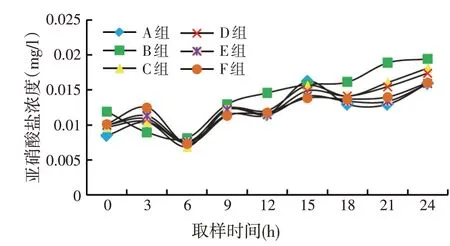
图3 不同饲料组24 h亚硝酸盐浓度变化
由图3可知,各组亚硝酸盐浓度在投喂初始含量基本一致,在0.008 5~0.011 9 mg/l 之间。在投喂6 h时各组均降至最低点,在0.007 4~0.007 6 mg/l 之间。此后各组亚硝酸盐浓度开始增高并且上升幅度较大。在投喂饲料24 h 时各组亚硝酸盐浓度上升至最高点,在0.016~0.019 mg/l 之间。在亚硝酸盐浓度上升过程中污泥组的值比其他各组都高。
2.1.4 氨氮浓度变化(见图4)

图4 不同饲料组24 h氨氮浓度变化
由图4可知,除40%和5%活性污泥组外,各组氨氮值在投喂初浓度最低,并且差异不大,各组浓度值在0.208~0.223 mg/l 之间,在随后的24 h 内各组氨氮含量总体呈升高趋势。24 h各组氨氮值达到最高点,其中污泥组氨氮值最高(0.467 mg/l),40%活性污泥组氨氮值最低(0.404 mg/l)。从图4 可以看出污泥组在24 h内氨氮含量比其它组都高,在前6 h表现不明显,但在随后的18 h内表现较为明显。
2.1.5 磷酸盐浓度变化(见图5)

图5 不同饲料组24 h磷酸盐浓度变化
由图5 可知,各组活性磷酸盐在投喂初含量较低,在0.042 mg/l(对照组)与0.067 mg/l(50%活性污泥组)之间。以后各组磷酸盐含量均呈上升趋势。其中污泥组在第6 h上升至最高点(0.097 mg/l),随后含量在0.092(12 h)~0.093 mg/l(24 h)之间,变化较为平稳。其余各组含量均比污泥组低,其中对照组在24 h时含量最低。
2.1.6 化学耗氧量变化(见图6)

图6 不同饲料组24 h化学耗氧量变化
由图6 可知,各组化学耗氧量初始值在3.36~3.60 mg/l之间,在24 h内各组变化不明显。污泥组在6 h 后含量达到最高点(3.86 mg/l),此后含量略有下降,在3.71~3.76 mg/l 之间浮动。其余各组含量均小于污泥组。对照组含量在24 h 内较低,除了在18 h(3.46 mg/l)高于50%活性污泥组(3.35 mg/l)外,其余时间均低于其他实验组。
2.2 各组刺参对饲料的消化率(见表2)
由表2可知,在60 d四个周期中各组刺参对饲料的消化率总体呈上升趋势;其中对照组刺参饲料消化率和对饲料粗蛋白质消化率最高,其次为20%活性污泥组,与其它组均差异显著(P<0.05)。而污泥组刺参对饲料及粗蛋白质消化率最低。在投喂15 d后,各组刺参随着投喂活性污泥的比例增加,刺参对饲料总消化率及粗蛋白质消化率总体呈现递减趋势;从四个周期(60 d)各组刺参对饲料脂肪消化率来看,20%活性污泥组刺参对粗脂肪消化率最高,污泥组刺参对粗脂肪消化率最低,与其它各组差异显著(P<0.05)。在实验前30 d,投喂活性污泥刺参粗脂肪消化率高于对照组。在实验后30 d,50%活性污泥组粗脂肪消化率与对照组差异不显著(P>0.05);前30 d对照组刺参糖消化率最高,与其他各组差异显著(P<0.05)。后30 d 20%活性污泥组刺参糖消化率最高,与对照组差异性显著(P<0.05)。污泥组刺参对糖消化率最低,与其他各组均差异显著(P<0.05)。
2.3 饲料对刺参营养组分的影响(见表3)
分别在实验的第30 d和第60 d对各组刺参随机取样,测定刺参体壁的粗蛋白质、粗脂肪、总糖、灰分和水分。第30 d时,30%活性污泥组刺参粗蛋白质含量最高,与其他五组差异显著(P<0.05),污泥组刺参粗蛋白质含量最低,其中C、D、F组刺参粗蛋白质含量差异不显著(P>0.05);对照组和30%活性污泥组刺参粗脂肪含量最高,两组之间差异不显著(P>0.05)。对照组刺参粗脂肪含量最高,与20%和30%活性污泥组差异不显著(P>0.05),但与污泥组、40%和50%活性污泥组差异显著(P<0.05)。对照组总糖含量最高,20%活性污泥组次之,两组之间差异不显著(P>0.05),污泥组总糖含量最低,与各组差异显著(P<0.05);污泥组灰分含量最高,与其他五组差异显著(P<0.05),30%活性污泥组含量最低,与其它组差异显著(P<0.05)。

表2 四个周期(60 d)不同饲料组刺参对饲料的消化率(%)

表3 不同饲料组刺参基本营养成分(干重%)
第60 d时,30%活性污泥组刺参粗蛋白质含量最高,与其它组差异显著(P<0.05)。污泥组含量最低并与其它组差异显著(P<0.05);A、D、E、F组刺参粗脂肪含量最高,四个组之间差异不显著(P>0.05)。污泥组和50%活性污泥组粗脂肪含量最低,两组差异不显著(P>0.05);A、E组和F组刺参总糖含量最高,三组间差异不显著(P>0.05);污泥组灰分含量最高,20%活性污泥组最低,除了C组和D组差异不显著外(P>0.05),其余各组之间差异显著(P<0.05)。
2.4 不同投喂组刺参肠道蛋白酶比活力(见图7)
第30 d 对照组刺参肠道蛋白酶比活力最高(0.560 U/mg),污泥组肠道蛋白酶比活力最低(0.142 U/mg.),6 组刺参肠道蛋白酶比活力均差异性显著;第60 d 对照组的刺参肠道蛋白酶比活力(0.650 U/mg)和20%活性污泥组(0.516 U/mg)较高,两组之间差异显著(P<0.05)。污泥组肠道蛋白酶比活力最低(0.182 U/mg),与其他五组差异均显著(P<0.05)。D、E两组肠道蛋白酶比活力差异不显著(P>0.05)。

图7 不同饲料组刺参肠道蛋白酶比活力
2.5 不同投喂组刺参肠道淀粉酶比活力(见图8)

图8 不同饲料组刺参肠道淀粉酶比活力
第30 d 对照组刺参肠道淀粉酶比活力最高(3.32 U/mg),污泥组淀粉酶比活力最低(1.31 U/mg),六组之间E 组与C、E 组与F 组差异不显著(P<0.05);第60 d 20%活性污泥组刺参淀粉酶比活力最高(4.49 U/mg),与其它五组差异显著(P<0.05)。污泥组和50%活性污泥组淀粉酶比活力最低,两组之间差异不显著。
2.6 不同投喂组刺参肠道纤维素酶比活力(见图9)
第30 d 对照组刺参肠道纤维素酶比活力(0.046 U/mg)和20%活性污泥组刺参肠道纤维素酶比活力(0.045 U/mg)最高,两组之间差异不显著(P>0.05)。污泥组最低(0.017 U/mg),与其它五组差异显著(P<0.05);第60 d 20%活性污泥组(0.063 U/mg)和对照组(0.056 U/mg)最高,两组之间差异不显著(P>0.05)。污泥组肠道纤维素酶比活力最低(0.032 U/mg),并且与其它五组差异显著。

图9 不同饲料组刺参肠纤维素酶比活力
3 讨论
3.1 饲料对刺参养殖水质的影响
实验组饲料是添加大菱鲆代谢废物(污泥)和经过流化床曝气处理的代谢废物(活性污泥)。这些代谢废物主要成分是碳水化合物、脂肪、蛋白质、磷等有机质,另外还包括工厂化养殖中未被大菱鲆摄食的残饵等。将它们作为饲料投入水中,可能会对刺参养殖水体产生一定的负面影响。苗淑彦等[8]认为水产动物代谢废物能够消耗水中溶氧,使水中H2S 含量增加,影响正常的消化作用,对养殖动物具有毒害影响。付成东等[9]研究显示养殖残饵和粪便会加速厌氧细菌繁殖,促进有机质转化成氨氮和硫化氢,导致养殖水体富营养化。通过本实验数据我们看到各组水质昼夜pH值变化不大,在7.65~7.93之间;实验中不间断充氧所以各组之间溶氧含量差异不大,昼夜幅度在7.85~9.94 mg/l之间,基本能够满足刺参对水质溶解氧的要求。在氨氮、亚硝酸盐、活性磷酸盐、化学耗氧量等指标,污泥组的浓度比对照组和活性污泥组都高,而对照组和活性污泥实验组间差异不大。Seymour等[10]研究显示在鱼类养殖中1吨鱼的排泄物会产生9 kg磷、52 kg氮和500 kg生物耗氧量。Gowen等[11]认为,养殖50吨鱼1年会产生19.4吨有机碳、2.2吨有机氮和4吨可溶性含氮化合物。因此把鱼类代谢废物作为刺参饲料添加剂,在平时养殖管理中要及时检测水质,严格控制水中有害成分的含量。本实验中的活性污泥通过流化床上附着在生物膜上的硝化细菌等有益菌可以有效去除氮、硫污染物[12-13],对养殖水质的影响较小。另外在养殖实验过程中每天全量换水,因此养殖水质的各项指标基本符合刺参正常生长要求。
3.2 刺参对饲料营养成分消化的影响
消化率是影响水产动物生长的重要指标,有研究表明影响水产动物消化率的因素有饵料营养成分、环境水温、饲料形状大小和动物生理状况等[14-15]。本实验前期刺参对活性污泥的吸收率低于刺参商品饲料,但实验后期刺参对活性污泥的吸收率均有不同程度的提高,说明刺参对活性污泥饲料具有一定的适应性。在活性污泥饲料中刺参对20%添加量的饲料吸收率较好,尤其在实验后期添加20%的活性污泥刺参对糖和粗脂肪的消化率最高。脂类是重要的能源物质,水产动物对脂类的吸收可以促进生长,降低对饲料粗蛋白质的需求。有研究表明对虾饲料脂肪最适量为6%~10%之间[16],海水鱼类饲料脂肪含量最适量为10%~13%[17]。刺参属于低营养级的沉食性生物,消化器官较简单,自身对营养物质的消化率较低,有研究显示刺参较鱼类和对虾对脂肪需求量较低,饲料最适含量为5%[4]。本实验活性污泥饲料的脂肪含量较商品饲料高,适量地增加脂肪含量可以促进刺参的生长,与王吉桥等[18]研究结果一致。在水产饲料原料中糖类是较为经济的能源物质,可以直接为动物提供能量来源[19]。本实验刺参对污泥和活性污泥的糖类消化率较低,可能与饲料中糖类原料的成分有关,有待进一步的研究。
3.3 饲料对刺参体壁营养组成和肠道消化酶比活力的影响
刺参体壁为主要食用部位,是衡量刺参营养品质的重要部位。干品刺参蛋白质含量为34%~60%,总脂含量为3.5%,糖类含量在2.1%~3.8%,灰分含量可达28%~37%[20-22]。本实验各组刺参经过60 d 养殖体壁的营养成分均有增加,其中投喂30%活性污泥的刺参体壁蛋白质含量较高,说明活性污泥可以作为饵料有效增加刺参的营养成分。投喂污泥的刺参体壁各项营养成分都较低,与刺参对污泥营养成分的吸收率低有一定关系。刺参消化酶大部分集中在消化道的前肠和中肠,消化酶的活力能够体现刺参对饵料消化吸收的能力[23]。刺参消化酶活性受水温、盐度、饵料成分、水质环境等因素影响[24-25]。实验中各组刺参消化酶比活力均有提高,其中投喂商品饲料的刺参蛋白酶比活力较高,投喂20%活性污泥的刺参淀粉酶和纤维素酶比活力较高,大体与各组刺参对饲料粗蛋白质和糖类营养成分的吸收率有一定关系。投喂污泥的刺参消化酶比活力最低,可能与污泥对养殖水质的影响有关。污泥投入水中后氨氮和亚硝酸盐含量较其它各组高,会影响刺参的摄食行为。胡炜等[26]研究表明氨氮胁迫对刺参生长和消化酶活性具有明显的影响作用。如何充分利用污泥替代蛋白质饲料原料,不仅要考虑营养组分的搭配比例,还要考虑饲料对养殖环境因子的影响。
4 结论
饲料中添加适量活性污泥不会对养殖刺参水质造成危害影响,同时活性污泥作为一种粗蛋白质饲料来源,易于被刺参消化吸收,能够改善刺参营养成分和消化酶比活力。

