hucMSCs-Exo对子痫前期孕鼠血清sFLt-1 VEGF的影响
熊智慧 王欣晨 官海涟 金美媛
子痫前期(PE)一直是临床研究的热点,是导致不良妊娠结局的主要疾病,其发病机制复杂,有大量的证据显示胎盘血管形成异常是子痫前期发病过程中的一个中心环节,血管生成是血管内皮细胞增殖、迁移和细胞外基质降解共同参与过程,受血管生成因子和抗血管生成因子的调节[1]。人脐带间充质干细胞源外泌体(hucMSCs-Exo)是人脐带间充质干细胞(hucMSCs)通过旁分泌方式产生的一种直径约30~100nm的膜性小囊泡,hucMSCs-Exo中含有多种蛋白质,在生物活动中起重要的调控作用,包括血管生成、免疫应答、炎症反应、细胞凋亡等[2-3]。已有研究报道外泌体可以促进人脐静脉血管及脑血管的新生[4-5],并发现hucMSCs培养液能有效刺激胎盘血管再生[6],而hucMSC产生的外泌体能否刺激胎盘血管再生尚不清楚。本研究将hucMSCs-Exo用于子痫前期胎盘血管形成异常的孕鼠模型干预治疗,从胎盘血管内皮功能修复、胎盘微血管密度来评价hucMSCs-Exo的生物学效应,为子痫前期的治疗探索一种具有广泛应用前景的生物制剂。
1 材料与方法
1.1 主要试剂与材料 人脐带间充质干细胞购自广州赛业生物科技有限公司;10周龄健康SD雌性大鼠(200~250 g)购自第二军医大学实验动物中心[SCXK(沪)-2013-0016];流式细胞仪(美国BD公司);FEI Tecnai 12 型透射电子显微镜(Philips 公司);Biorad Gel Dol EZ 成像仪(GEL DOC EZ IMAGER,Biorad,California,USA)。
1.2 hucMSCs及hucMSCs-exo的分离提取及鉴定 人脐带间充质干细胞,获取P3代细胞分别从形态学进行观察,流式细胞计数进行细胞表面标志CD45、CD29、CD90、CD34、CD105鉴定、成骨成脂试验进行分化能力的鉴定。超速离心取出FBS中的外泌体待用。P3代hucMSCs融合至90%左右时将培养基更换为无血清培养基培养48h后,充分收集上清液。利用超速离心方法从hucMSCs培养上清液中获取hucMSCs-exo,分别进行电镜及蛋白CD63和CD81的鉴定。采用Image J软件对目的条带进行灰度值分析。
1.3 实验动物分组与处理 取50只受孕成功的SD大鼠连续腹腔注射L-NAME,建立子痫前期模型大鼠[7],将模型大鼠分为5组,分别为PE组(n=10,不做任何处理)、PE+NC组[n=10、孕14d腹腔注射无菌生理盐水,0.5ml/(只·d),共6d];L-Exo组[n=10,孕14d腹腔注射浓度为120μg/ml的外泌体,0.5ml/(只·d),共6d]、M-Exo组[孕14d腹腔注射浓度为140μg/ml的外泌体,0.5ml/(只·d),共6d]、H-Exo组[孕14d腹腔注射浓度为160μg/ml的外泌体,0.5ml/(只·d),共6d]。
1.4 标本收集及检测 (1)实验结束时,麻醉大鼠后,开腹取腹主动脉血。ELISA检测血清血管生成因子(VEGF)和抗血管生成因子可溶性fms-样酪氨酸激酶受体-1(sFlt1)的水平;(2)剖宫取出胎盘组织,剪取合适大小胎盘组织于多聚甲醛溶液中固定,石蜡包埋进行免疫组化检测。
1.5 统计学方法 采用SPSS 21.0 统计软件。计量资料以(x±s)表示,两两比较采用最小显著差法(LSD法),多组之间的比较采用One-Way ANOVA 单因素方差分析,服从正态分布的计量资料两组之间的比较采用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 hucMSCs-Ex的提取和鉴定 透射电镜下观察到一组直径为30~100 nm、大小不等的圆形或椭圆形膜囊泡。膜结构在囊泡周围区域明显,胞内的电子密度较低,见图1A。Western blot结果显示hucMSCs-exo有高表达CD63和CD81,见图1B-C。以上结果表明,hucMSCs-exo被成功分离。
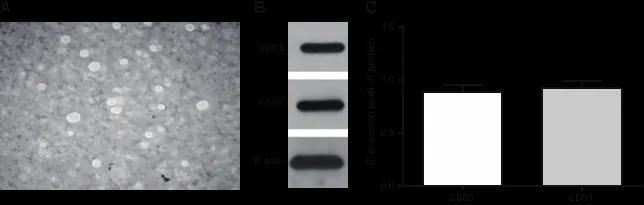
图1 A hucMSCs-Ex在透射电镜下的形态学(×100000);B hucMSCs-Ex的Western blot鉴定;C hucMSCs-Ex细胞阳性表达CD63和CD81
2.2 hucMSCs-exo对孕鼠胎盘微血管密度(MVD)的影响 采用免疫组化法检测胎盘组织中MVD,显微镜下观察胎盘组织CD31 阳性细胞表达情况,见图2A-B,400倍视野下计算单位面积内CD31 阳性微血管数目,随机选取5个视野,取平均值。结果显示PE组和PE+NC组比较,MVD在L-Exo组,M-Exo组和H-Exo组明显升高,H-Exo高于L-Exo组和M-Exo组(P均<0.05)。MVD在M-Exo组明显高于L-Exo组,差异无统计学意义(P>0.05),见表1。
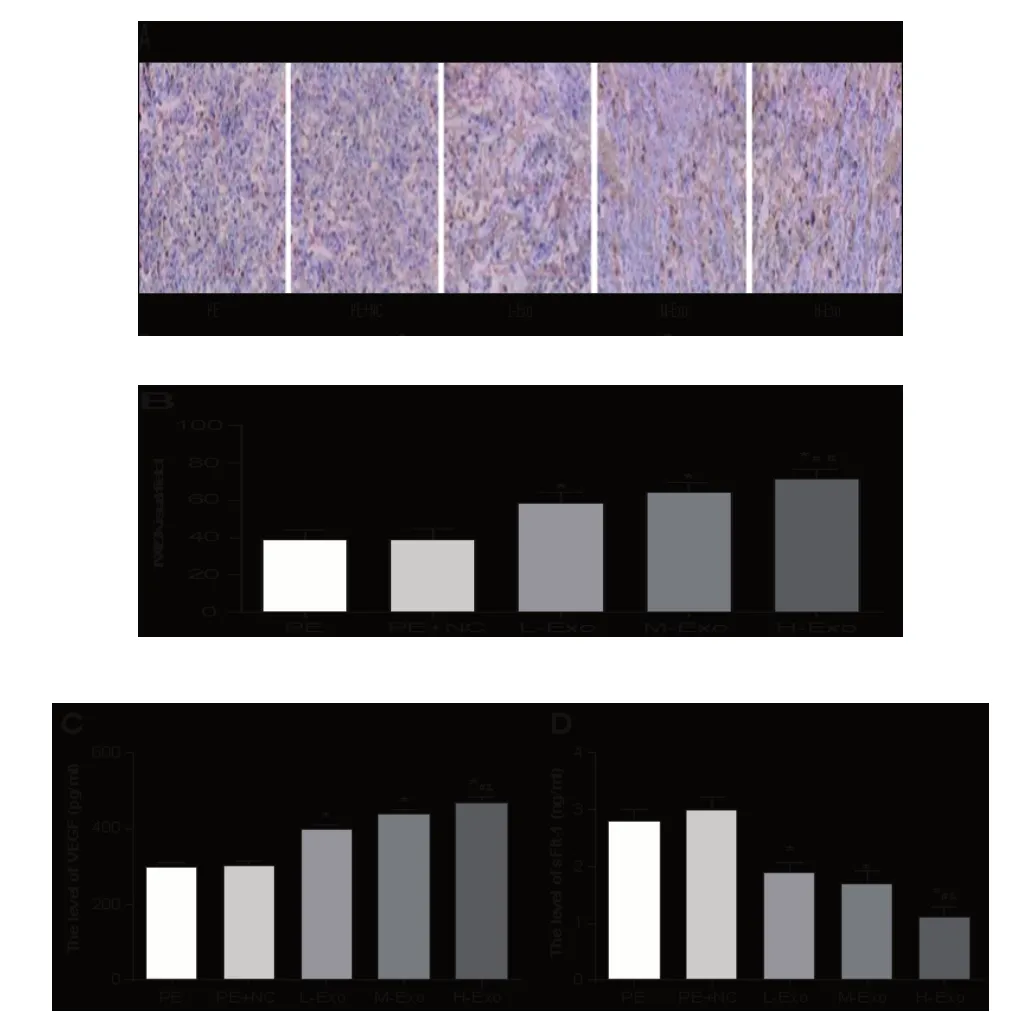
图2 A:免疫组化法检测各组大鼠胎盘CD31的阳性表达;B:各组大鼠的MVD;C:各组大鼠血清中VEGF的表达;D:各组大鼠血清中sFLT1的表达

表1 hucMSCs-exo对大鼠胎盘微血管密度的影响(x±s)
2.3 hucMSCs-exo对孕鼠血清sFlt-1及VEGF的影响 ELISA进行VEGF和sFlt-1表达的确定,见图2C-D,结果:PE组与PE+NC组比较,差异无统计学意义(P>0.05)。同时还发现,VEGF的表达在L-Exo组、M-Exo组和H-Exo组明显高于PE组和PE+NC组,而sFlt1的表达在PE组和PE+NC组则明显下降,并且H-Exo组与PE组和PE+NC组相比有显著差异,见表2-3。结果表明hucMSCs-exo通过抑制sFlt-1和促进VEGF的产生来促使血管内皮修复,从而增加胎盘微血管密度,达到改善子痫前期大鼠胎盘的形态。

表2 hucMSC-exo对大鼠血清sFlt-1表达水平的影响(x±s)

表3 hucMSCs-exo对大鼠血清VEGF表达水平的影响(x±s)
3 讨论
子痫前期是妊娠期常见的并发症,每年有50000~100000孕产妇死于子痫前期,是孕产妇死亡的主要原因之一[8]。子痫前期可影响机体各器官系统功能,在临床上是医源性早产最常见的原因,可导致胎儿生长受限、胎盘早剥以及围生儿死亡。
子痫前期一直被临床所关注,经过长期的探索研究,总结出多种治疗子痫前期的方法,包括血管生成因子、血管舒张药物、抗炎药物及减少氧化应激的药物的应用等[9],但目前尚处于基础研究阶段,因此寻找能够促进血管内皮功能恢复,胎盘血管生成的治疗方案尤为关键。近年间质干细胞(MSCs)在一些领域已取得一定的成就,如细胞替代治疗、器官移植及再生医学[10],但MSCs对人体也存在一定的负面作用,在免疫抑制和免疫调节中的不可控性,潜在的致瘤性,异常堆积等[11],因此,MSCs在疾病的治疗中受到了限制。而外泌体作为机体细胞分泌的活性囊泡,所表现出来的治疗优势被越来越多的学者所认识。外泌体性能相对稳定,不存在异倍体性的风险,免疫排斥机会小,并且具有母体细胞相似的生物学作用[12],MSCs-Exo在某些疾病如神经系统疾病、免疫系统疾病及女性生殖系统疾病等动物实验中已表现出良好的治疗策略。
本研究结果发现,子痫前期大鼠可出现胎盘血管不同程度的异常,并与疾病的严重程度呈正相关,治疗组经过1个疗程的外泌体治疗后,胎盘的MVD显著升高(P<0.05),并且通过大鼠血清中sFlt-1、VEGF的蛋白量对比发现,经过1个疗程的外泌体治疗后,治疗组的VEGF的蛋白表达量较对照组有不同程度的升高趋势(P<0.05),而sFlt-1蛋白则有不同程度的下降趋势(P<0.05)。上述研究结果提示hucMSCs-exo可在一定程度上恢复VEGF分泌的能力,促进血管内皮功能的恢复。其作用机制可能是hucMSCs-exo作为一种炎症调控因子参与免疫调节,上调VEGF同时下降sFlt-1的表达发挥免疫调节作用和微环境调控的方式,继而达到恢复血管内皮的功能。由此可见,一定浓度的hucMSCs-exo对SD大鼠血管内皮功能有一定的修复作用,能够恢复胎盘血管生成能力。根据上述研究结果,可以推测hucMSCs-exo的胎盘移植,有望成为临床防治子痫前期的新方式,然而其具体作用机制还需要进一步的研究,今后可以对hucMSCs-exo所携带的蛋白质及核酸分子进行分析,找出其有效成分及发挥重要作用的细胞信号通路,或者通过人工生物合成其有效成分,更直接的促进血管内皮功能的恢复及胎盘血管的生成,对临床治疗子痫前期具有重要的指导意义。
综上所述,通过本实验研究证实,hucMSCsexo可有效改善血管内皮功能,这种作用可通过调整sFLt-1与VEGF来发挥作用,hucMSCs-exo可以成为临床防治子痫前期的新方法,但仍需要更加深入的研究来验证。
——外泌体与老年慢性疾病相关性的研究进展

