2种高效液相色谱法测定小米中黄色素的比较
王 喆,郝瑞丽,陈利青,马芳芳,韩渊怀,3,张 彬,3
(1.山西农业大学农学院,山西 太谷 030801;2.山西农业大学生物工程研究所,山西 太谷 030801;3.杂粮种质资源发掘与遗传改良山西省重点实验室,山西 太谷 030801)
随着人们生活品质的提高,越来越多的人开始注重养生,由于杂粮具有保健功能[1-3],人们对杂粮的需求量也越来越大,与此同时,对其品质的要求也越来越高。谷子(Setaria italica)作为我国古老且种植面积最大的杂粮作物之一[4-5],主要分布在干旱和半干旱地区[6],其营养价值很高,含丰富的矿质元素和维生素,它不仅供食用,还有药用功能[7]。谷子脱壳之后称为小米,有黄、白、绿等颜色。经统计,在众多米色性状中,黄米居多。有研究表明,米色是衡量小米品质的重要指标,小米米色越黄,米饭的口感越好[8-9],而小米中的黄色素含量对其外观品质有很大的影响[10],而且许多食品的着色剂中都有小米黄色素[11-12]。因此,挖掘一种测定黄色素更加高效、准确的方法具有十分重要的意义。
目前,对于小米中黄色素的研究并不多[10]。王海棠等[13]通过从小米中提取黄色素,确定了其主要化学成分,并发现这些成分对光和酸较敏感,对氧化还原反应和热反应具有一定的稳定性,但由于条件有限,并没有准确测出黄色素的组成成分[14-15]。贾鹏禹等[10]通过多种化学技术分析小米黄色素,发现其化学成分与玉米黄色素基本相同,属天然类胡萝卜素。刘晓庚等[16]研究表明,类胡萝卜素在深色谷物含量较多。李福乾等[17-22]的研究中详细介绍了类胡萝卜素的理化性质及生理功能。李赫等[23]的研究中用C18 反相液相色谱分析法分离类胡萝卜素类物质,效果良好;惠伯棣等[24]通过采用C30 反相液相色谱法分析类胡萝卜素类物质,发现该方法在异构体分辨和分析专属性方面比C18 更好。
近年来,随着黄色素越来越多地应用于生产实践[25-27],黄色素的相关研究也越来越多。研究测定黄色素的方法不仅可以为食品安全测定提供依据,且可以加快高品质育种进程[28-30]。如C18 柱对非极性类胡萝卜素顺/反异构体的能力比C30 柱的分离差[24],而C30 柱需要与适合的洗脱模式结合才能达到良好的分离效果。目前,关于测定黄色素及其组分含量的方法鲜见报道。
本研究以黄、白、绿3 种颜色的小米品种为试验材料,通过2 种高效液相色谱法分离出黄色素的主要成分,并测定各成分的含量,探究其含量对米色的影响,以期建立一种更加合理、高效的测定黄色素主要组分及含量的方法,为今后选育高叶黄素谷子品种提供理论依据。
1 材料和方法
1.1 试验材料和试剂
1.1.1 试验材料 试验材料为晋谷21 号(JG21)、支生谷(ZSG)和大青谷(DQG),其中,晋谷 21 号为山西省农业科学院经济作物研究所通过对晋汾52号进行60Coγ 射线辐射诱变选育而成,其品质极好,不仅外观看上去金灿灿的很诱人,蒸煮后还有饭香且口感好,因此,大家认为其为顶级米质,曾5 次获全国农博会优质谷米金奖[31-32]。支生谷和大青谷为农家品种,其小米米色呈白色和绿色。
1.1.2 试验试剂 水饱和正丁醇、甲醇(色谱纯)、MTBE(甲基叔丁基醚)、水(娃哈哈纯净水)、叶黄素和玉米黄质标准品(均购自Sigma 公司)。
1.2 仪器
砻谷机;电子天平;HY-4 型调速多用振荡器(苏州培英实验设备有限公司);离心机(赛默飞世尔科技(中国)有限公司);紫外可见光分光光度计(上海美谱达仪器有限公司);超声波清洗器(昆山市超声仪器有限公司);高效液相色谱仪。
1.3 高效液相色谱法一[33-34]
本试验对文献[33-34]的方法进行了适当调整,如样品处理方法其采用的是先烹饪,而本试验采取的是直接研磨取样,操作简单;类胡萝卜素提取方法不同,其采用甲醇提取该物质,本试验则用水饱和正丁醇参照AACC 法提取;色谱柱不同等。
1.3.1 总类胡萝卜素的提取 提取液制备:将纯净水和正丁醇按体积比1∶1 均匀混合,然后静置分层,上层即为水饱和正丁醇。
各称取2.0 g 研磨好的样品,分别加入10 mL水饱和正丁醇,振荡30 s,使其充分混匀,避光保存。在室温下摇3 h,4 000×g 离心10 min 后取上清,即为类胡萝卜素提取液。通过分光光度计分别测3 个品种在450 nm 处的吸光值,从而得到总类胡萝卜素含量。
1.3.2 样品上机前处理 取适量类胡萝卜素提取液,过0.22 μm 滤膜。前2 滴弃去,剩下的用于样品高效液相色谱分析。
1.3.3 测定玉米黄质和叶黄素含量的高效液相色谱(HPLC)分析
1.3.3.1 色谱条件 色谱仪:ACQUITY UPLC 超高效液相色谱系统;色谱柱:Thermo Scientific Syncronis C18 超高效液相色谱柱(100 mm×2.1 mm,1.7 μm);流动相:流动相A 为MTBE∶甲醇∶水=15∶81∶4(V/V/V),流动相 B 为 MTBE∶甲醇=90∶10(V/V);流速:0.4 mL/min,柱温:35 ℃,检测波长:448 nm。
1.3.3.2 洗脱条件 梯度洗脱:在0~3 min,流动相B 的体积百分比为0;在3~4 min,流动相B 的体积百分比由0 变到100%;在4~5 min,流动相B 的体积百分比为100%;在5~5.3 min,流动相B 的体积百分比由100%变到0。
1.4 高效液相色谱法二[35]
根据文献[35]的方法进行,但略有改进,例如,样品处理方法不同,其先清洗,然后冷冻干燥,并去壳3 次,研磨,而本试验直接去壳1 次,研磨,相对节约时间;其研磨完毕要筛细粉,本试验不需要。
1.4.1 总类胡萝卜素的提取 各取适量谷子用砻谷机脱壳,把没脱壳的、碎的小米和其他杂质挑掉,将小米在咖啡机中研磨。分别称取研磨充分的小米粉0.6 g 于10 mL 洁净离心管中(外壁用锡箔纸包裹以避光),加入6 mL 水饱和正丁醇,快速振荡使其充分混匀,用封口膜封住,放置在HY-4 型调速多用振荡器上室温振荡3 h,后于4 ℃8 000 r/min条件下离心15 min,将其轻轻取出,收集上清,注意不要吸到沉淀。其中一部分用于高效液相色谱分析,另一部分用来测定总类胡萝卜素含量。以水饱和正丁醇为参比,使用紫外可见分光光度计测定样品在450 nm 波长下的吸光值,每个样品做2 次重复,整个过程在避光条件下进行。

其中,A 为波长 450 nm 处吸光值;V 为提取液体积(mL);m 为样品质量(g)。
1.4.2 样品上机前处理 从备好的类胡萝卜素提取液中用新的注射器吸取0.5~1 mL 溶液,经过滤器进行过滤后,放到液相色谱专用瓶子中备用。
1.4.3 测定玉米黄质和叶黄素含量的高效液相色谱(HPLC)分析
1.4.3.1 色谱条件 色谱仪:高效液相色谱仪(Thermo Fisher Scientific,Ultimate 3000);色谱柱:C30 柱(250 mm×4.6 mm,5 μm;YMC 公司,Japan);流动相:流动相 A 为MTBE∶甲醇∶水=15∶81∶4(V/V/V),流动相B 为MTBE∶甲醇= 90∶10(V/V);流速:1 mL/min;柱温:35 ℃;检测波长:450 nm;进样量:20 μL。
1.4.3.2 标准工作曲线绘制 母液制备:用水饱和正丁醇将1 mg 玉米黄质和叶黄素标准品溶解(玉米黄质 250 μL,叶黄素 200 μL),然后混匀,用锡箔纸包裹配置好的标准品母液,使其避光,并置于-80 ℃冰箱保存备用。
标准工作液制备:用水饱和正丁醇将玉米黄质和叶黄素标准品按一定浓度梯度稀释,玉米黄质分别为 32,16,8,1.6,0.32,0.16,0.08 μg/mL;叶黄素分别为 44,22,11,2.2,0.44,0.22,0.11 μg/mL。
标准曲线绘制:将水饱和正丁醇稀释好的标准品溶液按浓度从小到大依次上机,从而获取各样品浓度对应的色谱图。根据峰面积定量,保留时间定性,以进样浓度(μg/mL)为横坐标、峰面积(mAU/min)为纵坐标,进行线性回归,从而得到对应的回归方程。
1.4.3.3 洗脱条件 梯度洗脱:在0~20 min,流动相B 的体积百分比由0 变到22.2%;在20~25 min,流动相B 的体积百分比由22.2%变到0;在25~30 min,流动相B 的体积百分比为0。
2 结果与分析
2.1 2种高效液相色谱方法比较
从表1可以看出,方法2 的样品用量和提取液用量均少于方法1 所用的量,从而节约了试验材料和试验试剂,也相对节约了操作时间。

表1 谷子叶黄素和玉米黄质含量测定方法的比较
2.2 叶黄素和玉米黄质的回归方程、线性范围与检测限
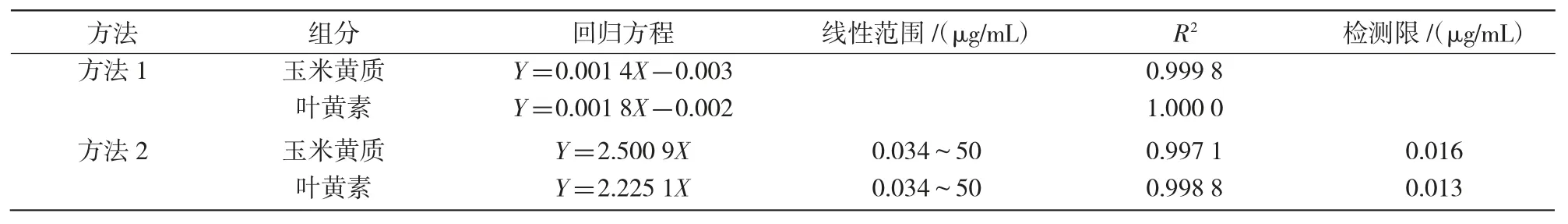
表2 叶黄素和玉米黄质线性回归方程
对玉米黄质和叶黄素进行了线性范围考察,根据峰面积(Y)分别对其浓度(X)(μg/mL)进行线性回归分析,进而说明试验结果的可靠性。由表2可知,不同方法的2 种物质具有显著的线性相关性,相关系数均大于0.997。方法2 的检测限与贾鹏宇等[10]的研究结果(0.3~0.4 μg/mL)相比较低,说明方法2 对叶黄素和玉米黄质检测的灵敏度更高。
2.3 样品测试结果比较
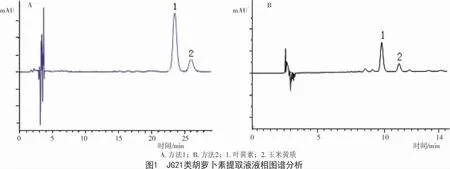
2.3.1 2 种方法样品分离情况 以晋谷21 号、支生谷、大青谷3 个品种作为试验材料,分别运用方法1 和方法2 测定3 个品种的黄色素含量,进一步比较验证了2 种高效液相色谱方法。
以JG21 为例,叶黄素和玉米黄质的分离情况根据标品保留时间定性。从图1可以看出,2 种方法均可将这2 种物质分离开。但是方法2 中叶黄素和玉米黄质保留时间分别约在10,11 min,方法1的保留时间则约为23,25 min,可见方法二的灵敏度更高。另外,方法2 的定性结果与王海棠等[13]的定性研究结果较为一致,可见方法2 比较可靠。在2 号峰后面还有一些小峰,但由于条件有限,无法对其定性,需要采用核磁共振或液相色谱与串联质谱联用技术进一步研究。
2.3.2 叶黄素和玉米黄质含量比较 本试验测定了3 个小米品种中黄色素的主要组分含量,并对2 种测定方法的检测结果进行了比较。由表3可知,2 种方法均能满足叶黄素和玉米黄质的检测,但检测结果存在差异。方法2 检测叶黄素和玉米黄质的含量均高于方法1,说明方法2 较方法1 效果更好。
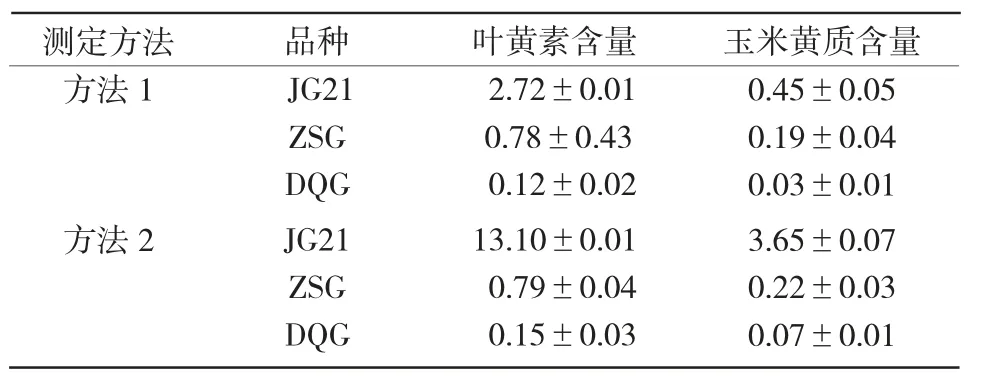
表3 2种方法测定不同谷子品种中叶黄素和玉米黄素的含量 mg/kg
从表3可以看出,各品种叶黄素含量均高于玉米黄质含量。此外,2 种方法测出的JG21 的叶黄素和玉米黄质含量均高于ZSG 的,而ZSG 的叶黄素和玉米黄质含量又均高于DQG,该结果均与贾鹏禹等[10,14,35]的研究结果一致,说明方法 2 检测结果的准确性更可靠。因此,可以推测,小米中叶黄素、玉米黄质含量均与黄色素含量呈正相关,即小米中叶黄素或玉米黄质含量越多,黄色素含量越多,小米越黄,品质越好。
3 结论与讨论
本研究经过2 种高效液相色谱法对3 个米色的小米品种中黄色素含量分析发现,2 种方法均能在30 min 内完成叶黄素和玉米黄质良好分离,C30柱可对2 个成分进行更好的分离,这与EMENHISER 等[36]研究结果一致,证实了C30 柱具有分辨异构体构型的优点。且方法2 的定性结果与王海棠等[13]的研究结果较为一致,可见方法2 比较可靠。此外,对于3 种小米中黄色素含量的高低,本研究与贾鹏禹等[10,14,35]的研究结果一致,再次证实黄色素确实对米色有影响,而且黄色素含量越多,小米越黄,小米品质越好;但杨延兵等[4]对黄米和绿米的黄色素含量测定结果表明,绿米中的黄色素含量相对较多,这与本试验所得结果不一致,可能是由于试验材料的时期不同或试验方法不同导致,具体原因有待进一步研究。
本研究中,叶黄素和玉米黄质含量均与米色呈正相关。通过比较2 个方法发现,方法2 具有省材、省时,操作简单,且重复性好,灵敏度高,结果相对稳定的优点。因此,可进一步探究黄色素其他成分与米色的关系,并将其应用在小米品质改良中。

