补肾益元方对运动性低血睾酮大鼠HPG 轴的影响及有效成分测定
王一蓉, 周志宏, 汤长发
(1. 湖南师范大学体育学院, 湖南 长沙 410081; 2. 湖南体育职业学院, 湖南 长沙 410019)
竞技体育的重要目的是要不断提高运动成绩, 如何使运动员在大负荷训练期间提高身体机能水平、 消除疲劳是竞技体育界最关心的问题, 大量研究表明, 长时间高负荷运动训练能引起血睾酮水平下降, 进而导致体能下降、 运动能力降低或产生疲劳, 故如何防治运动性低血睾酮的发生一直是运动医学界研究的重点领域[1-2]。 中医理论认为,肾藏精, 主骨生髓, 为先天之本, 是体力产生的原动力和源泉, 若肾精不足, 则雄性激素分泌减少, 故补肾能促进体内雄性激素的分泌(睾酮是体内主要的雄性激素), 从而提高机体的运动能力[3]。
补肾益元方由十余种中药提取物组成, 具有补肝肾、强筋骨、 补气活血、 祛风通络功效, 方中人参大补元气,为君药; 淫羊藿、 女贞子、 枸杞补肝肾, 壮筋骨, 强腰膝,使“阴助阳则生化无穷”, 为臣药; 杜仲、 黄芪补肾健脾,大伸筋草、 仙鹤草舒筋活血, 共为佐助药, 含有人参皂苷,淫羊藿苷, 枸杞多糖等成分。 前期课题组采用该方颗粒、超微化物分别对小鼠、 大鼠、 运动员抗疲劳指标和免疫相关指标进行检测, 取得了一定成果[4-5]; 本实验拟创新该方剂型, 选择11 味中药提取物复方, 通过大鼠递增负荷跑台训练方案建立运动性低血睾酮模型, 并以淫羊藿提取物为阳性对照, 观察补肾益元中药提取物复方对HPG 轴的影响, 研究其防治大鼠运动性低血睾酮作用的有效性和分子机制, 并比较中药提取物复方和单味中药提取物的干预效果, 测定方中有效成分, 为临床开发新型运动营养补剂提供理论依据。
1 材料
1.1 动物 SPF 级雄性SD 大鼠40 只, 2 月龄, 体质量(300±10) g, 由湖南斯莱克景达实验动物有限公司提供,湖南省动检二站进行质量检测, 动物生产许可证号SCXK(湘) 2013-0004, 国家标准啮齿类B 级动物饲料饲养, 许可证号SCXK (湘) 2014-0002, 清洁级, 在干净、 通风的环境下饲养, 自由进食饮水。
1.2 仪器 Agilent 1260 高效液相色谱仪(美国Agilent 公司); 汇松PW-812 全自动酶标洗板机、 汇松MB-530 多功能酶标分析仪(山东博科科学仪器有限公司); 164-5050电泳仪(美国Bio-Rad 公司); DYCZ-40A 转膜仪(北京六一生物科技有限公司), T-Gradient PCR 仪(德国Biometra公司); PikoReal 96 荧光定量RCP 仪(美国Thermo 公司)。试剂盒均购自北京康为世纪生物科技有限公司。
1.3 药物 将补肾益元方中11 味中药提取物(褐色粉末)混匀, 装入胶囊, 平均粒重0.543 1 g, 由西安天一生物技术股份有限公司制作并提供。
2 方法
2.1 分组及给药 40 只大鼠随机分为空白组、 模型组、淫羊藿提取物组(阳性对照) 及补肾益元方低、 高剂量组, 每组8 只, 分笼饲养。 空白组大鼠常规喂养, 自由饮食, 每天灌胃4 mL 生理盐水, 不运动; 模型组大鼠每天运动, 并于运动前1 h 灌胃4 mL 生理盐水; 淫羊藿提取物组、 补肾益元方组每天运动, 并于运动前1 h 灌胃给药,连续6 周。 淫羊藿提取物组给药剂量为0.70 g/kg, 补肾益元方低、 高剂量组给药剂量分别为0.35、 0.70 g/kg, 生理盐水溶解药物后配成4 mL 溶液, 其中低剂量组用量与成人持平[6]。
2.2 有效成分测定
2.2.1 色谱条件 Agilent TC-C18色谱柱(4.6 mm ×250 mm, 5 μm); 流动相水(A) -乙腈(B), 梯度洗脱,程序见表1; 检测波长203、 270 nm; 柱温30 ℃; 体积流量1 mL /min; 进样量10 μL。
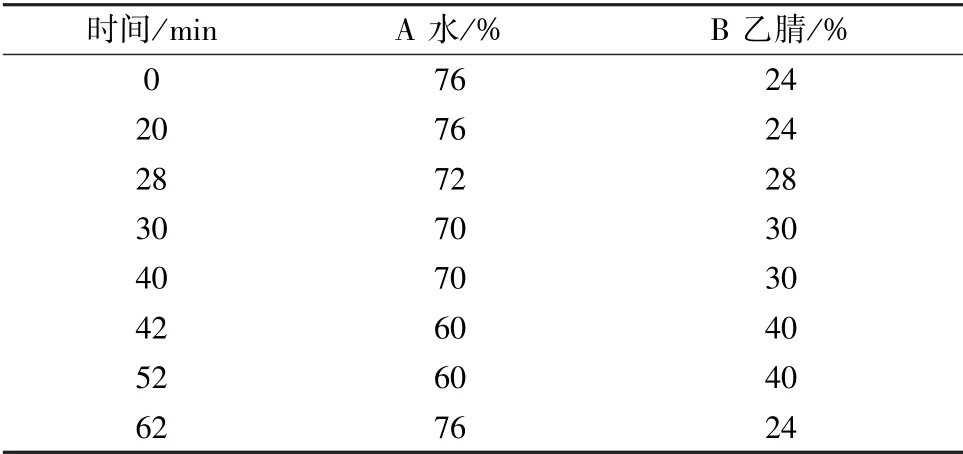
表1 梯度洗脱程序
2.2.2 对照品溶液制备 精密称取人参皂苷Rg1、 Re、Rb1、 Rc、 Rb2、 Rd 及淫羊藿苷对照品适量, 加甲醇制成每l mL 分别含0.3、 0.3、 0.3、 0.3、 0.3、 0.3、 0.4 mg 上述成分的溶液, 摇匀, 即得。
2.2.3 供试品溶液制备 精密称取补肾益元方、 淫羊藿提取物各约0.25 g, 置于锥形瓶中, 精密加入10 mL 甲醇,称定质量, 超声1 h, 取出, 放冷, 甲醇补足减失的质量,摇匀, 滤过, 取续滤液, 即得。
2.3 运动性低血睾酮大鼠模型建立 采用逐级递增负荷跑台方案, 以血睾酮较训练前下降15%为判断依据[7]。 运动方案参照Bedford 在1979 年根据大鼠体质量/摄氧量回归方程所建立的逐渐递增速度和时间的训练方式, 周期6 周,每周训练6 d, 坡度保持在0°, 见表2。
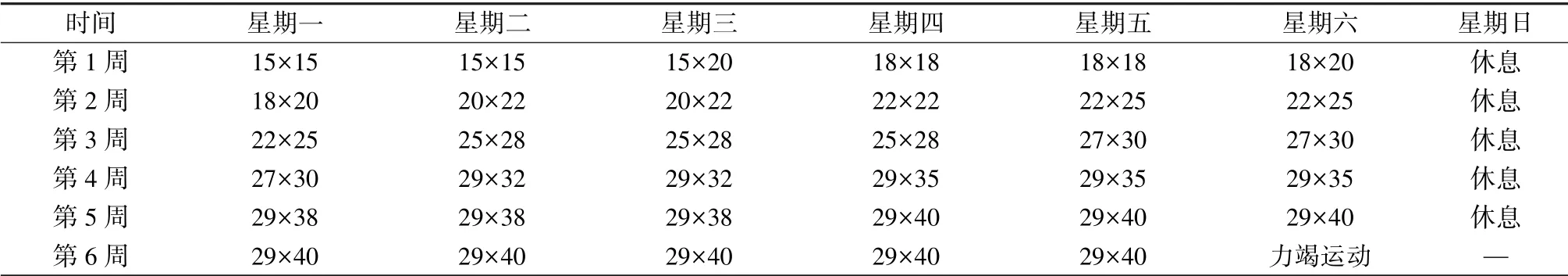
表2 大鼠递增负荷跑台训练方案[(m/min) ×min]
2.4 取材及指标检测 运动组大鼠在第6 周最后1 d 进行力竭实验, 力竭运动后不再给药, 24 h 后腹腔注射2%戊巴比妥钠麻醉, 打开腹腔, 取大动脉血管血液6 mL, 其中3 mL在37 ℃下凝固后, 4 ℃、 3 000 r/min 离心10 min, 取血清, -20 ℃冰箱中保存, 用于检测血清皮质醇、 睾酮水平。 然后, 大鼠断头处死, 迅速开颅取脑组织, 称定质量后立即于1 mL 煮沸的生理盐水中煮3 min, 再加入0.5 mL 1 mol/L冰醋酸, 置于匀浆器中匀浆, 0.5 mL 1 mol/L 氢氧化钠中和, 4 ℃、 3 000 r/min 离心30 min, 取上清液, -20 ℃冰箱中保存, 用于检测卵泡刺激素(FSH)、 黄体生成素(LH)、 促性腺激素释放激素(GnRH) mRNA、 蛋白表达。
2.5 统计学分析 通过SPSS 18.0 软件进行处理, 数据以) 表示, 组间比较采用单因素方差分析。 P<0.05 表示差异有统计学意义。
3 结果
3.1 皮质醇、 睾酮水平 表3 显示, 各组皮质醇水平无明显变化(P>0.05)。 与空白组比较, 模型组睾酮水平及睾酮/皮质醇显著降低(P<0.01), 而补肾益元方高剂量组两者显著升高(P<0.05); 与模型组比较, 淫羊藿提取物组、补肾益元方组睾酮水平显著升高(P<0.01)。
3.2 FSH、 LH、 GnRH mRNA 表达 表4 显示, 与模型组比较, 淫羊藿提取物组、 补肾益元方组FSH、 LH、 GnRH mRNA 表达显著升高(P<0.05, P<0.01); 与补肾益元方高剂量组比较, 淫羊藿提取物组、 补肾益元方低剂量组LH mRNA 表达显著降低(P<0.05), 并且后一组GnRH mRNA表达也显著降低(P<0.05)。&
表3 各组皮质醇、 睾酮水平比较±s, n=8)

表3 各组皮质醇、 睾酮水平比较±s, n=8)
注:与空白组比较,#P<0.05,##P<0.01;与模型组比较,∗∗P<0.01
空白组 187.050±48.310 1.758±0.343 108.929±36.000模型组 115.518±13.053## 1.745±0.284 67.830±14.288##淫羊藿提取物组 206.833±5.537∗∗ 1.787±0.328 119.532±25.037∗∗补肾益元方低剂量组 210.600±5.084∗∗ 1.782±0.211 119.380±13.019∗∗补肾益元方高剂量组 220.567±14.714#∗∗ 1.786±0.167 124.257±14.789#∗∗
表4 各组FSH、 LH、 GnRH mRNA 表达比较 s,n=8)
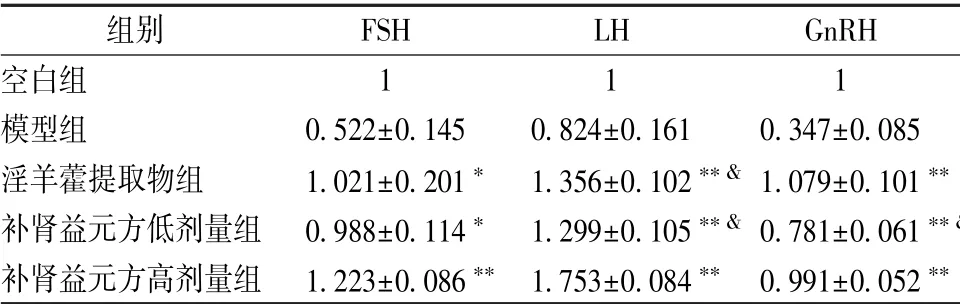
表4 各组FSH、 LH、 GnRH mRNA 表达比较 s,n=8)
注:与模型组比较,∗P <0.05,∗∗P <0.01;与补肾益元方高剂量组比较,&P<0.05
空白组 1 1 1模型组 0.522±0.145 0.824±0.161 0.347±0.085淫羊藿提取物组 1.021±0.201∗ 1.356±0.102∗∗& 1.079±0.101∗∗补肾益元方低剂量组 0.988±0.114∗ 1.299±0.105∗∗& 0.781±0.061∗∗补肾益元方高剂量组 1.223±0.086∗∗ 1.753±0.084∗∗ 0.991±0.052∗∗
3.3 FSH、 LH、 GnRH 蛋白表达 表5、 图1 显示, 与空白组比较, 模型组FSH、 GnRH 蛋白表达显著降低(P <0.01), 淫羊藿提取物组、 补肾益元方高剂量组LH、 GnRH蛋白表达显著升高(P<0.01); 与模型组比较, 淫羊藿提取物组、 补肾益元方组三者表达显著升高(P<0.01); 与补肾益元方高剂量组比较, 补肾益元方低剂量组GnRH 蛋白表达显著降低(P<0.05)。
表5 各组FSH、 LH、 GnRH 蛋白表达比较s, n=8)

表5 各组FSH、 LH、 GnRH 蛋白表达比较s, n=8)
注:与空白组比较,##P<0.01;与模型组比较,∗∗P<0.01;与补肾益元方高剂量组比较,&P<0.05
?

图1 各组FSH、 LH、 GnRH 蛋白表达
3.4 有效成分测定 图2 显示, 色谱峰1 ~2、 8 ~11 为人参皂苷特征峰, 外标法测得每粒复方中药中含人参总皂苷43.57 mg; 色谱峰3~7 为淫羊藿提取物特征峰, 其中7 号峰为淫羊藿苷, 峰面积也最大, 外标法测得每粒复方中药中含淫羊藿苷5.03 mg。
4 讨论

图2 各成分HPLC 色谱图
研究表明, 睾酮能促进纤维和骨骼生长, 从而保持肌肉质量、 强度及骨骼密度, 并在一定条件下增强运动员运动能力和竞技能力[8-9], 但长期高负荷强度训练使机体受到的刺激增加, 导致下丘脑-垂体-肾上腺轴(HPA 轴) 过度应激, 以致多个环节的功能被抑制, 从而引起运动性血睾酮降低[10-11], 造成运动员身体机能水平下降, 运动后恢复能力下降, 甚至产生伤病。 HPG 轴调节是通过在下丘脑合成促性腺激素释放激素(GnRH), 经过毛细血管进入门脉血管中与受体结合, 加速卵泡刺激素(FSH)、 黄体生成素(LH) 激素释放, 最终促进睾酮合成和分泌, 由此可知,HPG 轴活跃程度是决定睾酮分泌的最重要部分。
疲劳训练后, 运动员出现的症状大多类似中医的肾阳、肾气虚弱, 故补肾气、 温肾阳中药在抗运动性疲劳致血睾酮降低的治疗中占据主导地位[12], 其中淫羊藿能增加性腺或附属性腺器官的脏器系数, 提高血睾酮水平, 对HPG 轴具有促进作用[13], 其主要有效成分为淫羊藿苷。 因此, 本实验选择补肾益元方, 以方中臣药淫羊藿提取物为阳性对照, 经过6 周递增负荷跑台大强度运动训练后发现, 与空白组比较, 模型组大鼠HPG 轴FSH、 LH、 GnRH 激素mRNA、 蛋白表达较低, 血清T 水平也明显下降(P<0.01),并且LH mRNA、 蛋白表达略微下降, 但不明显, 这与黄文聪[14]提到的长期训练运动量变化对LH 水平并无大影响,但长期耐力训练会引起其生物活性下降的观点基本一致;给予中药提取物复方后, 大鼠HPG 轴中FSH 激素mRNA、蛋白表达较模型组升高, 但淫羊藿提取物及补肾益元低、高剂量组之间无明显变化; 给药组LH mRNA、 蛋白表达也有所升高, 补肾益元方高剂量组更明显; 补肾益元高剂量组、 淫羊藿提取物组GnRH mRNA 表达与空白组基本相当,均明显高于补肾益元方低剂量组, 而在蛋白表达方面补肾益元低剂量组与空白组比较接近, 而补肾益元高剂量、 淫羊藿提取物组显著升高, 但2 组之间无明显差异; 但淫羊藿提取物组血清睾酮水平低于补肾益元低、 高剂量组, 可能与激素的脉冲式释放有关。 张福生等[15]报道, 中药可通过提高GnRH 基因转录与表达水平来提高GnRH 单位水平,也能通过调节FSH 来刺激睾酮分泌, 并且有些中药本身具有性激素作用, 也可直接作用于性腺, 从而促进睾酮分泌;本实验发现, 给药组均能通过调控HPG 轴来显著提高运动低血睾酮大鼠睾酮水平, 其中补肾益元方高剂量组更明显。蔡德培等[16]指出, 补肾中药可通过提高机体下丘脑-垂体促性腺功能, 从而提高机体机能状态; 本实验发现, 补肾益元方对HPG 轴具有多环节、 多靶点促进作用, 对长期大负荷强度运动训练引起的运动性低血睾酮具有良好的调节作用, 有利于提高机体适应能力。
综上所述, 补肾益元方能明显改善运动性低血睾酮大鼠FSH、 LH、 GnRH mRNA、 蛋白表达, 从而调控HPG 轴,可为中药抗运动性低血睾酮提供理论依据。 由于补肾益元方高剂量组疗效优于淫羊藿提取物组、 补肾益元方低剂量组, 故建议在长期高强度运动训练前, 运动员可使用与补肾益元方高剂量组(0.70 g/kg) 等效的成人剂量, 即1 次4 粒, 每天3 次, 以提高机体运动能力。

