七十味珍珠丸对脑缺血再灌注损伤大鼠血脑屏障的保护作用
梁 源, 孙位军, 王 张, 贾晓静, 胥培艳, 付 珂, 徐文龙
(1. 成都中医药大学药学院, 四川 成都 611137; 2. 成都中医药大学民族医药学院, 四川 成都 611137)
脑缺血属于中枢神经系统急症之一, 近年来发病率有明显升高的趋势, 具有恢复慢、 致残率和致死率高的特点[1-3], 发生缺血性中风的主要原因是血栓形成后堵塞血管, 引起脑血流量降低, 进而使脑组织发生缺血缺氧、 软化甚至坏死[4], 而缺血再灌注是导致病情加重的主要原因[3]。 脑缺血再灌注损伤后, 血脑屏障出现结构及功能改变[5],前者主要表现在对微血管内皮细胞、 星形胶质细胞足突、 基底膜的影响, 对缺血更敏感的胶质细胞足突较微血管率先发生肿胀和退行性变, 胶质细胞皱缩, 毛细血管内可见出多个向管腔内伸入的呈伪足样突起; 后者主要表现在通透性变化, 毛细血管内皮细胞间隙增大导致通透性增加。 在动物实验中,可用伊文思蓝来反映血脑屏障功能改变, 其损伤机制涉及ROS/RNS 损伤[6]、 MMPs 激活[7]、 炎细胞浸润[8]、 水通道开放[9]、 钙超载[10]等。
七十味珍珠丸(藏文译音然纳桑培) 始载于藏医经典著作《四部医典》 中, 由珍珠、 檀香、降香、 九眼石、 西红花、 牛黄、 麝香等药材组成,具有安神镇静、 通经活络、 调和气血、 醒脑开窍的作用[11], 主要用于治疗“黑白脉病” “龙血不调”, 以及中风、 瘫痪、 半身不遂等疾病[12], 其中白脉病相当于现代医学的神经系统疾病。 经查阅文献发现, 尚无七十味珍珠丸对脑缺血再灌注损伤动物模型血脑屏障保护作用的报道, 故本实验将对此进行考察, 并初步探讨其作用机制。
1 材料
1.1 试药 七十味珍珠丸(西藏甘露藏药股份有限公司, 批号16044A); 尼莫地平片(拜耳医药保健有限公司, 批号BJ30601)。 SOD 试剂盒(货号A001-1)、 MDA 试剂盒(货号A003-1) (南京建成生物工程研究所); 红四氮唑(上海灵锦精细化工有限公司, 批号20160500); 甲酰胺(成都市科隆化工试剂厂, 批号2017092901); 多聚甲醛(国药集团化学试剂有限公司, 批号20160512);甲苯胺蓝(上海如吉生物科技发展有限公司, 批号120418); PBS 缓冲液(北京中杉金桥生物技术有限公司, 批号ZLI-9062); 苏木素(北京百灵威科技有限公司, 批号LM10N13); 伊红(东京化成工业株式会社, 批号GL01-GMPC); 依文思蓝(上海如吉生物科技发展有限公司)。 没食子酸(批号PS000688)、 柯里拉京(批号PS000532)、鞣花酸(批号PS14102401) 对照品(成都普思生物科技股份有限公司, 含有量大于98%)。 乙腈为色谱纯(安徽天地高纯溶剂有限公司); 甲醇为分析纯(西格玛奥德里奇贸易有限公司)。
1.2 仪器 电子天平[赛多利斯科学仪器(北京) 有限公司]; 紫外可见分光光度计(上海美谱达仪器有限公司); 台式高速冷冻离心机(上海天美生化仪器设备工程有限公司); 全自动生化分析仪(上海特康科技有限公司); TSJ-Ⅱ型全自动封闭式组织脱水机、 BMJ-Ⅲ型包埋机、 PHY-Ⅲ型病理组织漂烘仪(常州市中威电子仪器有限公司);数码三目摄像显微镜(麦克奥迪实业集团有限公司); LC-2010A HT 型高效液相色谱仪(日本岛津公司)。
1.3 动物 SPF 级SD 雄性大鼠72 只, 体质量(260±10) g, 购自成都达硕实验动物有限公司,动物生产许可证号SCXK (川) 2015-030, 四川省实验动物质量合格证号 51203500003428、51203500003567 等。
2 方法
2.1 分组与剂量 大鼠随机分为假手术组、 模型对照组、 尼莫地平片组(30.00 mg/kg)、 七十味珍珠丸组(66.68 mg/kg), 每组再分为3 个亚组(脑梗死率、 血脑屏障通透性、 脑组织形态学),其中七十味珍珠丸临床用药剂量为重病患者每天1 g (1 丸), 一般患者每隔3 ~7 d 1 g (1 丸)。 前期课题组[12-13]开展七十味珍珠丸抗大鼠脑缺血再灌注损伤的量效关系(0.52、 1.04、 2.08、 4.17、8.33、 16.67、 33.34、 66.68、 133.36 mg/kg, 分别 为 成 人 用 量 的0.031 25、 0.062 5、 0.125、0.25、 0.5、 1、 2、 4、 8 倍) 及其对线栓致大鼠局灶性脑缺血再灌注损伤的时效关系(2、 6、 12、24、 48、 72 h, 剂量为33.50 g/kg, 即临床成人用量的2 倍) 研究, 发现66.68 g/kg (临床成人用量的4 倍) 为最佳剂量, 故本实验设置该剂量进行研究。
2.2 造模与给药 参考文献[14], 沿大鼠颈部正中线偏右作一切口, 止血钳钝性分离淋巴组织及腺体, 在胸骨舌骨肌、 胸锁乳突肌、 二腹肌后腹交界空隙处分离右侧颈总动脉, 在近心端处系1 根缝合线, 止血钳夹住线头以起到牵拉作用; 沿颈总动脉向大脑方向继续分离颈外动脉和颈内动脉, 在两者分叉处结扎颈外动脉, 止血钳夹住颈外动脉的结扎线以起到牵拉作用, 再沿颈内动脉往内分离翼腭动脉, 在分叉处结扎。 然后, 在颈外动脉远心端的结扎线和近心端的松结之间剪一小口, 在自制挑针辅助下将栓线插入到颈内动脉, 长度约20 mm (从颈总动脉分叉处算起), 缝合手术创口并消毒, 术中保温至大鼠清醒, 大脑中动脉阻断2 h 后进行再灌注, 而假手术组仅在动脉处备线处理, 不造模。考虑到七十味珍珠丸在临床上每隔3 ~7 d 给药1次, 具有“缓释样效应”, 并结合课题组前期研究结果[12-13], 本实验也仅给药1 次, 手术前灌胃给予七十味珍珠丸混悬液、 尼莫地平混悬液或生理盐水, 给药体积均为10 mL/kg。
2.3 脑梗死率检测 大鼠脑缺血24 h 时麻醉取血后, 立即取出全脑, 滤纸吸干脑组织表面水分称定质量后, 将其置于-20 ℃冰箱中速冻20 ~30 min,用配好的1% TTC 缓冲液染色30 min, 分离梗死组织呈苍白色部分, 滤纸吸干脑组织表面水分称定质量, 计算脑梗死率(脑梗死部分质量/脑组织质量×100%)。
2.4 神经行为学评分 参考Longa[15]、 Bederson[16]的5 分制法, 在大鼠脑缺血后2、 24 h 时应用表1进行评分, 分值越高, 表明大鼠行为障碍越严重。

表1 神经行为学评分Tab.1 Neurobehavioral scores
2.5 脑组织病理学评价和尼氏小体计数 取各组大鼠的缺血侧脑组织, 4%多聚甲醛溶液固定、 脱水、 石蜡包埋, 部分进行苏木精-伊红(HE) 染色, 光镜下观察脑组织病变程度, 分为“-” (未见病变)、 “+” [小灶性灰、 白质水肿, 细胞溶解;小灶性灰、 白质细胞萎缩, 胞浆及核深染; 灶性少许细胞增生(主要为胶质细胞); 轻度血管周水肿; 轻度血管充血、 出血; 少许炎细胞浸润; 轻度灰质萎缩薄; 少许室管膜细胞增生]、 “++” [多灶性灰、 白质水肿, 细胞溶解; 灶性灰、 白质细胞胞萎缩, 胞浆及核深染; 灶性较多细胞增生(主要为胶质细胞); 中度血管充血、 出血; 较多炎细胞浸润。 中度血管周水肿]、 “+++” [弥漫性灰、白质水肿, 细胞溶解; 多灶性灰、 白质细胞萎缩,胞浆及核深染; 灶性大量细胞增生(主要为胶质细胞); 重度血管充血、 出血; 大量炎细胞浸润];部分脑组织用甲苯胺蓝水溶液染色, 光镜下观察尼氏小体数。
2.6 血清SOD、 MDA 水平检测 大鼠24 h 腹腔注射水合氯醛麻醉, 腹主动脉采血5 mL, 离心(3 500 r/min) 10 min 分离血清, 取上清液, 按试剂盒方法测定。
2.7 血脑屏障通透性评价 大鼠脑缺血24 h 时麻醉, 股静脉缓慢注射2% 伊文思蓝 (EB) 溶液(4 mL/kg), 2 h 后心脏灌注, 迅速断头取脑, 去除皮质表面蛛网膜、 脑室脉络丛, 取缺血侧大脑称定质量, 充分剪碎后置于5 mL 甲酰胺溶液中,60 ℃水浴下静置24 h, 离心(20 ℃、 12 000 r/min)15 min, 取上清液, 620 nm 波长处测定光密度; 甲酰胺溶液作为空白对照, 配制8、 4、 2、 1、 0.5、0.25、 0.125 μg/mL EB 溶液, 测定光密度, 绘制标准曲线(Y 为光密度, X 为溶液质量浓度) 为Y=17.436X+0.012 8 (R2=0.999 7), 计算脑组织EB 含有量(样品中EB 含有量×甲酰胺溶液体积/脑组织质量)[17-28]。
2.8 统计学分析 通过SPSS 21.0 软件进行处理,计量资料以() 表示, 组间比较采用方差分析; 等级资料组间比较采用非参数检验。 P<0.05表示差异有统计学意义。
3 结果
3.1 成分分析 采用课题组前期建立的方法[29],通过HPLC 法进行分析, 条件为柱温30 ℃; 体积流量0.8 mL/min; 检测波长254 nm; 流动相乙腈-0.2%磷酸, 梯度洗脱, 色谱图见图1。
3.2 脑梗死率 表2、 图2 显示, 与假手术组比较, 模型对照组脑梗死率显著增加(P<0.01); 与模型对照组比较, 七十味珍珠丸组其梗死率显著降低(P<0.01)。
3.3 神经行为学评分 表3 显示, 与假手术组比较, 模型对照组在2、 24 h 有显著的神经行为学异常(P<0.01), 表现为大鼠向左转圈、 向左侧倾倒、 左前脚不自然伸直等; 与模型对照组比较, 七十味珍珠丸组在24 h 其异常显著改善(P<0.01)。
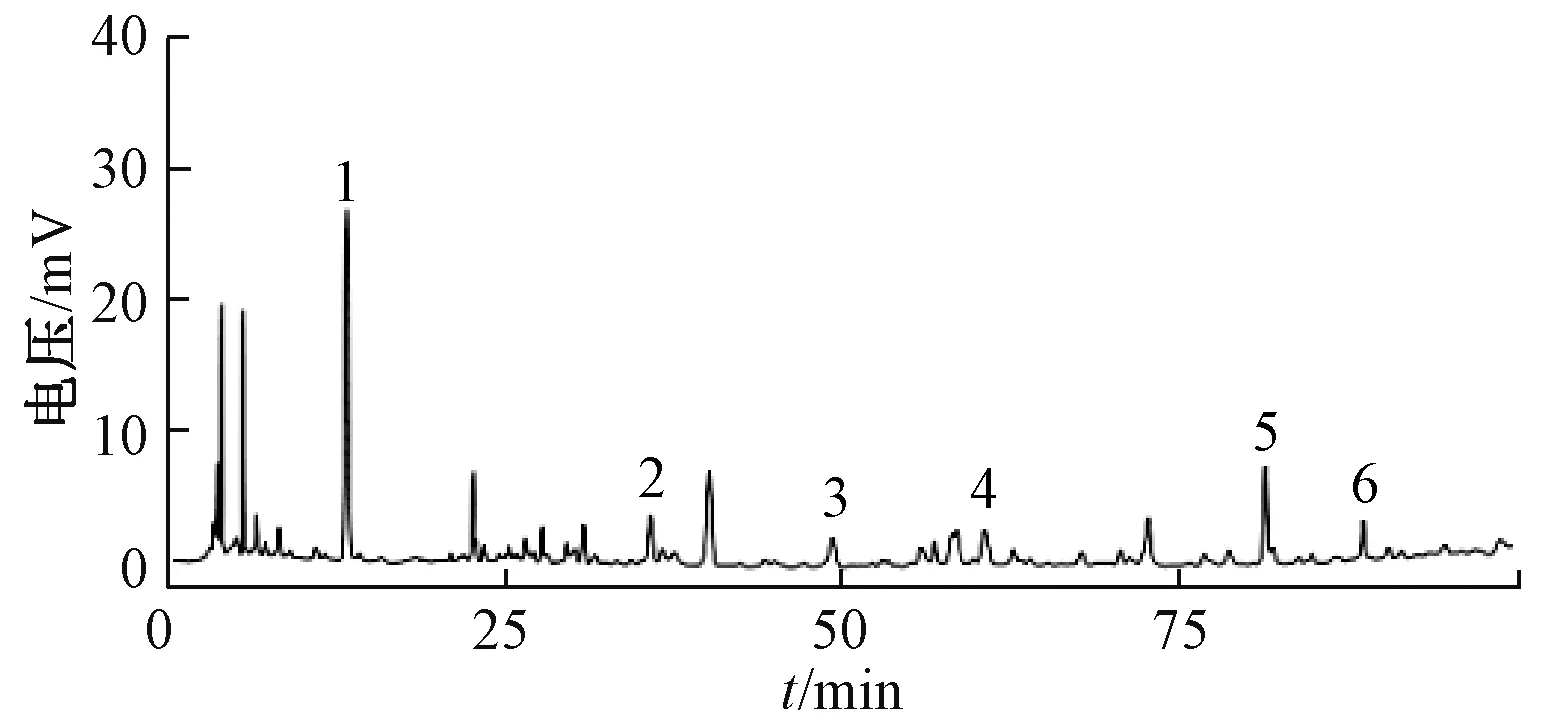
图1 七十味珍珠丸HPLC 色谱图Fig.1 HPLC chromatogram of Qishiwei Zhenzhu Pills
表2 七十味珍珠丸对脑梗死率的影响 n=6)Tab.2 Effect of Qishiwei Zhenzhu Pills on cerebral infarction rate n=6)

表2 七十味珍珠丸对脑梗死率的影响 n=6)Tab.2 Effect of Qishiwei Zhenzhu Pills on cerebral infarction rate n=6)
注:与假手术组比较,##P<0.01;与模型对照组比较,∗∗P<0.01
假手术组 — 0.00±0.00模型对照组 — 15.06±1.87##尼莫地平片组 30.00 6.65±3.15∗∗七十味珍珠丸组 66.68 2.77±2.45∗∗
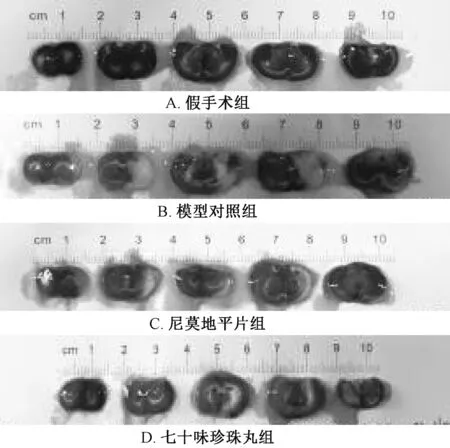
图2 各组大鼠脑组织Fig.2 Brain tissues of rats in various groups
3.4 尼氏小体数 表4、 图3 显示, 与假手术组比较, 模型对照组尼氏小体数显著减少 (P <0.01); 与模型对照组比较, 七十味珍珠丸组其数量显著增加(P<0.05)。
表3 七十味珍珠丸对神经行为学评分的影响s, n=6)Tab.3 Effect of Qishiwei Zhenzhu Pills on neurobehavioral scores , n=6)
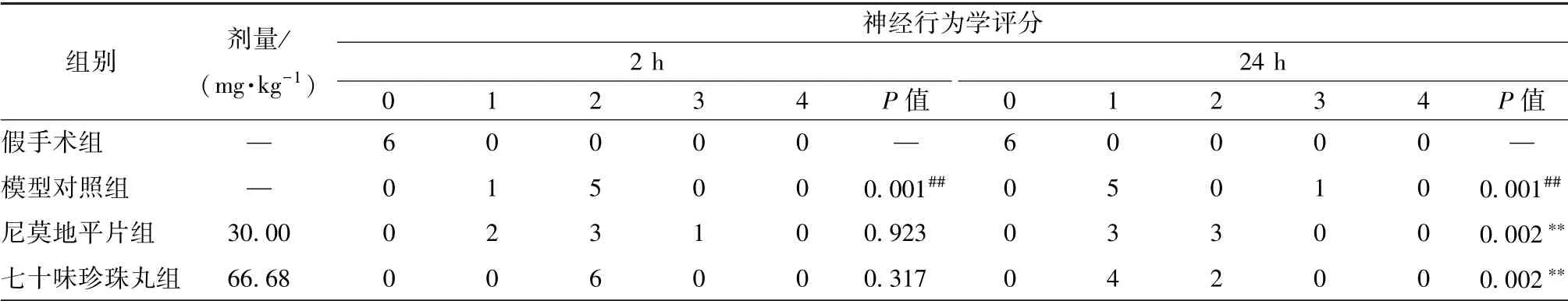
表3 七十味珍珠丸对神经行为学评分的影响s, n=6)Tab.3 Effect of Qishiwei Zhenzhu Pills on neurobehavioral scores , n=6)
注:与假手术组比较,##P<0.01;与模型对照组比较,∗∗P<0.01
假手术组 — 6 0 0 0 0 — 6 0 0 0 0 —模型对照组 — 0 1 5 0 0 0.001## 0 5 0 1 0 0.001##尼莫地平片组 30.00 0 2 3 1 0 0.923 0 3 3 0 0 0.002∗∗七十味珍珠丸组 66.68 0 0 6 0 0 0.317 0 4 2 0 0 0.002∗∗
表4 七十味珍珠丸对尼氏小体数的影响 n=6)Tab.4 Effect of Qishiwei Zhenzhu Pills on Nissl body count n=6)

表4 七十味珍珠丸对尼氏小体数的影响 n=6)Tab.4 Effect of Qishiwei Zhenzhu Pills on Nissl body count n=6)
注:与假手术组比较,##P<0.01;与模型对照组比较,∗P<0.05
假手术组 — 76.78±5.62模型对照组 — 60.39±5.07##尼莫地平片组 30.00 62.67±8.16七十味珍珠丸组 66.68 71.39±9.14∗
3.5 脑组织病理变化 表5、 图4 显示, 与假手术组比较, 模型对照组大鼠缺血侧脑组织灰质和海马神经细胞水肿、 空泡变性明显, 细胞结构模糊,呈脑缺血、 缺氧性改变(P<0.01); 与模型对照组比较, 七十味珍珠丸组细胞变性、 水肿程度均有一定程度减轻, 但无显著性差异(P>0.05)。
表5 七十味珍珠丸对病理切片等级的影响(x ±s, n=6)Tab.5 Effect of Qishiwei Zhenzhu Pills on pathological section grade ±s, n=6)
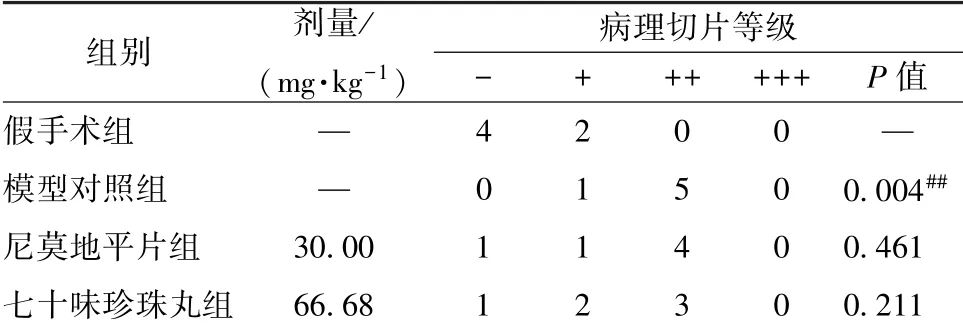
表5 七十味珍珠丸对病理切片等级的影响(x ±s, n=6)Tab.5 Effect of Qishiwei Zhenzhu Pills on pathological section grade ±s, n=6)
注:与假手术组比较,##P<0.01
假手术组 — 4 2 0 0 —模型对照组 — 0 1 5 0 0.004##尼莫地平片组 30.00 1 1 4 0 0.461七十味珍珠丸组 66.68 1 2 3 0 0.211
3.6 SOD 活性、 MDA 水平 表6 显示, 与假手术组比较, 模型对照组SOD 活性、 MDA 水平无明显变化(P>0.05); 与模型对照组比较, 七十味珍珠丸组两者有降低趋势, 但无显著差异(P>0.05)。
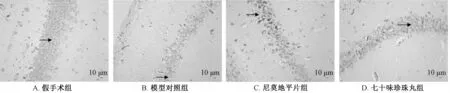
图3 各组大鼠脑组织显微图(尼氏染色, ×400)Fig.3 Micrographs for brain tissues of rats in various groups (Nissl staining, ×400)
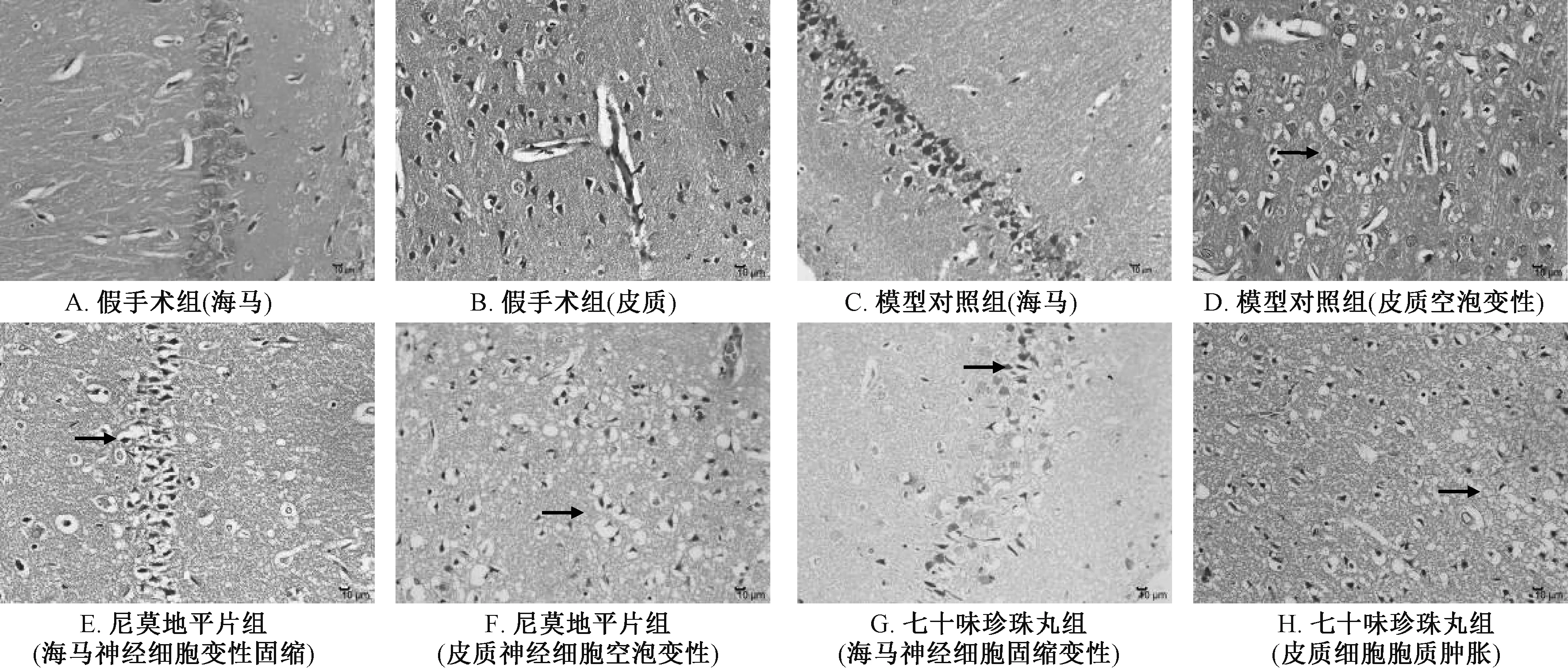
图4 各组大鼠组织病理形态(HE 染色, ×400)Fig.4 Histopathologic morphologies of rats in various groups (HE staining, ×400)
表6 七十味珍珠丸对SOD 活性、 MDA 水平的影响 n=6)Tab.6 Effects of Qishiwei Zhenzhu Pills on SOD activity and MDA level (s, n=6)
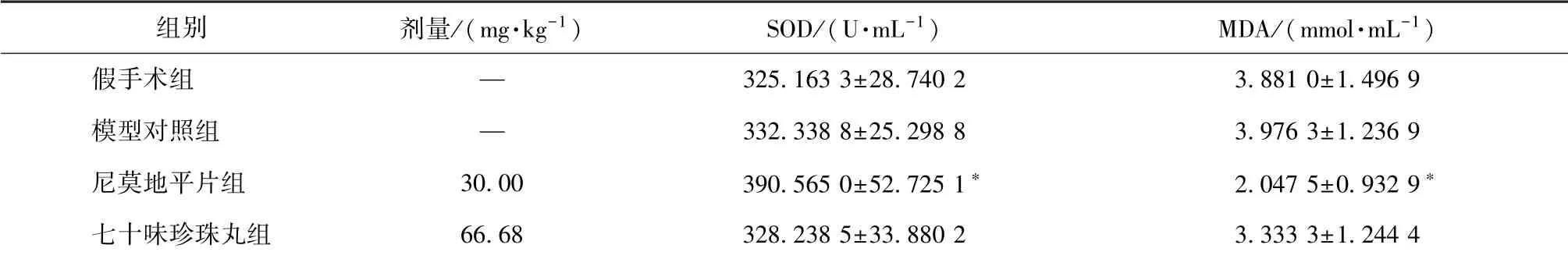
表6 七十味珍珠丸对SOD 活性、 MDA 水平的影响 n=6)Tab.6 Effects of Qishiwei Zhenzhu Pills on SOD activity and MDA level (s, n=6)
注:与模型对照组比较,∗P<0.05
组别 剂量/(mg·kg-1) SOD/(U·mL-1) MDA/(mmol·mL-1)假手术组 — 325.163 3±28.740 2 3.881 0±1.496 9模型对照组 — 332.338 8±25.298 8 3.976 3±1.236 9尼莫地平片组 30.00 390.565 0±52.725 1∗ 2.047 5±0.932 9∗七十味珍珠丸组 66.68 328.238 5±33.880 2 3.333 3±1.244 4
3.7 血脑屏障通透性 表7、 图5 显示, 与假手术组比较, 模型对照组EB 含有量显著升高(P<0.01); 与模型对照组比较, 七十味珍珠丸组其含有量显著降低(P<0.05)。
4 讨论
尼氏染色是观察缺血脑组织内神经元尼氏体的经典方法[30], 染色结果表明, 模型对照组大鼠缺血侧脑组织尼氏小体受损严重、 溶解或消失明显,而七十味珍珠丸组大鼠缺血侧脑组织尼氏小体数量增加。 HE 染色结果表明, 模型对照组大鼠缺血侧大脑灰质水肿, 染色较淡, 透光度增强, 各细胞层排列紊乱, 细胞空泡变性, 胞浆疏松、 肿胀, 细胞呈不规则形, 细胞核浓缩深染, 部分可见小胶质细胞增生, 其中2 例(2/6) 海马结构较完整, 海马椎体细胞固缩、 深染、 核仁模糊, 少量椎体细胞坏死; 七十味珍珠丸组大鼠缺血侧大脑灰质水肿或空泡变性, 染色透光度增强, 细胞胞浆疏松、 肿胀变性, 胞核浓缩深染, 偶见有小胶质细胞增生, 其中2 例(2/6) 海马组织水肿变性、 染色浅, 椎体细胞排列紊乱、 极向不清, 椎体细胞胞质肿胀、 疏松, 胞膜边界模糊不清, 有改善趋势。 TTC 染色结果表明, 模型对照组大鼠脑梗死率增加, 而七十味珍珠丸组其明显降低。 神经行为学结果表明, 模型对照组大鼠在2、 24 h 神经行为学明显异常, 而七十味珍珠丸大鼠上述异常明显改善。 综上所述, 七十味珍珠丸对脑缺血再灌注损伤大鼠脑组织有明显保护作用。
表7 七十味珍珠丸对EB 含有量的影响±s, n=6)Tab.7 Effect of Qishiwei Zhenzhu Pills on EB contents, n=6)

表7 七十味珍珠丸对EB 含有量的影响±s, n=6)Tab.7 Effect of Qishiwei Zhenzhu Pills on EB contents, n=6)
注:与假手术组比较,##P<0.01;与模型对照组比较,∗P<0.05,∗∗P<0.01
假手术组 — 3.867 8±2.734 0模型对照组 — 11.794 3±2.423 0##尼莫地平片组 30.00 7.622 6±1.883 5∗∗七十味珍珠丸组 66.68 7.953 8±1.911 0∗
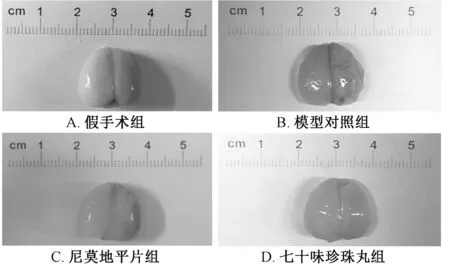
图5 各组大鼠血脑屏障通透性Fig.5 Blood-brain barrier permeabilities of rats in various groups
血脑屏障是维持脑内微环境的稳定、 保证大脑正常功能的特殊屏障, 在向脑内进行营养物质运输、 阻挡有害物质进入大脑中发挥着重要作用, 主要由血管内皮细胞、 星形胶质细胞、 细胞外基质共同组成1 个紧密结构[4,21-32], 其损伤将直接导致神经元所处生理环境改变, 并伴随神经炎症发生、 氧化应激、 脑水肿等现象[33-34], 最终会引起突触和神经元功能紊乱[35], 而且脑缺血再灌注损伤将导致其结构受损, 通透性增加[5]。 本实验采用伊文思蓝透过法检测血脑屏障通透性, 发现模型对照组大鼠脑组织EB 含有量明显升高, 表明可造成血脑屏障损伤, 通透性增加; 七十味珍珠丸组其含有量明显降低, 通透性减少, 表明它对血脑屏障有保护作用。
活性自由基能氧化细胞膜和基底膜上的不饱和脂肪酸, 引起血管内皮细胞和基底膜损伤, 从而破坏血脑屏障完整性[12], 而MDA 是主要脂质过氧化物, 能使细胞的结构和功能发生破坏[36]。 本实验发现与模型对照组比较, 七十味珍珠丸组大鼠血清SOD 活性、 MDA 水平有降低趋势, 表明其保护血脑屏障的作用机制可能与氧化应激有关。
七十味珍珠丸组方多, 而且为保密处方, 对血脑屏障发挥保护作用的机制较复杂。 本实验从血脑屏障通透性角度进行考察, 可为今后研究七十味珍珠丸ROS/RNS-MMPs-TJs 信号通路提供参考。

