木质素磺酸钠对镁合金AZ91D的缓蚀作用及其机理研究
刘 瑶,卢朝霞,郑 萌
(1.广西大学,南宁530000;2.中国科学院海洋研究所,青岛266000;3.青岛海洋科学与技术国家实验室,海洋腐蚀与防护开放工作室,青岛266000)
由于镁合金的强度高、密度小,在汽车、航天航空、生物医学和化工等领域得到了广泛的应用[1-5]。而纯镁的标准氢电极电位是-2.37 V[6],化学性质十分活泼,极易腐蚀,在含氯离子的腐蚀介质中尤为更甚,因此,镁合金在海洋环境中的应用受到局限。添加缓蚀剂是一种常用的减缓和保护金属不被腐蚀的方法。目前,减缓镁合金腐蚀比较有效的缓蚀剂是由硅酸盐[7-8]、磷酸盐[9]、磷酸氢盐[10]、氟化物[11]、锌盐和铬酸盐等构成的沉淀膜型缓蚀剂,由长链烷基磺酸盐[12-13]、烷基羧酸盐[14]、氨基酸[15-16]和阴离子表面活性剂[17-18]等构成的吸附性缓蚀剂,以及一些天然提取物[19-21]缓蚀剂。
木质素磺酸钠(SLS)是一种天然高分子聚合物,也是一种阴离子表面活性剂,对环境无危害。SLS可溶于水,在低浓度条件下以单分子的形态存在,SLS单分子直径约为14~22 nm;随其浓度的增加,SLS单分子开始聚合,形成球状的微粒,微粒直径约为0.5~1μm[22-23]。据文献[18]报道,当SLS质量浓度为4.0 g·L-1时,其对AZ31B镁合金的缓蚀作用最强,缓蚀率达75%,且其缓蚀机理为π键及库仑力的共同作用,符合Langmuir化学吸附模型。本工作针对文献[22-23]与文献[18]关于SLS缓蚀机理的差别,通过电化学阻抗法、动电位极化曲线法、失重法等考察了AZ91D镁合金在含不同量SLS的3.5%(质量分数,下同)NaCl溶液中的腐蚀行为,以明确木质素磺酸钠对AZ31B镁合金的缓蚀机理。
1 试验
1.1 试样及试剂
试验材料为AZ91D镁合金作,其中电化学试验用试样的制备过程如下:电极一端裸露,面积为1 cm×1 cm,另一端用环氧树脂密封。工作电极表面用SIC水砂纸(400~3 000号)逐级打磨。然后,去离子水清洗后,在丙酮中超声除油后待用。浸泡试验用试样尺寸为2 cm×5 cm×0.5 cm。试样表面经SiC水砂纸(400~3 000号)逐级打磨,去离子水清洗,丙酮超声除油后,再次经去离子水冲洗、吹干后,称量待用。
试验所用药品如表1所示。

表1 试验用药品Tab.1 Experimental drugs
1.2 试验方法
1.2.1电化学测试
电化学试验在ZAHNER ZNNIUM pro电化学工作站上完成,采用三电极体系,工作电极为AZ91D镁合金试样,参比电极为232型的饱和甘汞电极(SCE),辅助电极是铂电极,尺寸是2 cm×2 cm。测试温度为20℃,试验溶液为3.5%(质量分数,下同)氯化钠溶液。电化学阻抗测试待工作电极的开路电位稳定后进行,交流扰动电压为5 mV,频率为0.1~105Hz;极化曲线扫描速率为1 mV/s,扫描范围相对于开路电位为-250~250 mV。由于镁合金表面不稳定且极易氧化,所以极化曲线测试由开路电位分别往阴极和阳极扫描。
由电化学阻抗谱和极化曲线测得的缓蚀率用公式(1)和公式(2)计算:
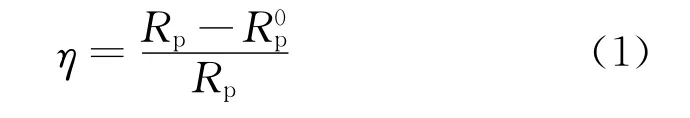
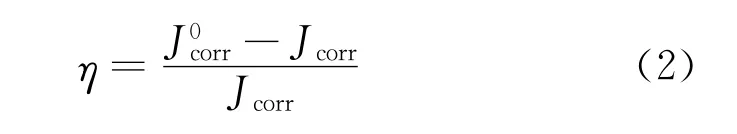
1.2.2静态失重试验
静态失重试验的温度为20℃,将镁合金试样分别浸入复配获得的缓蚀溶液中,72 h后取出。用铬酸洗液(200 g/L三氧化铬和10 g/L的氯化银)清洗5~10 min[6]。然后用无水乙醇和去离子水冲洗,干燥,称量,采用公式(3)计算腐蚀速率:
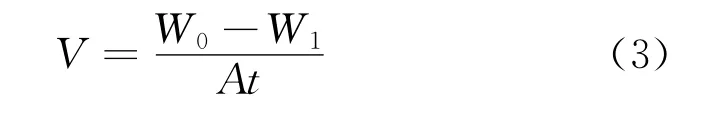
式中:W0和W1分别是浸泡腐蚀前后试样的质量,A为电极面积,t为浸泡时间。公式(4)为失重试验缓蚀率的计算公式:
自1877年以来,Dentsply Sirona公司全球有超过15 000名员工,其中800名在瑞士Ballaigues工作——致力于牙科医疗产品的研发。该公司发明了电动牙钻机,研发了第一台大块填充补牙机,运用直接修补技术更快更简单地完成整个过程。此外公司还宣称其在牙齿种植和电子工具领域可以带来更安全有效的使用操作。
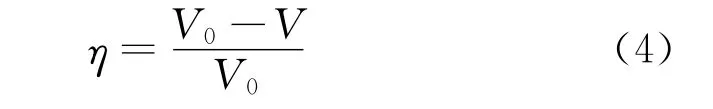
式中:V0和V分别是试样在空白溶液和添加缓蚀剂溶液中的腐蚀速率。
1.3 扫描电镜及能谱分析
将AZ91D镁合金试样分别浸入空白溶液和含有0.1 g/L、1 g/L和4 g/L SLS的3.5%NaCl溶液中72 h后取出,再用去离子水冲洗,吹干,采用日本JEOL公司出品的JSM-5600LV型扫描电子显微镜及其附属X射线能谱仪对浸泡后试样的表面形貌及其氧化产物进行元素分析表征。
2 结果与讨论
2.1 动电位极化曲线
由图1和表2可见:试样在含不同量SLS的NaCl溶液中的开路电位均在-1.57 V左右;当SLS的质量浓度为0.5 g/L和1 g/L时,试样的极化曲线几乎重合,表明其腐蚀抑制机理一致;此外,在含SLS的NaCl溶液中,试样的阴极反应过程斜率相对在空白溶液中的略微下降,说明阴极反应过程被促进了,而阳极反应过程出现电流平台,这是由阳极脱附过程引起的[23]。阳极脱附是因为阳极极化到一定程度时,SLS覆盖在金属表面的薄弱环节不再稳定,发生了快速阳极溶解,SLS随着溶解的金属离子一起离开了金属表面,于是吸附脱附平衡被打破,导致阳极溶解电流密度迅速增大,这种效应会影响整个金属表面的吸附平衡,导致吸附粒子在金属表面的覆盖率迅速趋近于零,金属表面成为“裸”表面[24]。而当SLS含量大于等于2 g/L后,其极化曲线类似,对试样的腐蚀抑制机理相同,其阳极过程和阴极过程均被抑制,腐蚀电流密度迅速下降,缓蚀率均达到了90%以上。
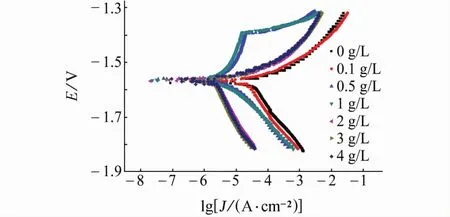
图1 试样在含不同量SLS的3.5%NaCl溶液中的极化曲线Fig.1 Polarization curves of samples in 3.5%NaCl solution containing various concentrations of SLS
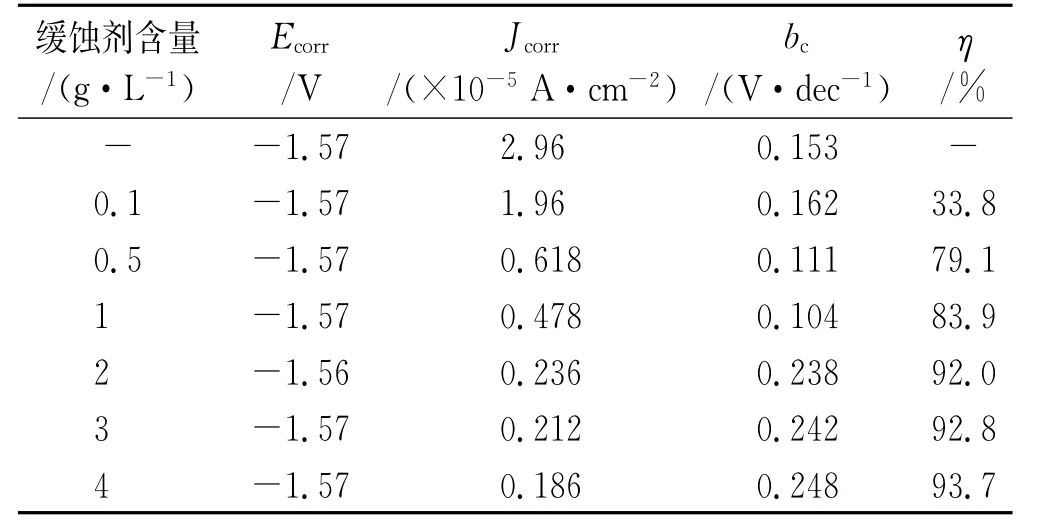
表2 极化曲线拟合结果Tab.2 Fitting results of polarization curves
2.2 电化学阻抗谱
电化学阻抗谱的横轴表示实部阻抗值,纵轴表示虚部阻抗值;容抗弧的直径代表缓蚀剂对镁合金的缓蚀性能,半径越大,阻抗越高,缓蚀性能越好。由图2可见:添加缓蚀剂后,容抗弧直径随着SLS含量的增加而增加,并且显著大于空白溶液的,这说明添加SLS缓蚀剂能显著提高镁合金的耐蚀性。
试样在空白和含0.1 g/L SLS的3.5%NaCl溶液中的电化学阻抗谱均包含1个高频容抗弧和1个低频感抗弧,说明3.5%NaCl溶液中加入0.1 g/L SLS没有明显改变镁合金的反应类型,出现低频感抗弧是由于局部腐蚀较快,大量析氢[25];当SLS的质量浓度为0.5 g/L和1 g/L时,感抗弧已消失,说明镁合金表面不再存在明显的析氢,且SLS开始聚合,溶液中同时存在聚合的SLS大分子和未聚合的SLS小分子,其共同吸附在AZ91D镁合金表面,抑制AZ91D镁合金的腐蚀;当SLS质量浓度为2,3,4 g/L时,SLS几乎完全团聚成微粒,其阻抗谱在阻抗复平面中退化成为一简单的容抗弧,且缓蚀率很高,达到90%以上,从其极化曲线图中也可看出,此浓度下镁合金的腐蚀电位几乎不变,由此可判断:当SLS浓度大于等于2 g/L时,其对镁合金的缓蚀作用机理是几何覆盖效应[24]。
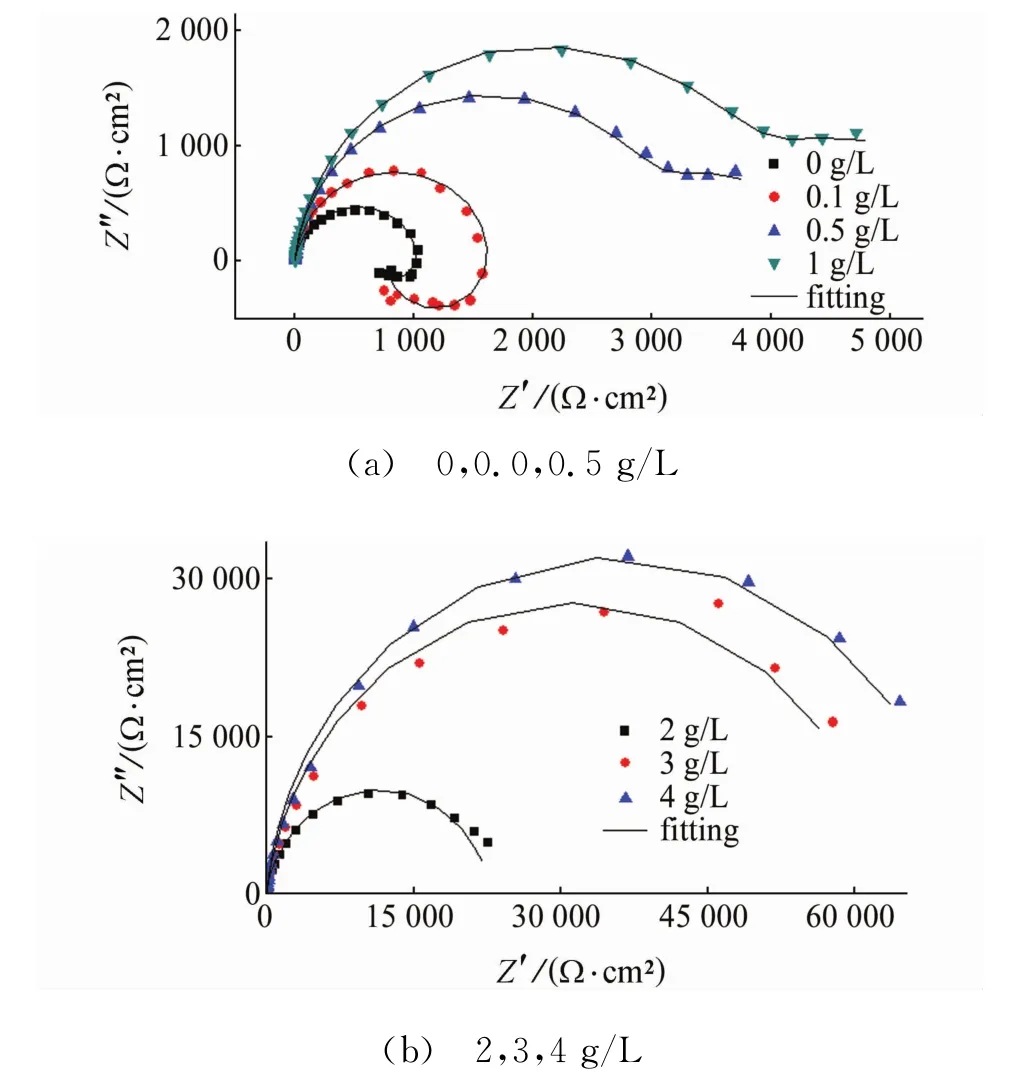
图2 试样在含不同量SLS的3.5%NaCl溶液中的Nyquist图Fig.2 Nyquist diagrams of samples in 3.5%NaCl solution containing various concentrations of SLS
采用图3所示等效电路对图2进行拟合,其中,Rs是溶液电阻;Qfi是常相位角元件,代表膜层电容,n代表弥散因子;Rfi代表膜层电阻;CPEdl代表双电层电容,Rct代表电荷转移电阻,RL代表电感电阻,L代表感抗,η代表缓蚀效率。相关电化学阻抗谱拟合参数见表3~5。可以看出,随着SLS含量的增加,其对镁合金的缓蚀率η不断增加。当SLS含量较高时,由于SLS分子完全团聚,其对镁合金的腐蚀抑制是几何覆盖效应,属于物理吸附,且是动态吸附平衡过程,所以其对应的阻抗谱退化成一个简单的容抗弧,可以用一个电容加电阻元件拟合。而SLS质量浓度浓度为0.1 g/L时,在镁合金表面未形成完整的膜层,所以其对镁合金的缓蚀率非常低;而当其质量浓度为0.5 g/L和1 g/L时,由于溶液中部分SLS分子团聚,不管是单个SLS分子,还是团聚的SLS微粒,均共同吸附在镁合金表面,SLS小分子会填充到大分子间的间隙,使膜层更致密,电阻增大。电荷转移电阻Rct随着SLS浓度的升高而不断上升,说明镁原子变成镁离子的难度加大,镁合金AZ91D的腐蚀过程被抑制。

图3 试样在含不同量SLS的3.5%NaCl溶液中的EIS等效电路图Fig.3 Equivalent circuits of EIS for samples in 3.5%NaCl solutions containing various concentrations of SLS

表3 电化学阻抗谱的相关电化学参数的拟合结果(SLS含量为0,0.1 g/L)Tab.3 Fitting results of electrochemical parameters of EIS(SLS content of 0,0.1 g/L)

表4 电化学阻抗谱的相关电化学参数的拟合结果(SLS含量为0.5,1 g/L)Tab.4 Fitting results of electrochemical parameters of EIS(SLS content of 0.5,1 g/L)

表5 电化学阻抗谱的相关电化学参数的拟合结果(SLS含量为2,3,4 g/L)Tab.5 Fitting results of electrochemical parameters of EIS(SLS content of 2,3,4 g/L)
2.3 静态失重试验
由表6可见,随着SLS含量的增加,其对铝合金AZ91D的缓蚀率不断上升,当SLS质量浓度为2 g/L时,缓蚀率达89%以上;继续增加SLS的量,其缓蚀率的增加已不明显。该结果与动电位极化曲线和阻抗图谱测试结果一致。
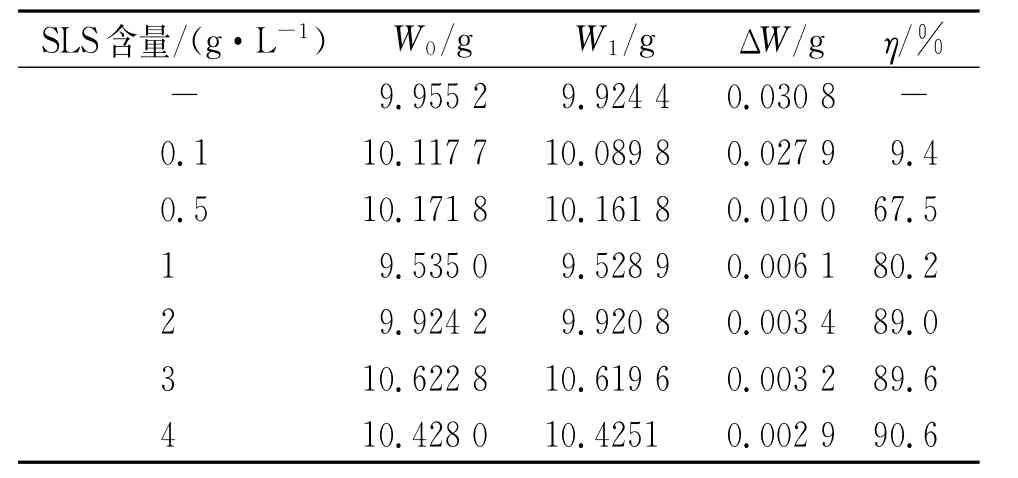
表6 试样在含不同量SLS的3.5%NaCl溶液中浸泡72 h后的试验结果Tab.6 Test results of samples immersed in 3.5%NaCl solutions containing different content of SLS for 72 h
2.4 表面形貌分析
由图5可见:在空白溶液中浸泡72 h后,环氧树脂与基体间为一层疏松膜,膜厚约为10μm;当溶液中含有0.1 g/L SLS时,环氧树脂与基体间的膜层厚度约为7μm,膜层也较疏松,说明0.1 g/L SLS对镁合金的缓蚀效果有限;当SLS质量浓度为1 g/L时,试样表面膜的厚度明显减小,约为2μm,膜层总体较致密,但也存在疏松的部位;当SLS质量浓度为4 g/L时,试样表面出现一层紧贴金属基体的致密薄膜层,约为2μm,这说明SLS对镁合金起到很好的缓蚀作用。

图4 试样在含不同量SLS的3.5%NaCl溶液中浸泡72 h后的表面形貌Fig.4 Surface morphology of samples immersed in 3.5%NaCl solutions containing different content of SLS for 72 h
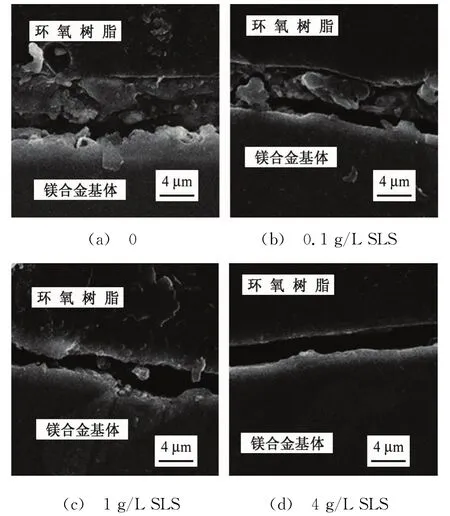
图5 试样在含不同量SLS的3.5%NaCl溶液中浸泡72 h后的截面形貌Fig.5 Cross-section morphology of samples immersed in 3.5%NaCl solutions containing different content of SLS for 72 h
2.5 EDS图谱
由图6可见:在空白溶液中浸泡72 h后,试样表面的O元素含量比较高,达到47.83%,这表明试样表面腐蚀严重,Mg被氧化成Mg(OH)2;随着溶液中SLS含量的增加,试样表面O元素含量不断降低,镁合金的氧化受到了抑制,即其腐蚀受到抑制。由图6还可见:在不同溶液中浸泡72 h后,试样表面的S(S是SLS的特征元素)元素含量都非常低,这是由于在清洗AZ91D镁合金的过程中,SLS被除去了。这说明SLS在AZ91D镁合金表面的吸附是动态的物理吸附平衡过程,在清洗过程中,吸附平衡被打破了,SLS迅速脱附,所以在AZ91D镁合金表面无法检测到S元素。
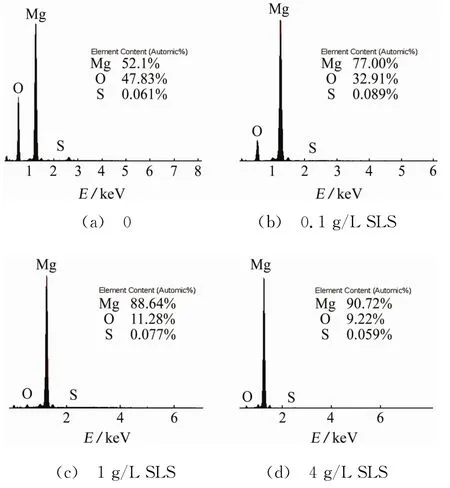
图6 试样在含不同量SLS的3.5%NaCl溶液中浸泡72 h后的EDS图谱Fig.6 EDS patterns of samples immersed in 3.5%NaCl solutions containing different content of SLS for 72 h
2.6 缓蚀机理分析
图7为SLS分子的团聚过程,研究表明[22-25],团聚后的SLS大分子呈球形,外部大部分是亲水的羧基,内部是疏水的苯环以及少量的酚羟基,随着SLS含量的增加,溶液中的SLS分子会从部分团聚发展成完全团聚。由图8可见:当SLS含量较低时,SLS分子未完全覆盖金属表面,出现局部大量析氢,在阻抗谱中出现感抗弧;当SLS为中等浓度时,由于SLS部分团聚,溶液中既存在SLS单分子,也存在团聚后的SLS大分子,SLS单分子吸附的表面膜层较薄,在阳极极化过程中易被击穿,导致镁金属大量溶解,SLS单分子随之脱附,打破表面的吸附平衡,因此,在动电位极化曲线图谱中出现电流平台现象;当SLS含量较多,SLS完全团聚,镁合金AZ91D表面的吸附膜层较厚,能有效隔离水分子的继续浸入,起到有效抑制镁合金AZ91D腐蚀的作用。
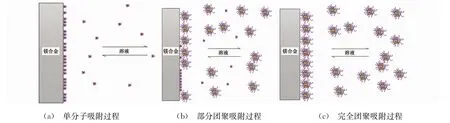
图8 不同聚合程度下的SLS分子在镁合金AZ91D表面的吸附机理图Fig.8 Adsorption mechanism diagram of SLSon the surface of Mg alloy AZ91D:(a)Adsorption process of single molecule;(b)Adsorption process of partial aggregation;(b)Adsorption process of full aggregation
3 结论
(1)SLS作为一种阴离子型表面活性剂,对镁合金AZ91D具有很好的缓蚀作用,其缓蚀率随其含量的增加而升高。
(2)当SLS含量较低时,未团聚的SLS对镁合金AZ91D的表面覆盖不完全,腐蚀抑制效果不明显;增加SLS的量,SLS部分团聚,能明显抑制镁合金AZ91D的阳极反应过程,对阴极反应过程略微促进;当SLS量较高时,SLS完全团聚,对镁合金AZ91D的抑制作用是几何覆盖效应的,同时抑制阳极反应和阴极反应过程。
(3)SLS单分子和团聚后的SLS大分子在镁合金AZ91D表面的吸附都是动态的物理吸附平衡过程。

