泡状棘球蚴淋巴结转移的影像表现及病理分析
蒲 鹏, 刘 丽, 陈增雄, 代 净
(阿坝藏族羌族自治州人民医院1放射科, 2病理科, 四川 马尔康 624000)
棘球蚴病是一种日益引起关注的人兽共患寄生虫病,在我国主要流行分布于西北部9省的畜牧区,但在全国各省、直辖市非流行区都可见散发病例报道[1]。泡状棘球蚴病的临床表现、病程和预后与细粒棘球蚴病截然不同,是目前唯一一种与肝癌特征相似的寄生虫病[2]。肝脏是泡状棘球蚴病首发和主要受累器官,病灶可直接侵犯周围组织器官和通过血行、淋巴全身播散、转移[3]。利用CT和MRI能够准确地对肝泡状棘球蚴病进行PNM(parasite lesion, neighboring organ invasion,metastases, PNM)分类,评价肝内血管、胆管和周围受侵情况,磁共振动态增强扫描和扩散加权成像能够更好地反应病灶浸润范围和评估泡球蚴的活性[4]。目前对泡状棘球蚴病肝外淋巴结转移的影像学表现研究报道较少,容易误诊为肝脏恶性肿瘤并淋巴结转移。随着畜牧区经济的发展和交通的方便快捷,地域性限制特点会有所变化,疫区患者到非疫区交流和寻求更好的医疗技术,并且随着草原旅游的蓬勃发展,更多的旅行者也存在被感染的风险,在非流行区域对该病的认识和诊断是一个挑战。本研究通过结合病理学对泡状棘球蚴淋巴结转移的CT、MRI影像表现进行探讨,旨在提高对该病的认识、避免误诊。
1 资料与方法
1.1 一般资料选择2014年5月-2018年6月肝泡状棘球蚴病并淋巴结肿大患者14例,对其临床、病理和腹部CT、MRI影像资料进行回顾性分析。男性4例,女性10例,年龄30~55岁,平均年龄(40.5±8.2)岁。纳入标准:(1)肝泡状棘球蚴病并有腹部淋巴结肿大(淋巴结短径≥1 cm);(2)手术前1周内进行腹部CT和MRI检查并有CT或MRI增强扫描影像学资料;(3)肝泡状棘球蚴病灶和淋巴结经手术切除并有病理组织学资料。排除标准:(1)肝泡状棘球蚴病既往有手术和药物治疗史。(2)合并有结核、肿瘤。根据此标准共14例肝泡状棘球蚴病纳入观察。
1.2 检查方法CT扫描仪为GE Brightspeed 16 MSCT。腹部常规CT平扫和多期动态增强扫描,扫描范围从膈顶至骶髂关节下缘。常规层厚和层间距5 mm及门静脉期图像1.25 mm薄层重建后冠矢状图像重组。增强对比剂注射速率3~3.5 mL/s(碘海醇,300 mg/100 mL),剂量1.5~2 mL/kg;动脉期30~35 s,门静脉期60~70 s,延迟期:180~210 s。
MRI扫描仪为GE 1.5T Brivo 355。使用腹部相控阵列线圈,层厚8 mm,层间距2 mm。常规横断序列和参数:呼吸触发FRFSE序列脂肪抑制T2WI(TR 2~3个呼吸周期,TE=75 ms,ETL=10~17)、2D FSPDGR-T1WI(TR=180 ms,TE=2.1 ms和4.2 ms)、LAVA平扫和三期动态增强扫描(TE minimum,激发角度15度)。对比剂为钆喷酸葡胺,用量15 mL经肘静脉推注,速率2 mL/s。分别在注射造影剂后13~18 s、40~50 s、80~120 s和3 min时进行动脉期、门静脉期、平衡期及延迟期扫描。
1.3 图像处理由2位高年资放射医师在工作站上独立观看CT和MRI图像。对短径≥1 cm的淋巴结进行观察,记录淋巴结部位、数量、大小、坏死、钙化、密度和信号特点(以正常肝实质为参照)及强化方式,结合病理结果进行统计。
1.4 统计学处理采用 SPSS 19.0软件进行统计学分析,对淋巴结反应性增生组和转移性淋巴结组采用Fisher确切概率检验,对淋巴结强化方式进行比较,以P<0.05为差异具有统计学意义。
2 结果
2.1 肝泡状棘球蚴病灶分布和淋巴结病理组织学特征在14例肝泡状棘球蚴病中,单发病灶10例,其中肝右叶5例,肝左叶4例,尾状叶1例。多发病灶4例,其中肝右叶和左叶1例,肝右叶、肝左叶和尾状叶1例,肝左右叶多个病灶2例。共31枚淋巴结肿大,5枚(3例)为淋巴结反应性增生(术前影像诊断为泡球蚴转移淋巴结)。26枚(11例)为转移淋巴结,其中2枚淋巴结为肉芽肿性淋巴结炎,镜下特点表现为以泡球蚴为核心伴周围淋巴细胞、多核细胞、巨噬细胞等炎性细胞浸润的肉芽肿炎症病变,见图1。24枚表现为淋巴结凝固性坏死,镜下特点为凝固型坏死组织内簇状或散在分布的粉皮组织(泡球蚴囊泡),见图2。
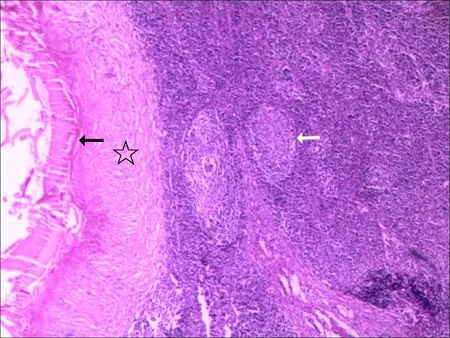
镜下见粉皮(黑箭头所示)周围环形纤维组织增生(☆所示)和淋巴细胞(白箭头所示)

镜下见散在的泡球蚴小囊泡(白箭头所示)周围坏死组织,表面可见少许纤维组织增生(黑箭头所示)
2.2 反应性淋巴结增生部位和影像表现5枚淋巴结反应性增生中位于门腔间隙和肝总动脉旁各1例,1例腹主动脉周围和右肾门3枚淋巴结肿大。平均直径约(1.2±0.2) cm,呈长梭性、椭圆形改变。增强轻中度均匀强化;CT平扫呈等密度;MRI扫描T1WI和T2WI呈等信号。
2.3 淋巴结转移部位、数量、大小和形态11例肝泡状棘球蚴病中,共25组26枚淋巴结转移,单组转移2例,多组转移9例;其中72.7%(8例)淋巴结转移发生于肝十二指肠韧带区域淋巴结,45.5%(5例)肝总动脉旁淋巴结,27.3%(3例)胰头后淋巴结,贲门右、腹腔干周围和腹主动脉周围淋巴结转移分别为18.2%(各2例),肝门、肠系膜上动脉周围和右心膈角旁淋巴结转移分别为9.1%(各1例)。淋巴结平均直径约(2.5±1.1) cm,呈圆形或类圆形改变。
2.4 转移淋巴结的影像表现在26枚转移淋巴结中,2枚(2/26,7.7%)肉芽肿性淋巴结炎为2例单组转移患者,24枚(24/26,92.3%)淋巴结完全凝固性坏死见于多组转移患者。肉芽肿性淋巴结炎CT平扫呈圆形等/稍低密度软组织结节,无坏死和钙化;增强呈不均匀轻中度强化,内见边界不清的斑片状稍低密度区,见图3。MRI平扫T1WI呈稍低信号、T2WI呈稍高信号。24枚淋巴结凝固性坏死CT平扫结果显示13枚(13/26,54.2%)呈稍低密度,8枚(8/24,33.3%)呈等密度,见图4a;3枚(3/24,12.5%)呈高密度。MRI扫描16枚(16/24,66.7%)T1WI 呈稍低信号、T2WI呈稍高信号;8枚(8/24,33.3%) T1WI呈等信号、T2WI呈低信号,见图4b、4c。CT、MRI增强扫描显示24枚凝固性坏死淋巴结内无强化,但13枚(13/24,54.2%)淋巴结边缘可见均匀环形强化的包膜,见图4d。7枚淋巴结(7/26,26.9%)T2WI显示高信号小囊泡,见图5。10枚(10/26,38.5%)合并液化坏死。9枚(9/26,34.6%)可见砂粒、结节样钙化。
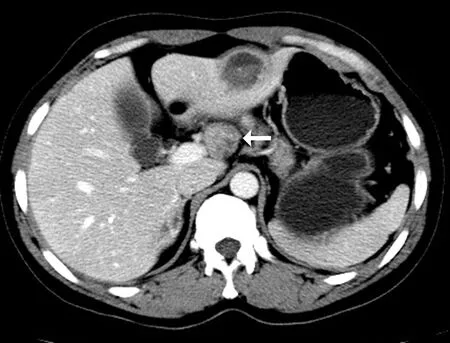
图3 肝左外叶泡状棘球蚴病肝总动脉旁淋巴结转移(肉芽肿淋巴结炎型)。CT增强肿大淋巴结呈轻中度不均匀强化,内见边界不清的小斑片样低密度灶(箭头所示)
2.5 淋巴结强化方式的比较对淋巴结反应性增生组和转移性淋巴结组的强化方式进行Fisher确切概率检验,差异有统计学意义(P<0.05),见表1。

表1 淋巴结反应性增生组和转移性淋巴结组强化方式的比较/例




a:CT平扫肿大淋巴结呈等密度改变,内见环形分布的砂粒、结节钙化灶(箭头所示) b:反相位肿大淋巴结T1WI呈等信号(箭头所示)
c:压脂T2WI呈低信号,内见片状高信号的液化坏死和高信号小囊泡(箭头所示) d:MRI增强扫描肿大淋巴结不强化,周围可见环形强化的包膜(箭头所示)
图4 肝右后叶泡状棘球蚴病肝总动脉后腹腔干右侧淋巴结转移(凝固性坏死型)
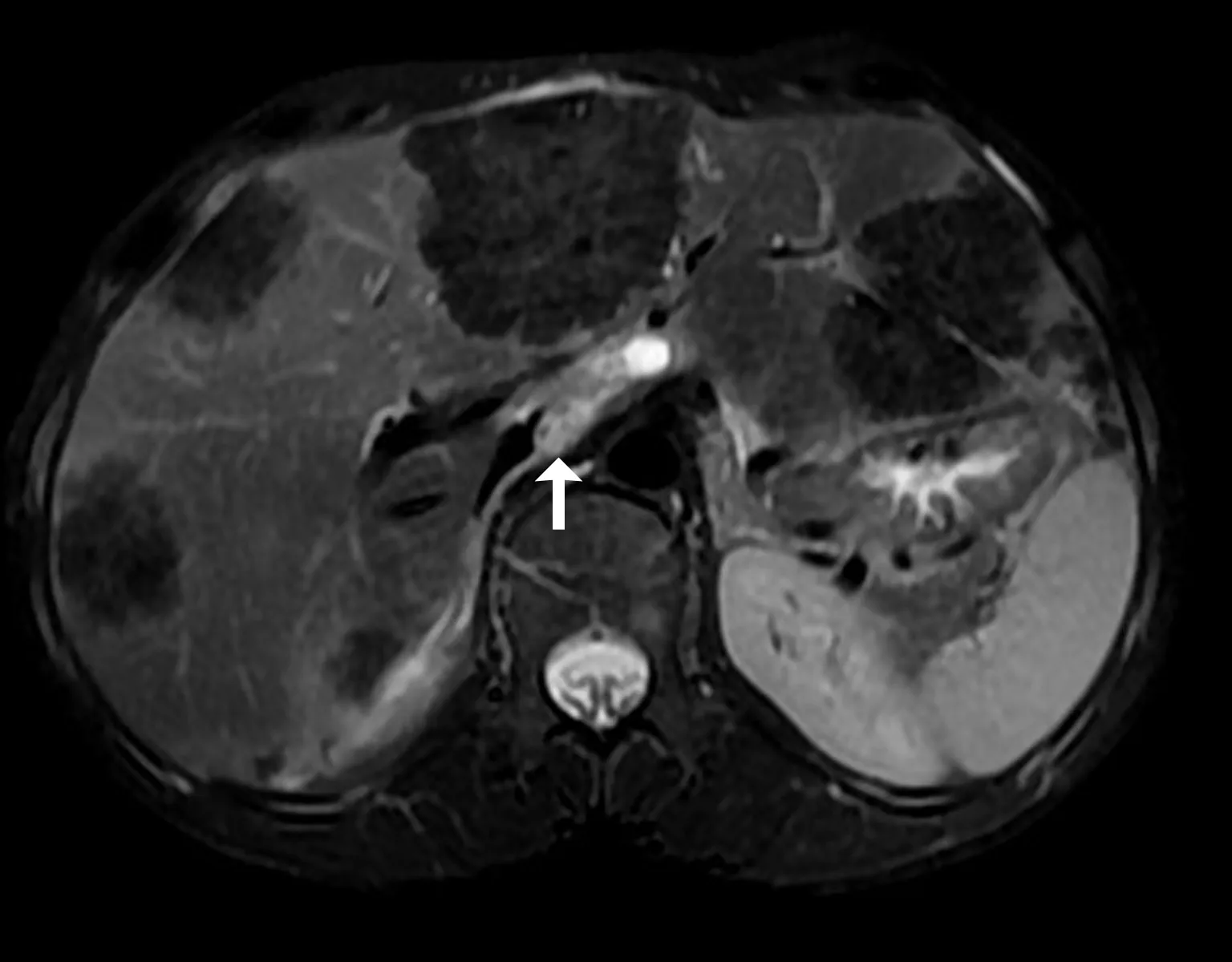
图5 肝泡状棘球蚴病腹膜后下腔静脉和主动脉旁淋巴结转移(白箭头所示)。压脂T2WI肿大淋巴结呈不均匀稍高信号,内见高信号的囊泡(黑箭头所示)。
3 讨论
泡状棘球蚴病在我国主要分布于高海拔寒冻地区,好发于30~50岁畜牧民。肝脏泡状棘球蚴病最多见,泡球蚴增殖破坏肝实质和侵犯周围组织器官,肝静脉、门静脉和淋巴管受侵后泡球蚴增殖芽脱落随血液和淋巴循环发生远处扩散转移。血行转移以肺、脑为最常见,淋巴转移见于腹部和胸部淋巴结[5],其转移率约25%[6]。肝泡状棘球蚴病发生淋巴结转移的具体机制目前仍不完全清楚,低水平CD44蛋白会增加转移的风险[7]。
3.1 转移淋巴结病理表现泡球蚴侵入肝淋巴管后增殖芽脱落,随淋巴循环到达淋巴结皮质,刺激淋巴结反应性增生、肿大,如果虫体未被吞噬、清除,泡球蚴在淋巴结内形成肉芽肿结节,镜下淋巴结内单一或散在分布的肉芽肿结节中簇状分布大小不一微小囊泡,周围纤维组织增生和嗜酸性粒细胞、淋巴细胞与浆细胞等炎性细胞浸润。泡球蚴无限制地内外芽生繁殖,淋巴结结构遭到完全破坏后形成凝固性坏死肿块,镜下见簇状或散在分布的泡球蚴小囊泡,部分肿块表面炎性肉芽肿和纤维组织增生形成包膜。切面呈灰白色或褐黄色,质硬,可见砂粒样、结节状钙化。液化坏死区呈“脓样”或“豆腐渣”样改变。
3.2 转移淋巴结分布泡状棘球蚴病肝外淋巴结转移以多区域淋巴结转移常见,可呈渐进式和跳跃式转移[8]。本组11例肝泡状棘球蚴病转移淋巴结中,以肝十二指肠韧带淋巴结转移最多见(72.7%),其淋巴引流途径经肝深淋巴管网沿门静脉周围引流到肝门淋巴结后到达肝十二指肠韧带再经门静脉后周围淋巴链发生门腔间隙淋巴结转移,然后向胰头后和腹膜后淋巴结转移。其次为肝总动脉旁淋巴结转移(45.5%),肝动脉链淋巴结引流可进一步向腹腔干和腹膜后淋巴结转移。泡球蚴也可经肝浅表淋巴结引流到达贲门淋巴结和膈肌淋巴结丛并可向胸部纵膈淋巴结转移,其转移路径符合肝脏的淋巴回流途径[9]。
3.3 淋巴结转移的CT和MRI表现泡状棘球蚴淋巴结转移根据病理学改变可分为肉芽肿性淋巴结炎、淋巴结完全凝固性坏死和淋巴结钙化。泡球蚴肉芽肿性淋巴结炎,属于淋巴结转移早期阶段,往往无坏死和钙化。CT和MRI增强在炎性淋巴结轻中度强化的背景下坏死肉芽肿呈相对低密度改变,CT和MRI表现需与淋巴结反应性增生鉴别。泡球蚴小囊泡是泡状棘球蚴病的特征性表现[10],泡球蚴小囊泡的检出有利于准确诊断[11]。但T2加权序列层厚较厚,对小囊泡检出率往往较低,本组资料T2加权序列对转移淋巴结内泡球蚴小囊泡检出率仅为27%,远远低于MR水成像[12],对于疑似病例应该增加MR水成像序列有利于病变的鉴别诊断。淋巴结凝固性坏死密度和信号改变与所处的时期相关,早中期由于泡球蚴内囊液及囊泡破裂囊液外漏引起周围组织炎性反应导致含水量的增加,CT平扫呈稍低或等密度,T2WI呈稍高信号,T1WI呈稍低或等信号。随凝固型肉芽肿水分减少、钙盐的沉积和钙化的形成,CT平扫由低向高密度转变;T1WI信号由稍低向等信号或稍高信号演变、T2WI信号从稍高向低信号改变。T1WI呈等或稍高信号、T2WI低信号属于典型的凝固性坏死信号特点[13]。54%的转移淋巴结边缘环形均匀强化的包膜,主要见于凝固型坏死肿块。T2WI对病变的液化坏死的判断优于T1WI和CT扫描,DWI弥散受限可以与癌性淋巴结转移液化坏死鉴别[14]。泡球蚴转移淋巴结完全钙化在三型中泡球蚴的生物活性最低[15]。
3.4 鉴别诊断该病需与淋巴结反应性增生鉴别。本研究发现淋巴结反应性增生增强后均匀强化,而转移性淋巴结不强化,差异具有统计学意义(P<0.05)。同时淋巴结反应性增生形态呈长梭性或长椭形,形态规整。CT平扫呈密度均匀的软组织结节,T1WI和T2WI呈均匀的等信号。腹部淋巴结结核影像改变与泡状棘球蚴淋巴结转移具有一定相似性[16],但淋巴结结核多数继发于肺结核的肺外伴随,患者有结核中毒症状,结核抗体呈阳性。
综上所述,肝泡状棘球蚴病腹部淋巴结转移途径以肝十二指肠韧带和肝动脉淋巴链转移最为常见,淋巴结凝固性坏死是转移的常见病理组织学类型,肉芽肿性淋巴结炎是早期转移表现。肿大淋巴结内密度、信号的异常可提示淋巴结转移,CT和MRI增强各期都不强化是淋巴结转移的可靠征象。目前,国内外关于肝泡状棘球蚴病淋巴结转移的相关性研究较少报道,淋巴结转移对患者的生存和预后的影响还有待进一步研究。

