房颤进展过程中犬左、右房心肌结构重构及超微结构的变化的不均一性
张 玲, 芦颜美, 周贤惠, 李耀东, 邢 强, 张疆华, 汤宝鹏
(新疆医科大学1临床医学研究院科研基地科, 乌鲁木齐 830011; 2第一附属医院心脏起搏电生理科, 乌鲁木齐 830054)
心房颤动(简称房颤)是临床最常见的持续性心律失常之一,发病率随着年龄增加而增加,给人民生活质量和经济带来巨大负担[1-3]。临床研究发现起源于左房的房颤较右房的更多[4-5],Embi等[6]研究结果显示羊心右心耳和左心耳糖原的密度和分布不同,左耳较右耳有更多的糖原分布。以上研究为左房较右房更容易发生房颤提供了组织学基础。
房颤时发生结构重构的表现为细胞间质纤维化,致心肌收缩性减弱并心脏体积增大[7]。但在房颤从急性至慢性进展过程中的胶原纤维及糖原沉积变化尚不清楚。本课题组之前的研究报道了48 h及8周左心耳起搏慢性房颤模型左右心耳在48 h及8 周房颤的胶原纤维及糖原的变化情况[8],但未有HE染色、左、右心房及超微结构变化的报道。本研究通过右心房快速起搏48 h及8 周建立犬房颤模型,通过HE染色、糖原染色及马松(Masson)染色观察犬在房颤进展过程中大体结构及超微结构的变化及糖原和胶原纤维的变化,为房颤的结构重构的机制提供实验基础。
1 材料与方法
1.1 研究对象选取成年比格犬18只,雌雄不限,体质量 (12±2.23) kg,购自新疆医科大学动物实验中心。通过Lead 7000电生理仪持续监测和记录。实验设计和实施均通过了新疆医科大学第一附属医院伦理委员会审批。
1.2 实验动物分组及房颤模型的制作实验动物用随机数字表法被随机分为3组:对照组(control组),6只,犬植入起搏器不起搏;起搏48 h组(48 h AF 组),6只,犬经颈静脉穿刺,通过7 F鞘管送入10极电极至高位右心房,以600次/min起搏,2倍的阈值电压刺激高右房,待心电监测出现房颤心电图后开始持续起搏48 h。起搏8 周组(8 w AF 组),6只,犬右侧开胸,暴露心脏并心包吊篮,双极电极缝于右心耳,缝合关闭心包。电极连于起搏器电极发生器。起搏器缝于右侧胸肌囊袋内。1周恢复后,起搏器打开并发放刺激,频率为600 次/min。心电图记录出现房颤图像后,持续起搏8周[9-10]。
1.3 组织学收集和处理造模结束后给予高剂量的戊巴比妥纳实行安乐死,取出心脏。将左、右心房组织固定于4%多聚甲醛,石蜡包埋。组织均根据染色的标准过程进行HE染色,糖原和Masson染色。电镜标本的留取,安乐死后即刻取左右心房组织切成1 mm3大小,4%戊二醛固定2 h,1/15 moL磷酸盐缓冲液漂洗,1%四氧化饿固定,丙酮脱水。丙酮浸透1 h后包埋并超薄切片,醋酸铀染色15~30 min,后透射电镜观察和采图[8-9,11]。
1.4 组织影像的形态学分析染色的切片通过连接于倒置显微镜(Carl Zeiss,German)上的CCD摄像机捕捉,并用Axio Vision software(Axio Vision 4.1 Zeiss. German)软件进行分析。所有切片采样均在同样的采样下进行。糖原染色阳性细胞的测定和胶原阳性纤维的测定分别采取20×倍和 40×倍放大。糖原染色阳性区域和胶原纤维的量化测量采用Image Pro Plus 6.0图像分析软件(Media Cybernetics,Inc.)。糖原和纤维的测量采用染色区域/ 图形的总面积[8-9,11]。
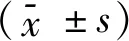
2 结果
2.1 模型制作完成情况急性及慢性房颤模型的制作方法均参照文献[9-10]进行模型制作方法。18只犬均顺利完成整个实验过程。实验过程中,血压心率平稳,无心衰现象发生。所有模型房颤成功率100%。
2.2 房颤模型心电图检测所有实验犬基础状态体表心电图均呈窦性心律,control 组于8周内每周行心电图观察均为窦性心律,48 h AF组起搏后即刻便为房颤心律,持续心电监测均为房颤心律。8 w AF组起搏器开启后数小时变为房颤心律,8周内每周行心电图观察起搏器工作状态下均为房颤心律。
2.3 组织学研究
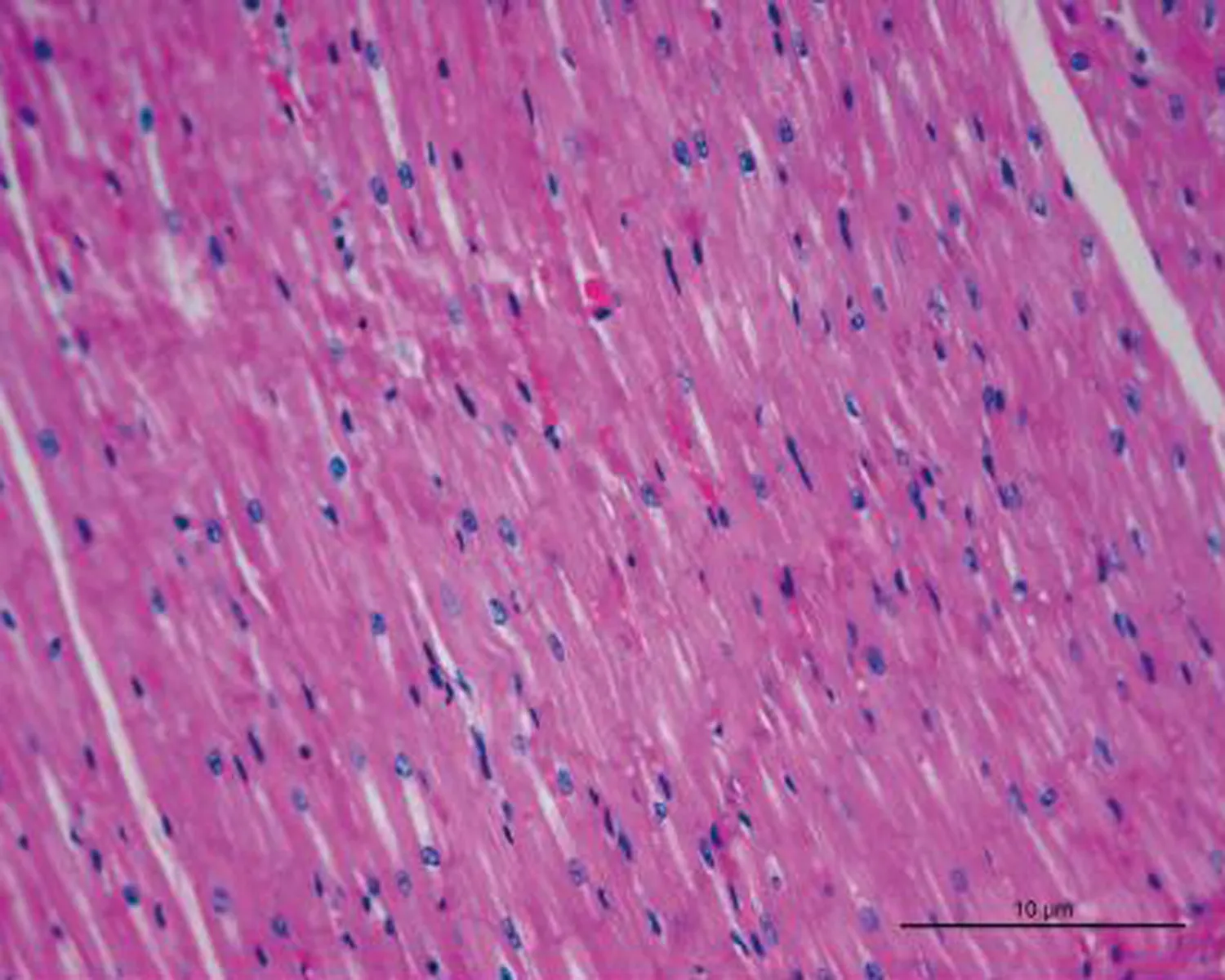
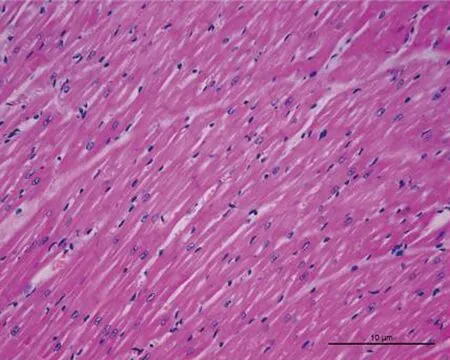
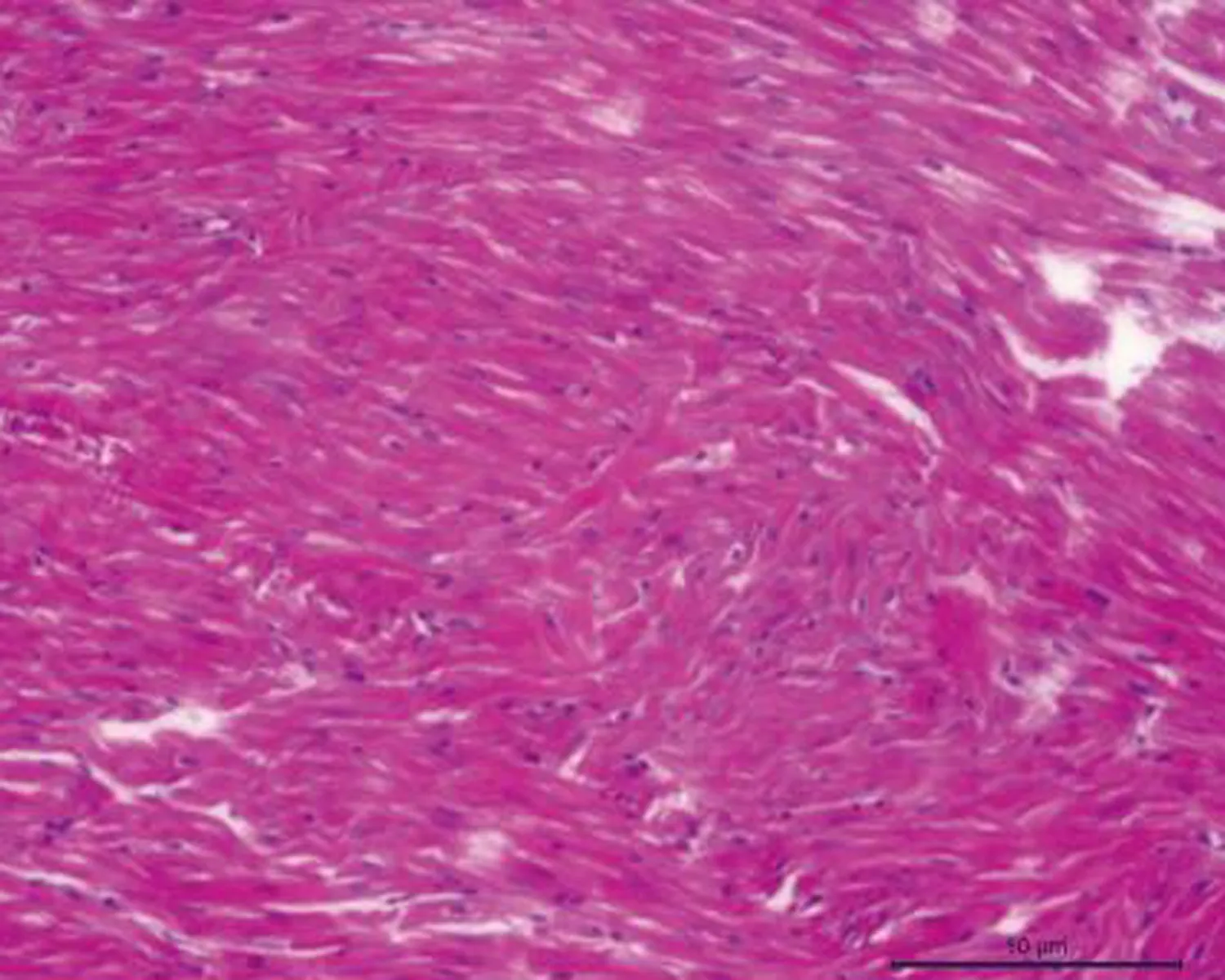
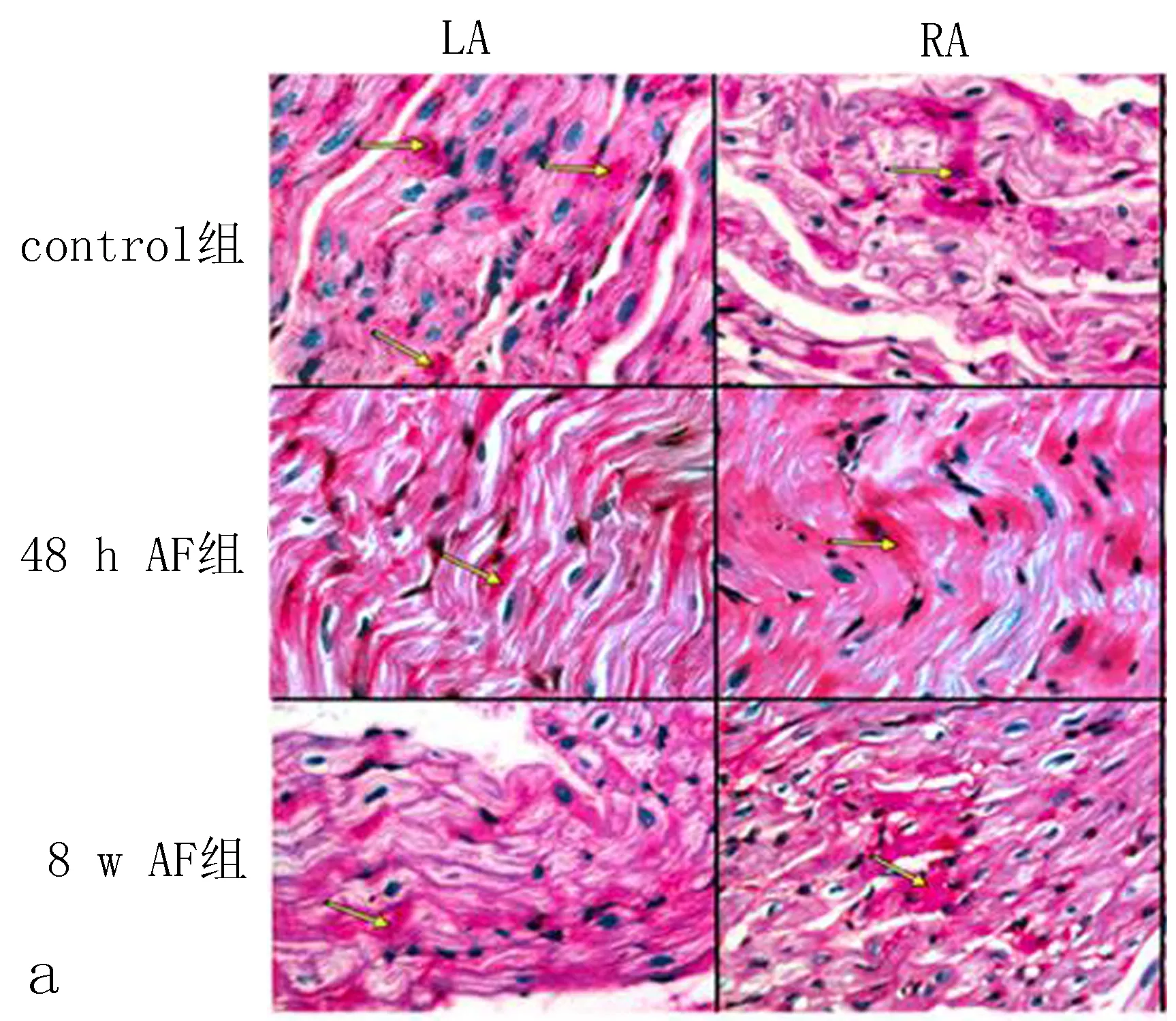
2.3.1 HE染色的比较 control组犬左心房组织切片HE染色可见心房肌细胞排列整齐,核清晰,周围仅有少量间质。48 h AF组HE染色较control组无明显变化。8 w AF组犬左心房组织切片上HE染色可见心房肌细胞核大小不规则清晰度明显降低,心肌纤维排列明显紊乱,核异型明显,细胞内可见肌纤维断裂;结缔组织增生,心肌细胞间隔明显增宽,见图1。
control 组 48 h AF 组 8 w AF 组
图1 3组左心房HE染色(×100)
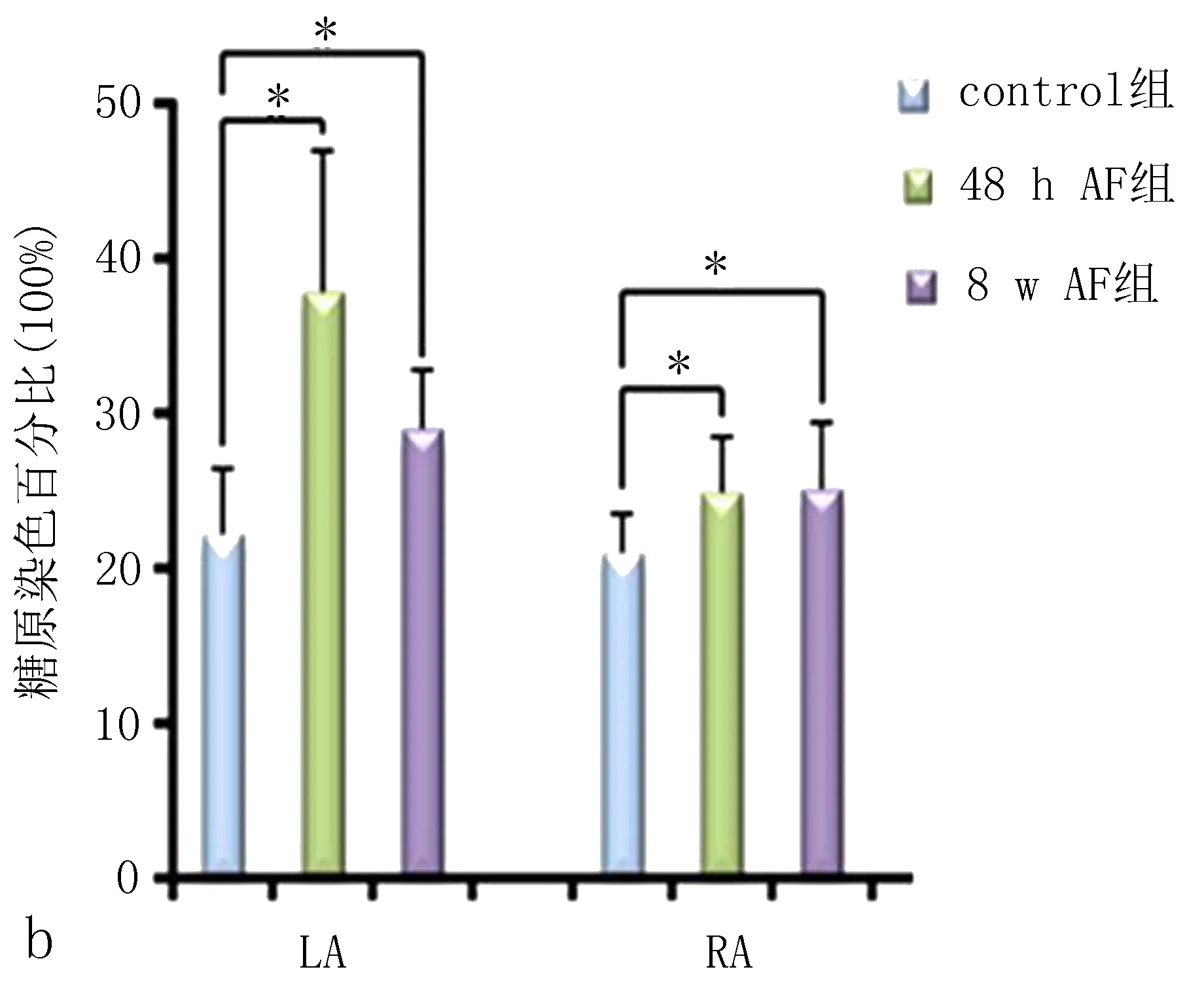
2.3.2 糖原染色的比较 图2显示了control组、48 h AF组、8 w AF 组左心房(LA) 和右心房(RA)糖原分布的比较。糖原染色结果显示,control组LA和RA心肌细胞仅有少量糖原聚集,48 h AF组心肌细胞糖原染色阳性物质较control组增多,LA多于RA,8 w AF 组胞浆内糖原颗粒明显增多形成糖原湖,LA较RA更明显,差异有统计学意义。
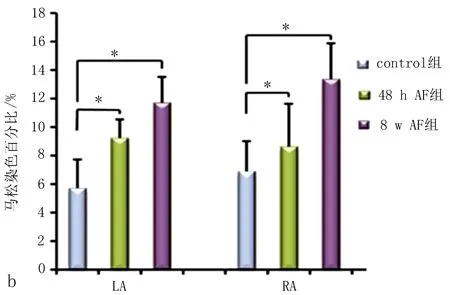
2.3.3 马松染色 胶原纤维的分布通过马松染色来判断。图3显示了control 组、48 h AF组、8 w AF 组 LA和RA胶原沉积的比较。Masson染色结果显示,心肌纤维为红色,胶原纤维为蓝绿色,control 组犬心肌有少量胶原均匀分布于肌纤维之间。48 h AF组胶原纤维轻度增多,8 w AF组心肌细胞排列紊乱,胶原纤维大量分布于肌纤维之间且相互连接成网状,排列紊乱,分布不均匀,LA较RA更明显,8 w AF 组纤维化程度较48 h AF组更重。
2.4 电镜结果的分析control 组肌原纤维细胞排列整齐紧密,心肌细胞核膜完整,核仁清晰,核质分布均匀,胞浆内线粒体大小均一分布,膜完整,脊清楚,闰盘结构完整,胞浆丰富,见图4a。48 h AF 组心肌细胞核膜完整,核仁清晰,核质分布均匀,肌纤维间质增宽,间质部线粒体聚集,见图4b。8 w AF 组线粒体肿胀变长,体积增大,基质变淡。肌原纤维排列紊乱,肌节长短不一;糖原聚集,峭异形明显,心肌闰盘不连续,扭曲,见图4c、4d。





a: control组肌原纤维细胞排列整齐紧密,心肌细胞核膜完整,核仁清晰,核质分布均匀,胞浆内线粒体大小均一分布,膜完整,脊清楚,闰盘结构完整,胞浆丰富。 b: 48 h AF 组心肌细胞核膜完整,核仁清晰,核质分布均匀,肌纤维间质增宽,间质部线粒体聚集。
c: 8 w AF组心肌细胞间线粒体变长,增多线粒体肿胀,体积增大,基质变淡。
d: 8 w AF组肌原纤维排列紊乱,肌节长短不一;糖原聚集,细胞器数量增多,峭异形明显,心肌闰盘不连续,扭曲。
图4 control组、48 h AF组、8 w AF组心肌细胞马松染色电镜观察
3 讨论
通过持续快速心房起搏构建房颤模型是目前最常用的建立房颤模型的方法[10-11]。人和动物研究均发现,LA起源的房颤更常见,左、右心房的结构特征、蛋白表达均有不同。由于左、右心房的解剖等特性,使LA更易发生房颤[12-13]。先前的研究也发现,在基线状态左心耳较右心耳有更多的糖原聚集,通过左心耳起搏建立AF模型后48 h及8 周均出现了LA的糖原聚集比RA更明显的现象,且8 周糖原聚集程度较48 h更重,LA的糖原分布可从闰盘延伸到心肌细胞[9],这些发现表明这些部位的糖原聚集可能在横向和纵向方向阻碍了心肌细胞间的电传导,这些异质性分布的阻碍传导的糖原岛使得非单一激动波阵形成缓慢的传导异向性,而由于左侧糖原分布更多使得LA来源的房颤较RA更容易发生。在本研究中,在基线状态,即使使用右心房起搏,LA的糖原累积仍较RA明显。提示无论LA起源或RA起源的房颤,均可造成LA的糖原累积程度较右侧重。无论在基线还是AF的进展阶段,LA及RA的糖原浓度和分布的不同可能促进了房颤发生。
房颤及其伴随的心血管疾病常常可能诱发心房肌在组织学水平及超微结构不同程度的变化。房颤的病史越长,结构重构的程度越重。房颤是一种伴随着心房肌结构重构的心律失常,房颤既是结构重构的结果,随着房颤的发展也可促进心房结构重构的进展。因此一旦发生了结构重构,即使恢复为窦性心律,也仅有非常少的结构重构的逆转。而心肌细胞之间的胶原沉积是房颤启动的重要因素,也是房颤导致心房结构重构中的最主要的变化。纤维化是房颤的重要基质及电生理传导阻滞的重要原因,表现为横向及纵向的双向阻滞,从而造成了分割的波阵从而促进了折返的形成[14-15]。本研究结果显示,糖原聚集和其他因素,神经和电生理的变化,为阵发性房颤提供了基质的同时,起搏8周诱发的房颤胶原纤维明显增加为AF的维持提供了基质。已有的研究证据也显示糖原累积和纤维化是房颤形成的长期持续性的形式[16-17]。
超微结构方面,从透射电镜可以看出房颤48 h后仅出现心肌细胞间线粒体聚集心肌能量代谢异常,8 周后可见心肌细胞肌原纤维排列紊乱,心肌闰盘不连续,肌节长短不一。线粒体变长,基质变淡,线粒体脊变短、异形。并出现糖原聚集。随着房颤从阵发性变为持续性,结构重构使得无论经典抗心律失常药物还是单纯肺静脉隔离的房颤治疗都无效[18-19]。因此,房颤的治疗中至关重要的是在房颤发生的早期预防心房的结构重构、纤维化、糖原聚集及超微结构的改变。

