红豆树叶挥发油化学成分及其抗氧化和抑菌活性研究
翟大才,姚建林,王文娟,尹 霞,李 继,奚晓飞,任梦强,柏晓辉*
1黄山学院生命与环境科学学院,黄山 245041;2 安徽省林业厅科技处,合肥 230001
红豆树(OrmosiahosieiHemsl.Et Wils.)为豆科红豆树属半常绿或落叶乔木,中国特有树种[1],国家II级重点保护植物;红豆树的根、茎、叶等皆可入药,具有理气、治疗风湿关节炎等功效[1]。红豆树自然分布于浙江、福建、江苏、湖北及四川等地,安徽有零星栽培[2]。红豆树有隔年结果现象,一般3~5年才开花结果一次,且种子产量较低;同时由于其种子坚硬,种皮透水性差,造成红豆树种子发芽困难,导致其自然更新较难[1]。另外,该树木材质地坚硬、纹理美观、耐腐蚀,是目前中国红木家具中最主要的木材原料,因常被砍伐用于制作各种高档家具、装饰品等,造成其资源稀少。近些年来,在人们的大力保护和研究下,其资源虽得到了有效保护,但天然种群依然很少[3]。
目前,红豆树的研究主要集中在红豆树的育苗与造林、生长特性及天然红豆树林调查等[1],而红豆树叶的成分及其抗氧化和抗菌性能等的研究还处于空白阶段。因此,课题组以红豆树叶为材料,通过水蒸气蒸馏法提取其挥发油,采用GC-MS对挥发油成分进行分析,并测定其对DPPH和ABTS自由基的清除能力及抑菌活性,以期为红豆树叶资源的合理开发利用提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
实验中所用红豆树叶于2018年5月采自安徽省黄山市歙县,经黄山学院潘健博士鉴定为红豆树(OrmosiahosieiHemsl.Et Wils.)的叶子(凭证标本采集号-03;采集人:翟大才;采集地:安徽歙县;采集时间:2018年5月)。
实验所用菌株购于中国典型培养物保藏中心,分别为枯草芽孢杆菌(Bacillussubtilis)、金黄色葡萄球菌(Staphylococcusaureus)、绿脓杆菌(Pseudomonasaeruginosa)和大肠杆菌(Escherichiacoli),以上菌种保存于黄山学院微生物学实验中心。抑菌活性实验使用LB(Luria-Bertani)平板培养基,制备方法参见文献[4]的方法。
1.1.2 仪器与试剂
气相色谱-质谱联用仪(Agilent 7890A-5975C型,美国 Agilent 公司)、超净工作台(ZHJH-C1106B型,上海智城分析仪器公司)、高压蒸汽灭菌锅(SQ510C,重庆雅马拓科技有限公司)、电子天平(AE224,上海恒平科学仪器有限公司)、恒温培养箱(ZGP-2050,上海智城分析仪器有限公司)、紫外可见分光光度计(UV754N型,上海精密科学仪器有限公司)。
2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS,东京化成工业株式会社)、1,1-二苯基-2-三硝基苯肼(DPPH,东京化成工业株式会社);无水乙醚、无水硫酸钠、乙醇(95%)、过硫酸钾、丙酮等为分析纯,购于上海国药集团;酵母提取物、蛋白胨、维生素C(Vc)、琼脂等生化试剂购自上海生工生物工程有限公司。对羟基苯甲酸丙酯(propylparaben,PP),购于Sigma-Aldrich公司。
1.2 实验方法
1.2.1 挥发油提取
称取粉碎后的新鲜红豆树叶60.0 g置于圆底烧瓶中,加入300 mL经两次蒸馏的双蒸水,按水蒸气蒸馏法提取6 h并收集乙醚层,挥发乙醚溶剂,加入无水硫酸钠干燥,得到香味浓郁的淡黄色透明油状物;按照此法分别提取12组样品,得率为0.16%。取1.0 μL干燥后的挥发油用无水乙醚稀释后进行GC-MS分析,同时取部分挥发油稀释至不同浓度后测定其抗氧化和抑菌活性,并将余下的挥发油密封后4 °C保存。
1.2.2 挥发油GC-MS分析
GC分析条件:色谱柱为HP-5 MS 石英毛细管柱(30 m × 250 μm × 0.25 μm);高纯氦气(99.999 %)为载气,载气流速为1.0 mL /min,进样量为 0.5 μL,进样口温度为 290 °C;柱箱采用程序升温,起始温度50 °C,以2.5 °C /min升至170 °C保持3 min,再以6 °C /min 升至 285 °C保持10 min,运行时间为 83 min。
MS分析条件:电子轰击(EI)离子源,离子源温度为 230 °C,四极杆温度为150 °C,电子能量为70 eV;溶剂延迟 3.0 min,质量数扫描范围m/z为50.0~500.0,选择谱库NIST08为质谱数据库。
1.2.3 挥发油对DPPH自由基清除能力的测定
对DPPH自由基清除能力的测定,参照文献[5]并适当进行了修改。取经丙酮稀释至不同浓度的红豆树叶挥发油100 μL,分别加到4 mL 0.06 mmol /L DPPH-乙醇(95%)溶液的溶液中,配制成浓度分别为0.00、0.07、0.14、0.21、0.28、0.35 mg /mL,混匀并避光反应20 min,于波长517 nm 处测定吸光值(Ax) 。以加入100 μL丙酮的DPPH乙醇溶液为对照组,测定对照组吸光值(A0) 。以Vc为阳性对照,每样重复 3 次,取平均值,并按公式(1)计算DPPH自由的清除率。
清除率(%)=(1-Ax/A0)× 100%
(1)
1.2.4 挥发油对ABTS自由基清除能力的测定
对ABTS自由基清除能力的测定,参照文献[6]方法并适当进行了修改。按体积比1∶1取2.45 mmol /L过硫酸钾与7 mmol /L ABTS溶液混合均匀并于暗处反应12 h。用甲醇将反应后的ABTS溶液稀释为734 nm处吸光值0.68~0.72。分别取不同浓度的红豆树叶挥发油200 μL加入2 mL ABTS溶液,配制成浓度分别为0.00、0.13、0.26、0.39、0.52、0.65 mg /mL的溶液,混匀后反应6 min,并测量其吸光值(Ax)。测量200 μL甲醇与2 mL ABTS溶液混合后的吸光值(A0) 。测量200 μL不同浓度挥发油样品与2 mL甲醇溶液的吸光值(Ay)。按公式(2)计算清除率。
清除率(%)=[(A0-Ax+Ay) /A0]× 100%
(2)
1.2.5 挥发油抑菌活性的测定
抑菌活性的测定,参考文献[4]的方法,并适当修改。用新制备的 LB(Luria-Bertani)液体培养基分别将活化后的大肠杆菌、金黄色葡萄球菌、绿脓杆菌和枯草芽孢杆菌培养至600 nm处吸光值(OD600)为0.2~0.3,分别吸取100 μL菌液涂布于新制备的LB平板培养基上,并贴上无菌滤纸片(直径 6 mm)。移取10 μL挥发油分别滴加于无菌滤纸片中央,并以丙酮为空白对照、对羟基苯甲酸丙酯(propylparaben,PP)为阳性对照。将此LB平板培养基于37 °C培养12~14 h,测量抑菌圈直径的大小并记录,实验结果重复3次,取平均值。
2 结果与分析
2.1 红豆树叶挥发油化学成分的分析
2.1.1 红豆树叶挥发油的化学成分分析
利用GC-MS对红豆树叶挥发油成分进行分析,通过对谱库NIST08检索、质谱分析确定挥发油的化学成分,并采用峰面积归一化法计算各组分的相对含量,其总离子流结果如图1,离子流结果具体分析结果见表1。由图1和表1结果知,从红豆树叶挥发油中共分离出77个色谱峰,鉴定出36个化合物,占挥发油总量的90.50%。已鉴定出的36个化合物包含烯、醇、烷、醛、酮、酯等,其中含量高于2.00%的化合物有1,4-二十烷二烯(25.72%)、1,19-二十烷二烯(10.85%)、2,6-二叔丁基对甲酚(10.14%)、邻苯二甲酸正丁基异丁基酯(9.75%)、(Z,Z)-6,9-二十烷二烯(7.60%)、(E,E)-α-金合欢烯(7.51%)、叶醇(4.74%)和2-异丙烯基-5-甲基-6-庚烯-1-醇(4.04%),这8种成分占挥发油总量的80.35%。

图1 红豆树叶挥发油总离子流图Fig.1 The total ion chromatogram of the volatile oil from O.hosiei Hemsl.Et Wils.leaves

表1 红豆树叶挥发油的化学成分分析
续表1(Continued Tab.1)
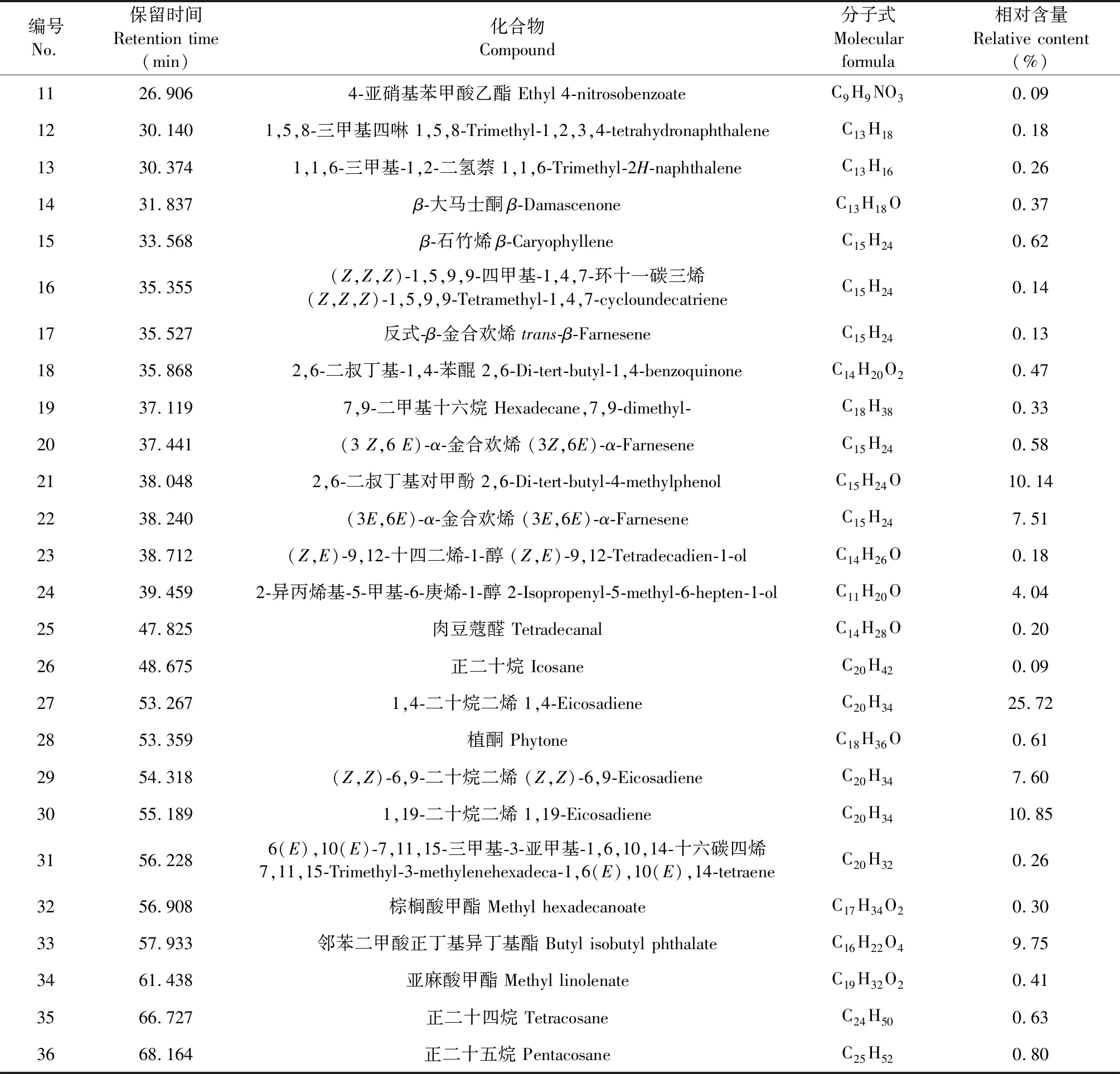
编号No.保留时间Retention time (min)化合物Compound分子式Molecular formula相对含量Relative content(%)1126.9064-亚硝基苯甲酸乙酯 Ethyl 4-nitrosobenzoateC9H9NO30.091230.1401,5,8-三甲基四啉 1,5,8-Trimethyl-1,2,3,4-tetrahydronaphthaleneC13H180.181330.3741,1,6-三甲基-1,2-二氢萘 1,1,6-Trimethyl-2H-naphthaleneC13H160.261431.837β-大马士酮β-DamascenoneC13H18O0.371533.568β-石竹烯β-CaryophylleneC15H240.621635.355(Z,Z,Z)-1,5,9,9-四甲基-1,4,7-环十一碳三烯 (Z,Z,Z)-1,5,9,9-Tetramethyl-1,4,7-cycloundecatrieneC15H240.141735.527反式-β-金合欢烯 trans-β-FarneseneC15H240.131835.8682,6-二叔丁基-1,4-苯醌 2,6-Di-tert-butyl-1,4-benzoquinoneC14H20O20.471937.1197,9-二甲基十六烷 Hexadecane,7,9-dimethyl-C18H380.332037.441(3 Z,6 E)-α-金合欢烯 (3Z,6E)-α-FarneseneC15H240.582138.0482,6-二叔丁基对甲酚 2,6-Di-tert-butyl-4-methylphenolC15H24O10.142238.240(3E,6E)-α-金合欢烯 (3E,6E)-α-FarneseneC15H247.512338.712 (Z,E)-9,12-十四二烯-1-醇 (Z,E)-9,12-Tetradecadien-1-olC14H26O0.182439.4592-异丙烯基-5-甲基-6-庚烯-1-醇 2-Isopropenyl-5-methyl-6-hepten-1-olC11H20O4.042547.825肉豆蔻醛 TetradecanalC14H28O0.202648.675正二十烷 IcosaneC20H420.092753.2671,4-二十烷二烯 1,4-EicosadieneC20H3425.722853.359植酮 PhytoneC18H36O0.612954.318(Z,Z)-6,9-二十烷二烯 (Z,Z)-6,9-EicosadieneC20H347.603055.1891,19-二十烷二烯 1,19-EicosadieneC20H3410.853156.2286(E),10(E)-7,11,15-三甲基-3-亚甲基-1,6,10,14-十六碳四烯7,11,15-Trimethyl-3-methylenehexadeca-1,6(E),10(E),14-tetraeneC20H320.263256.908棕榈酸甲酯 Methyl hexadecanoateC17H34O20.303357.933邻苯二甲酸正丁基异丁基酯 Butyl isobutyl phthalateC16H22O49.753461.438亚麻酸甲酯 Methyl linolenateC19H32O20.413566.727正二十四烷 TetracosaneC24H500.633668.164正二十五烷 Pentacosane C25H520.80
2.1.2 红豆树叶挥发油化学成分的类型
红豆树叶挥发油提取物所鉴定出的7类化合物的数目和相对含量见图2。从图2结果可知,红豆树叶挥发油中烯烃类,共13种,其相对含量高达58.68%;其次为醌、酚、萘类等(6种,11.42%)、酯类(4种,10.55%)、醇类(2种,5.75%)、烷烃类(5种,2.04%)、酮类(3种,1.10%)以及醛类(3种,0.96%)。
2.2 红豆树叶挥发油的抗氧化作用
2.2.1 红豆树叶挥发油对DPPH自由基的清除作用
测定红豆树叶挥发油对DPPH自由基的清除作用,结果见图3。从图3结果可知,红豆树叶挥发油对DPPH自由基有清除作用;当挥发油浓度为0.35 mg/mL时,其对DPPH自由基清除率为55.78% ± 0.35%;挥发油浓度与清除率间呈正相关,随着挥发油浓度的逐步增大,DPPH清除率逐渐增大。挥发油浓度(X)与清除率(Y)的回归方程为:Y=171.71X+3.611 (R2=0.928 5)。VC浓度(X)与清除率(Y)的回归方程为:Y=93 848X+3.303 4 (R2=0.988 6)。红豆树叶挥发油和VC对DPPH自由基清除作用的ED50值分别为0.27 mg/mL和0.000 5 mg/mL。
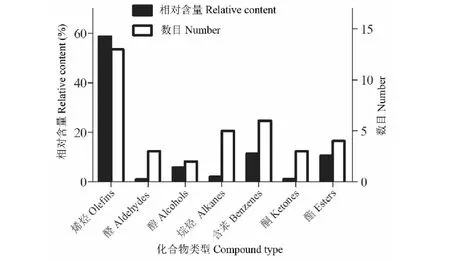
图2 红豆树叶挥发油化学成分的类型Fig.2 Compounds type of the volatile oil from O.hosiei Hemsl.Et Wils.leaves
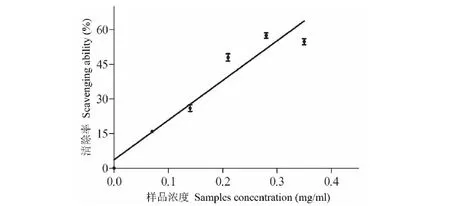
图3 红豆树叶挥发油对DPPH自由基的清除作用Fig.3 Free radical scavenging assays of the volatile oil from O.hosiei Hemsl.Et Wils.leaves against DPPH
2.2.2 红豆树叶挥发油对ABTS自由基的清除作用
测定红豆树叶挥发油对ABTS自由基的清除率,结果如图4。从图4结果可知,红豆树叶挥发油对ABTS自由基有清除能力;随着红豆树叶挥发油浓度的增加,其对ABTS自由基的清除能力逐步增强,但是增幅逐渐减弱。这说明红豆树叶挥发油浓度与清除作用间不仅存在剂量关系,且存在浓度饱和效应。鉴于挥发油浓度与ABTS自由基清除率间非线性关系,故采用GraphPad Prism 5.0软件进行量-效曲线[7]拟合,并计算ED50。而Vc浓度(X)与ABTS自由基清除率(Y)间呈线性关系,其回归方程为:Y=20 712X+1.892 4 (R2=0.964 7)。红豆树叶挥发油和Vc对ABTS自由基清除作用的ED50值分别为0.14 mg/mL和0.002 mg/mL。
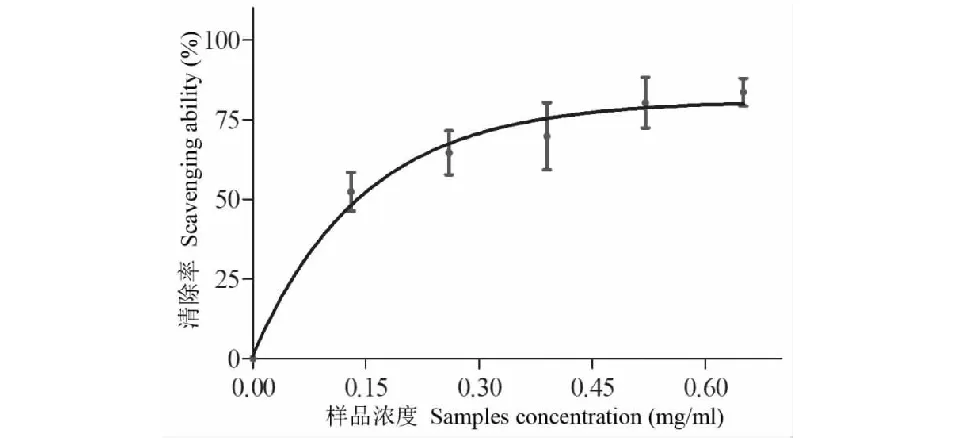
图4 红豆树叶挥发油对ABTS自由基的清除作用Fig.4 Free radical scavenging assays of the volatile oil from O.hosiei Hemsl.Et Wils.leaves against ABTS
2.3 红豆树叶挥发油的抑菌作用
本文检测了红豆树叶挥发油对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌及绿脓杆菌的抑菌活性,结果见图5。从图5结果可以发现,红豆树叶挥发油(the volatile oil)对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌及绿脓杆菌均具有一定的抑菌效果。当红豆树叶挥发油浓度为7.1 mg/mL时,其对金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌及绿脓杆菌的抑菌圈分别为11.29、9.88、10.85、11.03 mm。而作为阳性对照的对羟基苯甲酸丙酯(PP,浓度为1.0 mg/mL)的抑菌圈分别为8.18、10.85、9.78、11.58 mm。红豆树叶挥发油对革兰氏阳性和革兰氏阴性菌均具有一定的抑制效果,且在相同浓度下抑制强度为:金黄色葡萄球菌>绿脓杆菌>大肠杆菌>枯草芽孢杆菌。
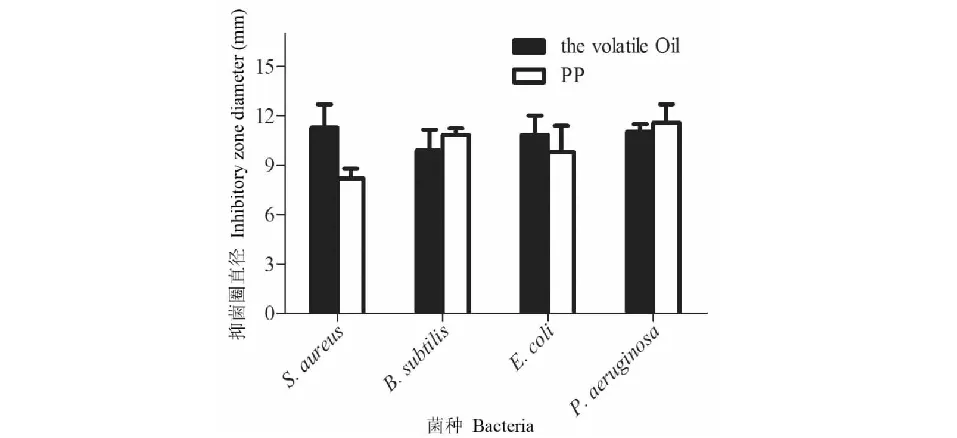
图5 红豆树叶挥发油对不同受试菌的抑菌活性Fig.5 Antibacterial activity of the volatile oil from O.hosiei Hemsl.et Wils.leaves against the tested bacteria注:抑菌实验菌株为金黄色葡萄球菌、枯草芽孢杆菌、大肠杆菌和绿脓杆菌。Note:The tested bacteria contain S.aureus,B.subtilis,E.coli and P.aeruginosa.
3 结论
文章首次报道红豆树挥发油化学成分,并对其抗氧化和抑菌活性进行分析。本研究采用水蒸气蒸馏法提取红豆树叶片的挥发油,通过GC-MS共鉴定出36个化合物,占挥发油总量的90.50%。红豆树叶挥发油化学成分以烯、酯、醇以及含苯环类化合物为主,醛、酮和烷烃类化合物含量相对较少。
红豆树叶挥发油具有较强的DPPH和ABTS自由基清除能力,且其抗氧化能力与挥发油浓度呈量效相关,这可能与挥发油中含有较高的抗氧化物质如2,6-二叔丁基对甲酚等相关。此外,红豆树叶挥发油对革兰氏阳性(如金黄色葡萄球菌)和阴性菌(如大肠杆菌)均具有明显的抑菌效果,但具体是哪种或哪些化合物发挥主要作用则需要进一步的研究,以便筛选更加有效的活性分子。因此,本研究结果可为红豆树资源的综合开发利用提供数据支持。

