短角湿生冷水花化学成分的研究
周鹏军,杨国勋,张梦甜,屠 娇,温宝莹,丁 杰*,胡金锋*
1四川轻化工大学化学工程学院,自贡643000;2复旦大学药学院天然药物化学教研室,上海201203
荨麻科(Urticaceae)冷水花属(Pilea)植物全球共有六百多种,其中中国境内大约分布90多种[1]。部分冷水花属植物有一定药用价值,可以清热、解毒、利湿等,如波缘冷水花(P.cavaleriei)、西南冷水花(P.plataniflora)、冷水花(P.notata)和粗齿冷水花(P.fasciata)[2]。目前国内外对该属植物的化学成分研究主要集中在波缘冷水花等为数不多的几种植物,所报道的化合物类型包括倍半萜[3,4],木脂素[5]和三萜类化合物[6,7],其中一些化合物显示抗菌和细胞毒等作用[3]。短角湿生冷水花P.aquarumsubsp.brevicornuta(Hayata)C.J.Chen是一种多年生草本植物,分布于我国福建、广东、贵州和云南等南方地区。到目前为止,短角湿生冷水花的化学成分还没有文献报道。近几年来,我们开始关注并探索天然产物中潜在抗炎活性成分的发现[8,9]。作为该研究工作的一部分,我们对短角湿生冷水花的化学成分进行了研究。经硅胶、微孔树脂(MCI)、葡聚糖凝胶(Sephadex LH-20)以及半制备HPLC等多种色谱方法从中共分离、鉴定了五个五环三萜类化合物:pilearbornol(1),rubiarbonone D(2),camarolide(3),表齐墩果酸(4),齐墩果酮酸(5);一个甾醇类化合物:5,8-epidioxy-(3β,5α,8α,22E)-ergosta-6,9(11),22-trien-3-ol(6)和一个木脂素:桉脂素(7)。其中,化合物1和2均为乔木萜烷型三萜,且化合物1为新化合物。化合物2的绝对构型首次通过X-射线单晶衍射得到了确定。结合生源关系,通过与化合物2的比较对化合物1的绝对构型也进行了合理推定。经查阅文献后发现,这是第一次从荨麻科植物中发现乔木萜烷型的三萜。

图1 化合物1和2的结构式Fig.1 Chemical structures of compounds 1 and 2
1 仪器与材料
核磁共振仪:Varian Mercury Plus 400 MHz和Bruker Avance III 600 MHz;MCI(75~150μm)为日本三菱公司产品;Sephadex LH-20为瑞士GE Healthcare公司产品;UV光谱和IR光谱数据分别由Hitachi U-2900E紫外光谱仪和Thermo Scientific Nicolet iS 5 FTIR型红外光谱仪获得;Rudolf Autopol Ⅳ旋光仪;ESI-MS数据由Agilent 1100 series仪器获得;HR-ESIMS采集于AB Sciex Triple TOFTM5600高分辨质谱仪;X-射线单晶衍射采集于Bruker D8 Venture;半制备高效液相色谱HPLC为Waters e2695,配备2998 PDA检测器;半制备色谱柱为Waters Sunfire ODS(5μm,250×10 mm);SGW X-4显微熔点仪为上海精密科学仪器有限公司;硅胶(100-200目,200~300目)为青岛海洋化工有限公司产品;分析纯石油醚(PE)、乙酸乙酯(EtOAc)、甲醇(MeOH)和正丁醇(n-BuOH)等为国药集团化学试剂化学有限公司产品,色谱级甲醇为上海星可高纯溶剂有限公司产品。
短角湿生冷水花全草2015年4月采集于贵州省贵阳市清镇市九龙山,并由李振元教授鉴定,凭证标本(No:20150412)保存于复旦大学药学院天然药物化学教研室。
2 实验方法
晾干粉碎后的短角湿生冷水花全草(3.0 kg)用75%EtOH在室温下浸提六次(每次24小时、5.0 L溶剂)。合并提取液,减压浓缩后得到的总浸膏(630.0 g)均匀分散在1.0 L水中,依次用石油醚(1.0 L×3)、乙酸乙酯(1.0 L×4)和正丁醇(1.0 L×3)萃取。将石油醚浸膏(113.0 g)进行硅胶柱(100~200目)色谱分离,用PE-EtOAc(150×800 mm,15∶1~0∶1,v/v)进行梯度洗脱共得到五个组分(Fr.1~Fr.5)。对Fr.2(1.4 g)进行MCI柱色谱(35×500 mm,MeOH∶H2O,7∶3~1∶0,v/v)层析并得到八个组分(Fr.2A~Fr.2H)。Fr.2C(312.0 mg)经Sephadex LH-20柱层析(35×1 200 mm,MeOH)层析后经硅胶(200~300目)柱层析(20×300 mm,PE∶EtOAc,8∶1,v/v)纯化得到化合物6(1.1 mg)。将Fr.2D(903.0 mg)再一次经Sephadex LH-20柱层析(35×1 200 mm,MeOH)分离得到化合物4(500.0 mg)。组分Fr.4(6.8 g)经MCI柱色谱(35×500 mm,MeOH∶H2O,7∶3~1∶0,v/v)层析后由Sephadex LH-20柱层析(35×1 200 mm,MeOH)分离得到化合物5(300.0 mg)。Fr.3(5.5 g)经MCI柱色谱(35×500 mm,MeOH∶H2O,7∶3~1∶0,v/v)层析得到八个亚组分(Fr.3A~Fr.3H),对组分Fr.3D(33.0 mg)进行Sephadex LH-20(20×1 200 mm,MeOH)柱层析后进一步通过半制备高效液相色谱纯化得到化合物3(1.5 mg,MeOH∶H2O,75∶25,tR=15.0 min,3 mL/min)。Fr.5(7.5 g)经MCI梯度(35×500 mm,MeOH∶H2O,7∶3~1∶0,v/v)柱层析同样得到八个亚组分(Fr.5A~Fr.5H),Fr.5B(301.0mg)经Sephadex LH-20(35×1 200 mm,MeOH)凝胶层析和硅胶柱层析(200~300目,20×300 mm,PE∶EtOAc,8∶1,v/v)后进一步用半制备高效液相色谱对它们进行纯化,分别得到化合物2(8.5 mg,MeOH∶H2O,78∶22,tR=13.8 min,3 mL/min)和1(1.1 mg,MeOH∶H2O,80∶20,tR=13.3 min,3 mL/min)。Fr.5H(14.0 mg)经Sephadex LH-20(20×1 200 mm,MeOH)柱层析后进一步通过半制备高效液相色谱纯化得到化合物7(4.0 mg,MeOH∶H2O,20∶80,tR=13.7 min,3 mL/min)。
3 实验结果

化合物2为白色针状晶体(甲醇);ESI-MSm/z457 [M+H]+,479 [M+Na]+,935 [2M+Na]+;其1H-,13C NMR以及ESI-MS都表明该化合物为rubiarbonone D[11]。然而,我们测得化合物2比旋光为+ 9.2(c0.03,CHCl3),与rubiarbonone D( +94.4(c0.03,CHCl3))相差较大,因此我们猜测化合物2为一对对映体。最后,我们得到化合物2的X射线(Ga Kα,λ=1.341 39)单晶衍射(Flack parameter,-0.029(8))数据(图2),证明了化合物2就是rubiarbonone D,并且确定该化合物的绝对构型为5R,7S,8S,10S,13R,14S,17S,18S,19R,21S。化合物1和2是来源于同一植物中具有相似分子骨架的化学成分,非常有可能有相同的生物合成途径。除此以外,即便从不同属植物得到的乔木萜烷型三萜,如从茜草科(Rubiaceae)紫参(RubiayunnanensisDiels)[12]中分离得到rubianols A-E以及从棕榈科(Palmae)槟榔(ArecacatechuL.)[13]中分离得到的乔木萜烷三帖,在C-5,C-8,C-10,C-13,C-14,C-17和C-21都有相同手性碳。因此,化合物1和2在相同手性碳位置非常可能具有相同绝对构型。最终,我们将化合物1的绝对构型确定为3S,5R,7S,8S,10S,13R,14S,17S,21S。
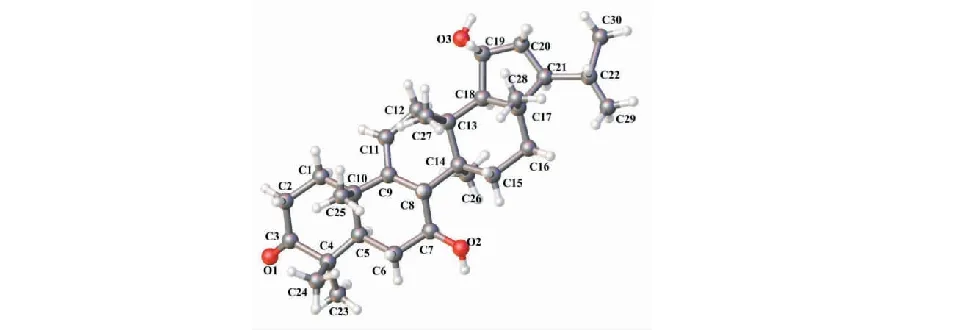
图2 化合物2的椭球图Fig.2 ORTEP drawing of compound 2


图3 化合物1的关键COSY,HMBC和ROESY相关Fig.3 Key COSY,HMBC and ROESYcorrelations of compound 1

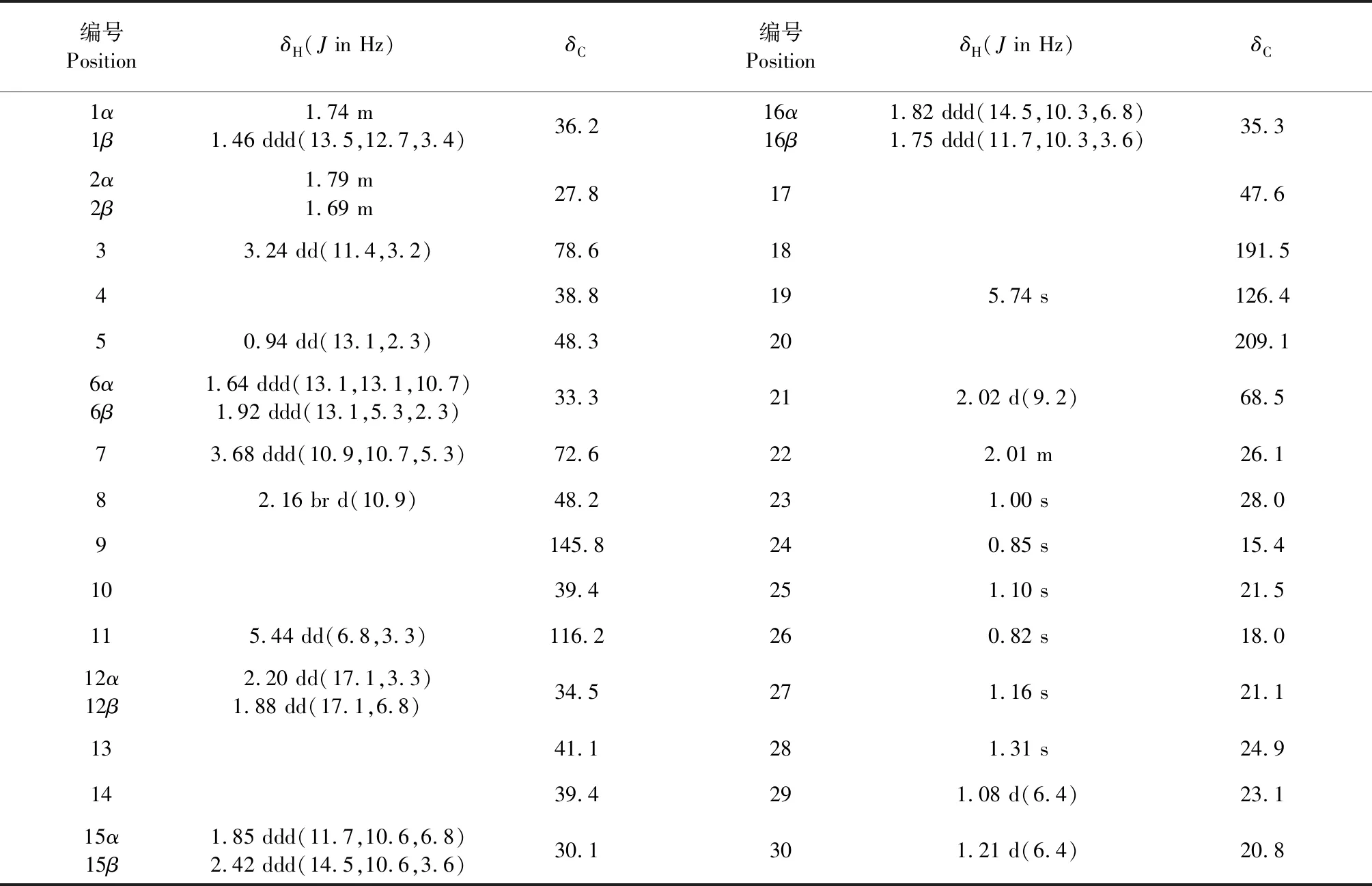
表1 化合物1的核磁数据
注:1H和13C数据分别于600 MHz和150 MHz核磁条件下于CDCl3中测得。
Note:Data were measured in CDCl3at 600 MHz for1H and at 150 MHz for13C.





以上化合物的详细结构鉴定数据原始图谱可从本刊官网免费下载(www.trcw.ac.cn)。
4 结论
本研究首次对短角湿生冷水花的化学成分进行了研究,从中分离并鉴定了七个化合物。其中,化合物1和2为乔木萜烷型三萜化合物。乔木萜烷型和羊齿烷型三萜都属于hopane型三萜,这类三萜化合物被认为是许多原核生物的必须成分,广泛存在于地质沉积物中[18]。在植物界,目前仅在茜草科(Rubiaceae)[11,12]、禾本科(Poaceae)[19]以及石竹科(Caryophyllaceae)[20]等少数科属植物中被发现,本文为首次报导荨麻科植物中分离得到乔木萜烷型三萜化合物。

