动物源活性蛋白多肽的分离纯化方法研究进展
付文鹏,杨永寿,肖培云*
1大理大学药学与化学学院;2云南省昆虫生物医药研发重点实验室,大理 671000
蛋白质是生命活动的物质基础,在生物体内发挥着重要作用。多肽是一类具有蛋白质特性、分子量比蛋白质小、由2~16个氨基酸通过肽键连接的化合物[1]。它涉及生物体内各种细胞功能的调节,是蛋白质水解产物,人体摄入的蛋白质经酶水解后,主要以肽的形式被消化吸收。科研工作者研究发现,多肽具有抗凝血、抗肿瘤、抗菌、抗氧化、增强免疫力、降血压等作用[1]。蛋白多肽类药物在预防和治疗疾病中具有用药剂量小、疗效好、毒副作用低等突出优点[2],因此具有较大的研究开发价值。目前研究比较热门的美洲大蠊、地龙、蜈蚣、鹿茸等动物类中药的有效成分均以蛋白多肽为主。研究发现,美洲大蠊中环二肽类化合物是发挥创面愈合的重要成分之一[3],我国重要的中药动物药地龙和鹿茸的主要有效成分都是蛋白质和多肽[4,5],蜈蚣毒素有大量分子量在 3~10 KDa的多肽分子[6]。而蛋白多肽的分离纯化是其研究与开发过程中的重要环节。蛋白多肽属于大分子物质,在分离纯化过程中既要保持其组成成分、结构性质和生物活性均不变,还要保证其安全性和高回收率,以达到经济环保的目的。因此,诸多因素限制了传统的植化分离方法在动物源蛋白多肽分离纯化中的应用,严重阻碍了对其的研究与开发。本文对近年来动物源活性蛋白多肽分离纯化方法的研究进展进行综述,以期为动物药的研究开发提供思路和参考。
1 沉淀法
1.1 盐析沉淀
中性盐对蛋白多肽的溶解度有显著影响,一般随着盐浓度的升高,蛋白多肽的溶解度也会增加,当盐浓度继续升高时,其溶解度不同程度下降并先后析出的过程称为盐析。分子大小、亲水程度不同的蛋白多肽,盐析时所需的盐浓度不同,因此调节混合蛋白多肽溶液中的中性盐浓度可使各种蛋白多肽分段沉淀,再通过透析除去盐,达到分离的目的。
蛋白多肽盐析常用的中性盐,主要有硫酸铵、硫酸镁、硫酸钠、氯化钠等。因为硫酸铵具有温度系数小而溶解度大以及不易引起蛋白质变性的优点[7],其在蛋白多肽的盐析中应用最多。冼永权等[8]在黑蚂蚁纤溶活性蛋白的分离纯化中,用硫酸铵逐级盐析黑蚂蚁浸提液,确定其最佳硫酸铵盐析浓度为30%~90%。周爱梅等[9]用盐析-柱层析结合法分离纯化重组人源胶原蛋白,通过40%饱和度的硫酸铵沉淀与Sephadex G100凝胶柱纯化后获得二聚体,其达到了电泳纯。Mariam等[10]用硫酸铵沉淀法纯化兔多克隆免疫球蛋白G(IgG),用40%饱和度的硫酸铵沉淀时,回收的多克隆IgG浓度最高(7.8mg/mL),除白蛋白效果最好(除去72%的白蛋白)。
1.2 等电点沉淀
等电点沉淀是利用蛋白多肽在等电点时溶解度最小,而各种蛋白多肽的等电点有差别,通过调节溶液的pH达到某一蛋白多肽的等电点使之沉淀的方法。梁姗姗等[11]采用等电点絮凝法对虾夷扇贝外套膜蛋白质进行分离回收,不仅分离的蛋白质纯度高,还有明显的脱脂及脱色效果。Geng等[12]用聚乙二醇(PEG)沉淀法将鸡蛋清中的卵清蛋白(OVA)与卵粘蛋白、卵转铁蛋白和卵类粘蛋白分离,富含OVA的上清液再用等电点沉淀(pI为4.5和温度为4 ℃)进一步纯化,HPLC检测OVA的纯度为95.1%,产率为46.4%。
1.3 低温有机溶剂沉淀
低温有机溶剂沉淀是通过加入与水可混溶的甲醇、乙醇或丙酮等中性有机溶剂,降低电解质的介电常数和破坏了蛋白多肽的胶体性,使多数蛋白多肽的溶解度降低并析出的方法。用不同浓度的有机溶剂并结合调节pH和离子强度可以分段沉淀不同的蛋白质[13]。马建[14]采用有机溶剂沉淀法对还原型谷胱甘肽抽提液进行了初步分离提纯,确定了最佳工艺为:有机溶剂选用乙醇,乙醇与样品的体积比为5,pH的适宜范围为3.0~3.4,温度为5 ℃。
2 色谱法
2.1 反相高效液相色谱
反相色谱(Reversed phase chromatography, RPC)是用极性大于固定相的有机溶剂(如甲醇、异丙醇、乙腈等)水溶液为流动相,进行物质分离和分析的一种色谱方法。用于分离蛋白多肽的反相色谱固定相使用最广是C8或C4配基的填料;应用最广的流动相是水-甲醇、水-乙腈和水-异丙醇。为使样品组分有较好的溶解性,通常流动相pH在2~4之间,并且低pH抑制了样品组分中酸性基团及硅胶上硅羟基的解离及非特异性吸附作用[15]。此外,有研究发现,向流动相中添加10%~16%三氟乙醇(TFE)能显着改善肽的色谱分离[16]。Ghassem等[17]应用反相高效液相色谱将鲤鱼肌原纤维蛋白具有ACE抑制活性最高的组分F2分成五个组分(A~E),并结合ESI-TOF MS / MS进行氨基酸序列分析,得知这些肽具有高ACE抑制活性的原因是在C-末端序列处存在两个脯氨酸残基。Basseri等[18]用高效液相色谱从美洲大蠊免疫诱导的血淋巴中分离到分子量62 KDa的抗菌肽。Ennaas等[19]用反相高效液相色谱从大鲭鱼的副产物protamex水解产物中分离得到四种抗菌肽。
2.2 凝胶排阻色谱
凝胶排阻色谱(gel exclusion chromatography)又叫凝胶色谱、分子筛色谱、凝胶过滤等,其分离机理是根据溶质分子大小进行过筛,溶液中所有组分按分子尺寸由大到小的顺序流出 ,达到分离的目的。它既适用于分子量较低的多肽、聚核苷酸等生物分子的分离,也适用于蛋白质、多糖等大分子物质的纯化。凝胶色谱主要有Sephadex G系列、Superose系列、硅胶系列、Bio-Gel Px系列等。Wang等[20]将鲨鱼皮水解产物通过SP-Sephadex C-25柱,Sephadex G-50柱和C18反相高效液相色谱分离,得到一个分子量为906Da的亲水性三肽,氨基酸序列是GAIGPAGPLGP。宋雪梅[21]通过Sephadex G-25凝胶色谱对牛乳硬质干酪中的苦味肽进行分离,得到3个组分,经鉴定组分Ⅱ中存在14种苦味肽。Jiang等[22]通过Sephadex G-50凝胶色谱,用75%乙醇洗脱,从乳清蛋白的胰蛋白酶水解物中分离出分子量范围为1.9 KDa~3.1 KDa降胆固醇肽。
2.3 离子交换色谱
离子交换色谱(ion exchange chromatography,IEC)是利用离子交换树脂对各种离子的亲和力不同,从而使能离子化的化合物得到分离的方法。目前在蛋白质或多肽的分离纯化中,离子交换色谱是应用最广泛的方法之一,占75%[15]。离子交换色谱主要分为阳离子交换柱和阴离子交换柱两大类型,根据蛋白或多肽所带电荷的差异并尽量保持其活性选择柱型。影响离子交换的因素有pH值、温度、洗脱剂、离子强度等。在离子交换色谱纯化多肽的试验中,柱填料的选择对于分离效果影响很大,查恩辉[23]比较了不同柱填料对梅花鹿茸多肽的分离效果,其中CM-Sepharose Fast Flow离子交换柱与Q-Sepharose Fast Flow离子交换柱,分离速度较快,柱料再生较为简単,只需用3个柱床体积的高浓度盐溶液冲洗即可。Geng等[24]用聚乙二醇沉淀鸡蛋清,将其分成四个组分(A~D),除卵霉素(沉淀物A)外,其他三个组分都通过Q Sepharose Fast Flow阴离子交换层析进一步纯化。分别从沉淀物B、沉淀物C和上清液D中纯化得到溶菌酶、卵转铁蛋白、卵清蛋白和卵黄蛋白,HPLC测定纯度分别为91.84%、94.55%、96.45%和88.16%。Wang等[25]通过DEAE Sepharose Fast Flow离子交换柱纯化兔和豚鼠血清中的免疫球蛋白G,用Tris-HCl缓冲液作为洗脱剂,考察了pH7.0和pH8.5的Tris-HCl缓冲液对免疫球蛋白G回收率和纯度的影响,发现pH8.5的Tris-HCl缓冲液较好。
2.4 亲和色谱
亲和色谱(affinity chromatography)是利用生物分子间专一的亲和力进行分离的一种色谱技术。蛋白多肽等生物大分子能和某些相对应的分子专一而可逆地结合,可以用于对生物分子的分离纯化。由于亲和力具有高度的专一性,使得亲和色谱分辨率很高,是分离生物大分子的一种理想色谱方法。按照特异亲和作用分为抗原-抗体、酶-底物、凝集素-多糖、寡核苷酸与其互补链等[26],对多肽类物质分离目前主要应用其单抗或生物模拟配基与其亲和。Xin等[27]用亲和色谱分离牛肺抑肽酶,通过SDS-PAGE电泳分析和凝胶过滤层析表明该蛋白为单一多肽,纯度分别约为97%和100%。Lan等[28]利用磁性亲和分离法快速纯化和表征蜥蜴鱼蛋白水解物中的血管紧张素转换酶(ACE)抑制肽,并通过反相高效液相色谱进一步纯化,得到活性最高的ACE抑制肽,其氨基酸序列为Gly-Met-Lys-Cys-Ala-Phe。
3 膜分离
膜分离技术(membrane separation technique)是借助一定孔径的高分子薄膜,通过在膜两侧施加一个推动力,将不同大小、性状和特性的物质分离的技术。根据驱动方式和分离原理,膜分离可分为微滤、超滤、反渗透、电渗析等。微滤能截留直径0.2~2 μm的颗粒,可除去淀粉、细菌、霉菌、乳化油等杂质;超滤截留直径0.02~0.22 μm的颗粒,相当于分子量1000~5×105Da,可滤出蛋白质、脂肪、色素等物质;反渗透膜孔径小至纳米级,在一定压力下,水分子可以通过反渗透膜,而水中的无机盐、重金属离子、有机物、胶体、细菌、病毒等无法通过反渗透膜;电渗析主要用于水溶液中除去电解质、电解质与非电解质的分离和膜电解等[7]。
李水清等[29]在鳖甲多肽的膜分离工艺的研究中,先采用0.3 μm微滤膜预处理鳖甲多肽提取液,再依次通过截留相对分子质量20 KDa和8 KDa的超滤膜,经过多级超滤,鳖甲多肽的分离效果较为理想。Lin等[30]采用截留相对分子质量为5 KDa和1 KDa的超滤膜对蛤蜊肌肉水解产物进行分离,得到两种氨基酸序列为Val-Lys-Pro和Val-Lys-Lys的降胆固醇肽。Zhang等[31]用截留相对分子质量为10 KDa,5 KDa和3 KDa的超滤膜对大黄鱼蛋白水解产物进行分级处理,获得抗氧化活性最高的组分后再用其他分离手段进一步纯化,得到两种抗氧化肽,其氨基酸序列为Ser-Arg-Cys-His-Val和Pro-Glu-His-Trp。
4 电泳法
电泳(phoresis)是带电颗粒在电场作用下,向着与其电性相反的电极移动的现象。1809年俄国的物理学家Pence首先发现了电泳现象,直到1937年瑞典科学家Tiselius设计出世界上第一台自由电泳仪,才作为一种分析方法不断发展和应用。根据电泳的分离特点,电泳法分为自由界面电泳、区带电泳、高效毛细管电泳。其中,区带电泳是目前应用最广泛的电泳技术。在蛋白多肽的分析研究中,应用最广泛的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)就是属于区带电泳。用SDS-PAGE既能测定蛋白多肽的分子质量,又可以用于蛋白多肽混合组分的分离和亚组分的分析。
目前,电泳法主要应用在测定蛋白多肽的分子质量。苏翔等[32]用SDS-PAGE对蚂蚁抗菌肽进行相对分子质量测定,SDS-PAGE电泳结果为单一条带,其分子质量为3.746 KDa。Cheema等[33]用琼脂糖凝胶亲和层析从杂交公牛的精浆中纯化得到肝素结合蛋白,通过SDS-PAGE分析鉴定出14个条带,分子量范围为14~150 KDa。但是SDS-PAGE对于小分子量尤其是10 KDa以下的蛋白质分辨率较低,在分离胶中添加甘油或尿素的Tricine-SDS-PAGE能检测小分子多肽的分子量,该方法能够消除由于多肽分子与标准蛋白质空间构象的不同带来的误差[34]。高世杰等[35]用SDS-PAGE对全蝎蛋白进行分离,所得的结果不理想,仅可获得7条谱带,且条带分辨率低。采用Tricine-SDS-PAGE,利用三层不连续凝胶系统,可以得到11条分辨率较高的电泳谱带,而利用两层不连续系统时则分离效果稍差,只能得到9条较清晰谱带,因此对于小分子量蛋白的分离应尽量使用三层胶系统。SDS-PAGE测定许多高分子量蛋白质(MW﹥100 KDa)时分辨率差,故测定高分子量蛋白质应采用能提高分辨率的脉冲SDS-PAGE电泳[36]。
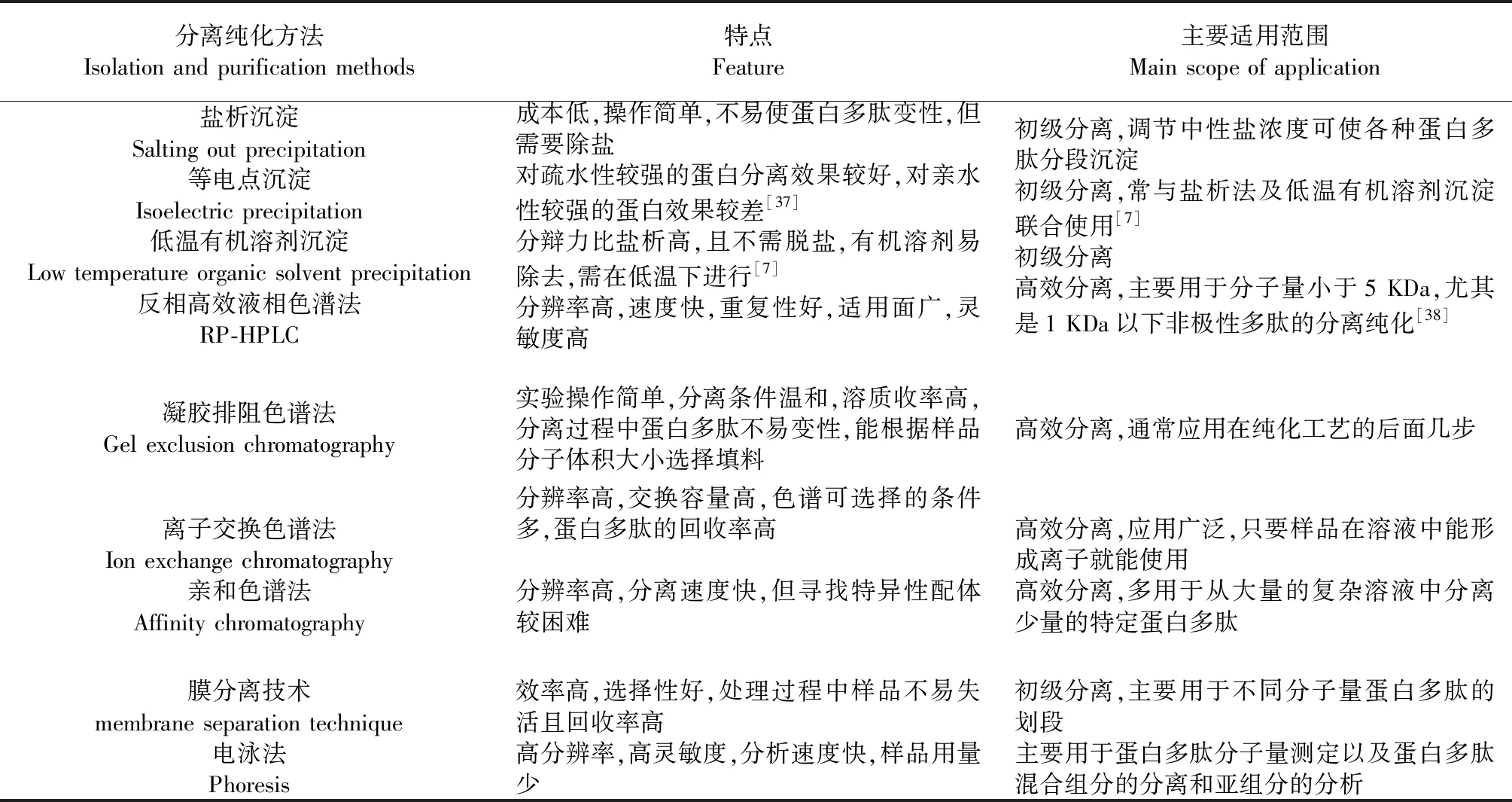
表1 动物源活性蛋白多肽分离纯化方法总结
5 多方法联用
由表1可看出不同方法各有优缺点和所适用的范围,对于动物蛋白多肽的分离纯化,要根据样品的性质来选择合适的方法,而且只用一种方法是很难实现的,大多数都要采用两种或两种以上方法联用。王心龙等[3]采用MCI gel CHP 20P柱、Sephadex LH-20凝胶柱、制备型HPLC和半制备型HPLC等色谱手段,从美洲大蠊中分离出14个环二肽类化合物。Nimalaratne等[39]采用超滤、阳离子交换色谱和反相高效液相色谱从蛋清水解产物中分离纯化到16种抗氧化肽,并用LC-MS/MS测定其氨基酸序列。胡春玲等[40]通过超滤、葡聚糖凝胶Sephadex G-15及高效液相色谱法对鳖甲水解产物进行分离,得到一个纯化的寡肽(CTEPH-1:Asn-Pro-Asn-Pro-Thr)。Matsumoto等[41]对牡蛎消化性水解产物A-3中血管紧张素转换酶抑制肽的分离纯化时,先用SP-Sephadex C-25和Toyopearl HW-40凝胶色谱分离,然后再通过三步高效液相色谱法,分离出血管紧张素转换酶抑制肽。Huang等[42]通过DEAE阴离子交换色谱,Sephadex G-25凝胶过滤和反相高效液相色谱从乳清蛋白水解物中分离钙结合肽,在色谱/电喷雾电离(LC/ESI)串联质谱上鉴定出该纯化肽的分子量为20 402 Da。
6 总结与展望
动物源蛋白多肽类物质,分子量较大,极性较强且容易变解,采用传统的植化分离方法很难得到目标物质,故需结合物质组分的特殊性质来选择合适的分离手段。对于动物蛋白多肽的分离纯化,目前为止没有一种万能的方法,只能根据物质的性质和具体的实验条件来选择适合的分离方法。沉淀分级和膜分离主要用于动物蛋白多肽的初级分离,但是蛋白多肽沉淀分级的条件较难控制;而膜分离技术在分离过程中无相变或化学变化,并且具有高选择性、低能耗、适应性强、操作条件要求不高、环保等优点,对性质相似组分可以达到很好的分离效果[43,44]。色谱法是蛋白多肽分离纯化中的高效分离方法,也是目前动物蛋白多肽分离纯化的主要技术手段,但是不同动物蛋白多肽分离时所需的条件又各不相同,寻找分离条件耗时长,导致效率低;高效液相色谱法具有分离度高、分离能力强及分离速度快等优点,因此在分离动物蛋白多肽时得到广泛应用。电泳主要作为一种分析方法用于测定蛋白多肽的分子质量,而作为制备电泳来分离蛋白多肽混合组分还应用较少。因此,对于大多数动物源活性蛋白多肽的分离纯化,高效、经济、适应性强的多方法联用将会得到更加广泛的应用和发展。
随着科学技术的发展以及国家对中医药发展的重视,动物源活性蛋白多肽的医疗保健价值将会不断被发掘。对于动物源活性蛋白多肽的分离纯化方法也会趋向于更加安全、高效、经济、环保的方向发展。

