基于UPLC-Q-TOF-MS法分析百合珠芽化学成分及其薯蓣皂苷元抗肿瘤活性研究
袁志鹰,罗林明,陈乃宏, , 梁 晟,周小江*,黄惠勇*,陈妍羽
1湖南中医药大学;2湖南省中药饮片标准化与功能工程技术中心,长沙 410208;3中国医学科学院北京协和医学院药物研究所,北京100050;4湖南省药品检验研究院,长沙 410001
百合(Liliibulbus)为多年生草本植物,始载于汉朝《神农本草经》,2015版《中国药典》收录为卷丹(LiliumlancifoliumThunb.)、百合(LiliumbroumiiF.E.Brown var.viridulumBaker)、细叶百合(LiliumpumilumDC.)3个品种[1~2]。百合药用部位主要为鳞茎及其珠芽(百合子),百合鳞茎研究报道较多,而百合珠芽由于研究较少,资源浪费严重。现代研究显示,百合珠芽中含有黄酮类、多酚类和生物碱等多种活性成分,具有抗氧化的生物活性[3]。
目前分析百合鳞茎、珠芽中化学成分的方法主要有高效液相色谱法(HPLC)[4,5]、气相色谱-质谱联用法(GC-MS)[6]、液相色谱-质谱联用法(LC-MS)等方法[7],其中HPLC法操作简便,目前主要用来测定百合鳞茎中酚酸甘油酯、没食子酸等成分。GC-MS法主要用于分析百合鳞茎中挥发性成分,具有一定的局限性。HPLC-Q-TOF-MS法灵敏度高,并且可以用来鉴定复杂基质中的化学成分[8,9],但分析速度一般。UPLC-Q-TOF-MS法具有快速、准确和灵敏度高的特点,成为中药分析领域重要技术手段[10-12]。目前,采用UPLC-Q-TOF-MS法快速分析百合珠芽中化学成分尚未见于报道。近年来,肿瘤已成为中国死亡率最高的疾病之一[13],而薯蓣皂苷属于甾体皂苷,可显著抑制肺癌A549、NCI-H460和NCI-H446细胞增殖,在体外具有较强的抗肺癌作用[14],同时还能明显抑制人胃癌细胞MGC-803、SGC-7901的增殖并诱导其凋亡[15,16]。薯蓣皂苷水解即可得到薯蓣皂苷元,而目前采用CCK8法研究薯蓣皂苷元抗肺肿瘤A549细胞、胃肿瘤HGC-27细胞的药效筛选以及百合珠芽中是否含有薯蓣皂苷尚未见报道,值得我们去探讨。
本试验在前期对百合鳞茎研究的基础上,采用UPLC-Q-TOF-MS联用技术可快速分析鉴定百合珠芽中主要化学成分,并采用CCK-8法进行薯蓣皂苷元肿瘤细胞增殖分析研究,对百合珠芽产品生产、加工和利用具有深层次指导意义。
1 仪器与试药
1.1 仪器
202型电热恒温干燥箱(北京中兴伟业仪器有限公司);Waters ACQUITY UPLC/Xevo G2 QTof/MS(美国Waters 公司);Agilent UPLC 2010(安捷伦科技公司);METTLER TOLEDO ML204电子分析天平(瑞士METTLER TOLEDO公司),KM-250DE台式超声波清洗仪(昆山美美超声仪器有限公司),80-1型电动离心机(城西晓阳电子仪器厂);96孔板(美国corning公司)、CO2培养箱(美国Thermo Fisher Scientific公司)、超净台(苏州安泰空气技术有限公司)、ELx 800酶标仪(美国Bio Tek 公司)。
1.2 药品与试剂
百合珠芽采于湖南龙山和顺百合种植基地,经湖南中医药大学周小江教授鉴定为百合科植物卷丹(LiliumlancifoliumThunb.)的珠芽部分。薯蓣皂苷元(B2117,上海源叶生物科技有限公司);甲醇(色谱纯,德国默克公司);乙腈(色谱纯,德国默克公司),王百合苷A(0252-DT01,上海standard 科技公司)。人胃癌细胞SGC-7901、人胃癌细胞HGC-27、人肺癌细胞A549(中科院上海细胞库);高糖DMEM培养基、FBS、PBS、0.25%胰蛋白酶-EDTA消化液(美国Gibco 公司);顺铂(CDDP,美国Sigma公司);CCK-8试剂盒(上海七海复泰生物科技有限公司);青霉素链霉素(美国HyCLone公司)。
2 方法与结果
2.1 UPLC-Q-TOF-MS分析百合珠芽中化学成分
2.1.1 色谱条件
色谱柱为Thermo Hypersil Gold C18柱(100 mm×2.1 mm,1.9 μm);流动相:乙腈-0.5%乙酸,梯度洗脱,流速:0.2 mL/min,柱温30 ℃,波长:309 nm,进样体积:2.00 μL。采用UPLC-MS/MS(正离子、负离子模式),离子化方式:电喷雾离子化(ESI),ESI-毛细管电压 2.8 kV,锥孔电压28 V,锥孔气流50 L/h;ESI+毛细管电压 3.0 kV,锥孔电压30 V,锥孔气流50 L/h。ESI+,ESI-离子化干燥气温度均为:T=350 ℃,V=600 L/h。流动性梯度洗脱程序见表1。
2.1.2 供试品溶液的制备
将采集的百合新鲜珠芽,洗净,再放入60 ℃鼓风干燥箱中60 min,得干百合珠芽,粉碎过100目,精密称定过筛的样品1.0 g至量瓶中,加入50 mL 80%乙醇,用超声仪提取40 min。冷却至室温,精密称定,补足80% 乙醇,滤过,滤液旋蒸至干,加入10 mL 80% 乙醇溶解过0.45 μm微孔滤膜,取续滤液,既得。
以国家土壤环境质量标准为评价标准,单因子污染指数评价法可用于评价土壤重金属污染程度,分析土壤环境质量对农业生产的影响程度。具体分级指标为:P综≤0.7,土壤环境质量处于清洁安全状态;P综
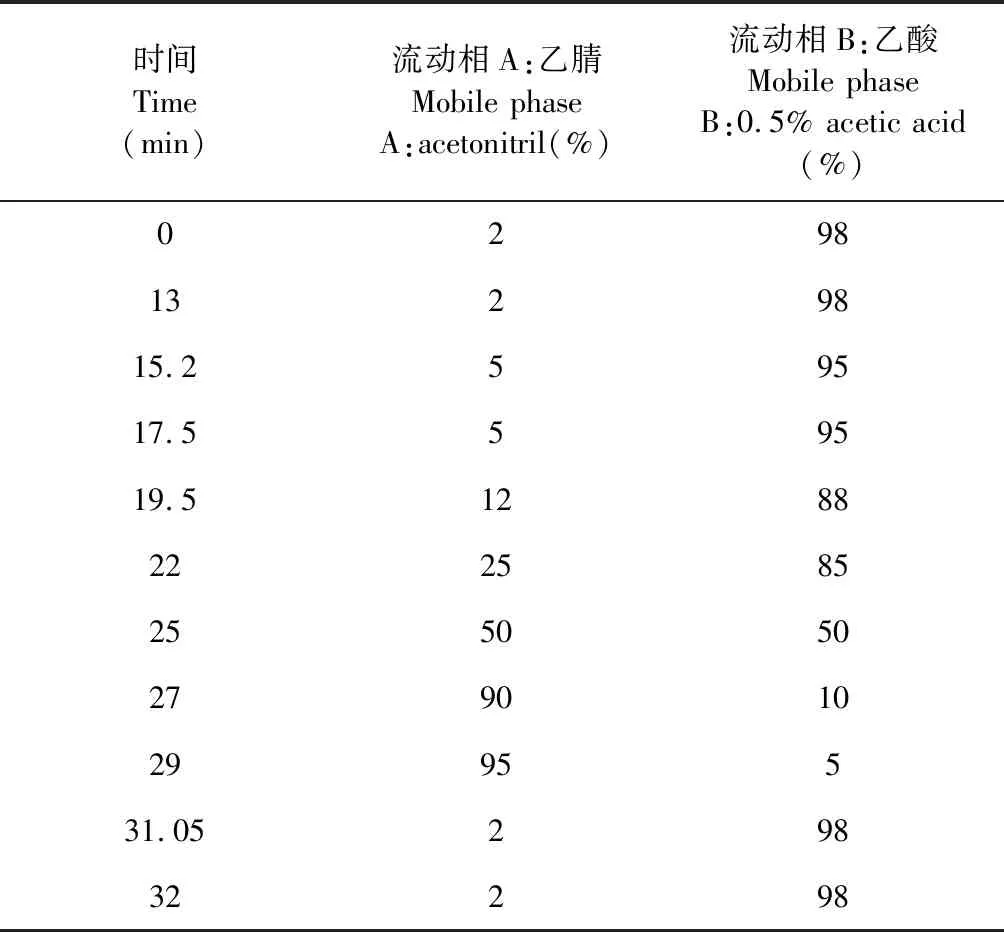
表1 梯度洗脱程序表
2.1.3 对照品溶液的制备
精密平行称取2份王百合苷A标准品适量,用80%乙醇溶解,稀释配制成0.556、0.68 mg/mL的王百合苷A对照品溶液。
2.1.4 超声提取优化试验
按2.1.2项下方法得到干百合珠芽,精密称定1.0 g干百合珠芽粉至量瓶中, 加入50 mL 80%乙醇,用超声仪在不同提取时间条件下(10、20、30、40、50 min)处理后,冷却至室温,精密称定,补足80% 乙醇,摇匀过0.45 μm微孔滤膜,取续滤液,既得待测液。在前期研究中,课题组发现与其他成分比较,百合珠芽中王百合苷A含量较高,因此选用王百合苷A的提取率作为百合珠芽药材的化学成分提取考核指标。将待测液注入Agilent UPLC 2010,测定王百合苷A的含量。王百合苷提取率计算方法:提取率(%)= 提取液浓度 ×体积 /原料质量 × 100%。
2.2 薯蓣皂苷元抗肿瘤实验
2.2.1 细胞培养
从-80 ℃冰箱内取出需要复苏的肺癌A549细胞,置于恒温水浴锅内37 ℃快速解冻,用移液枪迅速将冻存管内的解冻后的细胞液移至含4 mL 的10% FBS、1%双抗(青霉素、链霉素)DMEM完全培养液的15 mL离心管中,以800 rpm速率离心5 min,上清液弃去,加入6 mL DMEM完全培养液,混匀,将细胞液移至100 mm培养皿中,晃动培养皿使细胞液均匀分散,置于含5% CO2,37 ℃的培养箱内培养。细胞培养3~4天传代1次。
2.2.2 细胞增殖抑制试验
待培养细胞生长到对数生长期后,将细胞消化制成细胞悬液,计数,然后在96孔板中按100 μL/孔的比例接种细胞悬液(8.0×104~1.0×105个/mL),将培养板放在37 ℃,5% CO2培养箱中培养24 h。
2.2.2.2 加药干预
从培养箱中取出培养板,吸出旧培养液,每孔加入100 μL 无血清含双抗DMEM培养液,饥饿12 h后去掉培养液,5个实验组分别加入事先配置好的含不同浓度待测药物的DMEM完全培养液,溶剂对照组加入完全培养液,阳性对照组加入含4 μg/mL CDDP的完全培养液,每孔100 μL,每组设置5个副孔。置于培养箱中继续培养24 h。
2.2.2.3 加入CCK-8显色
取出培养板,吸弃每孔中的细胞培养液,避光加入CCK-8溶液与含双抗DMEM培养液,以10∶100比例新鲜配置的显色液,每孔100 μL,置于培养箱中孵育0.5~1.0 h。
2.2.2.4 检测吸光值
将处理好的培养板置于酶联免疫检测仪中,在波长为450 nm处的检测其OD值。
2.2.2.5 计算细胞增殖抑制率
根据每组测得的OD值,计算出药物对受试细胞的增殖抑制率。计算方法如下:
增殖抑制率(%)=(1-实验组OD值/对照组OD值)×100%
3 结果与讨论
3.1 超声提取条件的选择
进行了超声提取10、20、30、40、50 min的比较试验,发现40、50 min效果最佳,二者提取效率相当,故将超声提取时间设定为40 min。具体见表2。
3.2 液相色谱条件优化
对样品超声提取液进行UPLC-DAD测定,结果为309 nm时百合珠芽中多种有效成分有较大吸收峰,故选择百合珠芽定性分析检测波长为309 nm,(见图1)。同时考察了thermo C18(100 mm×2.1mm,1.5 μm),Agilent C18(2.1 mm×50 mm,1.8 μm),waters acquity UPLC BEH-C18(100 mm×2.1 mm,1.7 μm), 3 种色谱柱的峰形、柱效和分离度,结果显示,以thermo C18为最佳,这有利于质谱定性分析。

表2 不同超声提取时间下的王百合苷A提取效率

图1 百合珠芽液相色谱图(309 nm)Fig.1 Chromatography of lily bulbil(309 nm)
3.3 质谱条件优化
在实验中发现,单独用UPLC图无法很好地分离鉴定百合珠芽中复杂的化学成分。但是采用二级质谱离子流图可以较好地分离百合珠芽中主要化学成分。质谱条件的选择:ESI+模式下,毛细管电压从2.5 kV~3.5 kV,锥孔电压从20 V~40 V;ESI-模式下,毛细管电压从2.0 kV~3.2 kV,锥孔电压从20 V-35 V进行选择。最后发现,在ESI-模式下,毛细管电压 2.8 kV,锥孔电压28 V;ESI+模式下,毛细管电压 3.0 kV,锥孔电压30 V,TIC图得到的有效信息较多。
实验采用正、负离子模式同时扫描样品,其中在负离子模式条件下,王百合苷A、王百合苷B、王百合苷C、王百合苷E、王百合苷F、1-O-p-香豆酰甘油、1-O-阿魏酰香-3-O-p-豆酰甘油色谱峰响应值较高,而在正离子模式条件下,对香豆酸、槲皮素、薯蓣皂苷色谱峰响应值较高,为增大物质推测的可靠性,实验选用正、负离子模式同时测定样品,最大程度地获取质谱信息,见图2~3。
3.4 化学成分的UPLC-Q-TOF-MS鉴定
在拟定分析条件下,电喷雾电离源正离子模式和负离子模式对色谱流出物进行检测,四级杆飞行时间串联质谱法对各主要色谱峰进行归属,通过一、二级质谱图进行分析,根据其反相色谱保留行为、紫外检测和质谱特征,结合文献报道,进行结构鉴定。在负离子模式下,共推测鉴定出7个化学成分;在正离子模式下,共推测鉴定出3个化学成分。具体质荷比和碎片离子信息见表3。
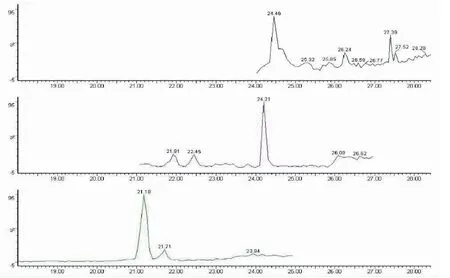
图2 二级质谱离子流图(正离子模式)Fig.2 Daughter ion flow graph of the MS-MS spectrogram in positive ion modes注:t=21.18 min,对香豆酸;t=24.21 min,槲皮素;t=27.39 min,薯蓣皂苷。Note:t = 21.18 min,p-coumaric acid;t = 24.21 min,quercetin;t = 27.39 min,dioscin.

图3 二级质谱离子流图(负离子模式) Fig.3 Daughter ion flow graph of the MS-MS spectrogram in negative ion modes 注:t=20.67 min,王百合苷C;t=21.52 min,王百合苷A;t=21.79 min,1-O-p-香豆酰甘油;t=21.82 min,王百合苷F;t=22.2 min,王百合苷E;t=22.85 min,王百合苷B;t=25.08 min,1-O-阿魏酰香-3-O-p-豆酰甘油。Note:t = 20.67 min,regaloside C;t = 21.52 min,regaloside A;t = 21.79 min,1-O-p-coumaroylglycerol;t = 21.82 min,regaloside F;t = 22.2 min,Regaloside E;t = 22.85 min,regaloside B;t = 25.08 min,1-O-feruloyl-3-O-p-coumaroylglycerol.
3.5 薯蓣皂苷元(Dio)对肿瘤细胞增殖的影响
3.5.1 Dio对肺癌细胞增殖的影响
Dio在浓度范围5~100 μM对肺腺癌A549细胞增殖具有弱抑制作用,其抑制率在8.11~15.03 %范围内。具体结果见表3。
3.5.2 Dio对胃癌细胞增殖的影响
5~100 μM Dio对胃癌HGC-27细胞增殖具有抑制作用,其抑制率在11.04~30.59%范围内,其中25~100 μM浓度组与对照组相比具有显著性差异(P<0.05,P<0.01,P<0.001)。具体结果见表5。
4 结论
本文建立了百合珠芽中主要化学成分的UPLC-Q-TOF-MS鉴定方法,方法快速简便,能为百合珠芽的质量控制及标志性成分分析提供技术参考。本文通过UPLC-Q-TOF-MS鉴定出了百合珠芽中薯蓣皂苷等10种化学成分,证实了百合珠芽中含有薯蓣皂苷,而薯蓣皂苷属于甾体皂苷,水解即可得到薯蓣皂苷元。在此基础上,进行了薯蓣皂苷元抗肿瘤药效实验,研究发现,薯蓣皂苷元对肺癌A549细胞增殖只有微弱的抑制活性,而对胃癌HGC-27细胞增殖表现出较强的抑制作用,其IC50值约为62786μM,并且展现出浓度依赖性。因此,有必要对百合珠芽化学成分进行深层次的药效研究,课题组将继续对鉴定出来的其他物质进行药效试验研究,为更好利用百合资源提供实验依据。
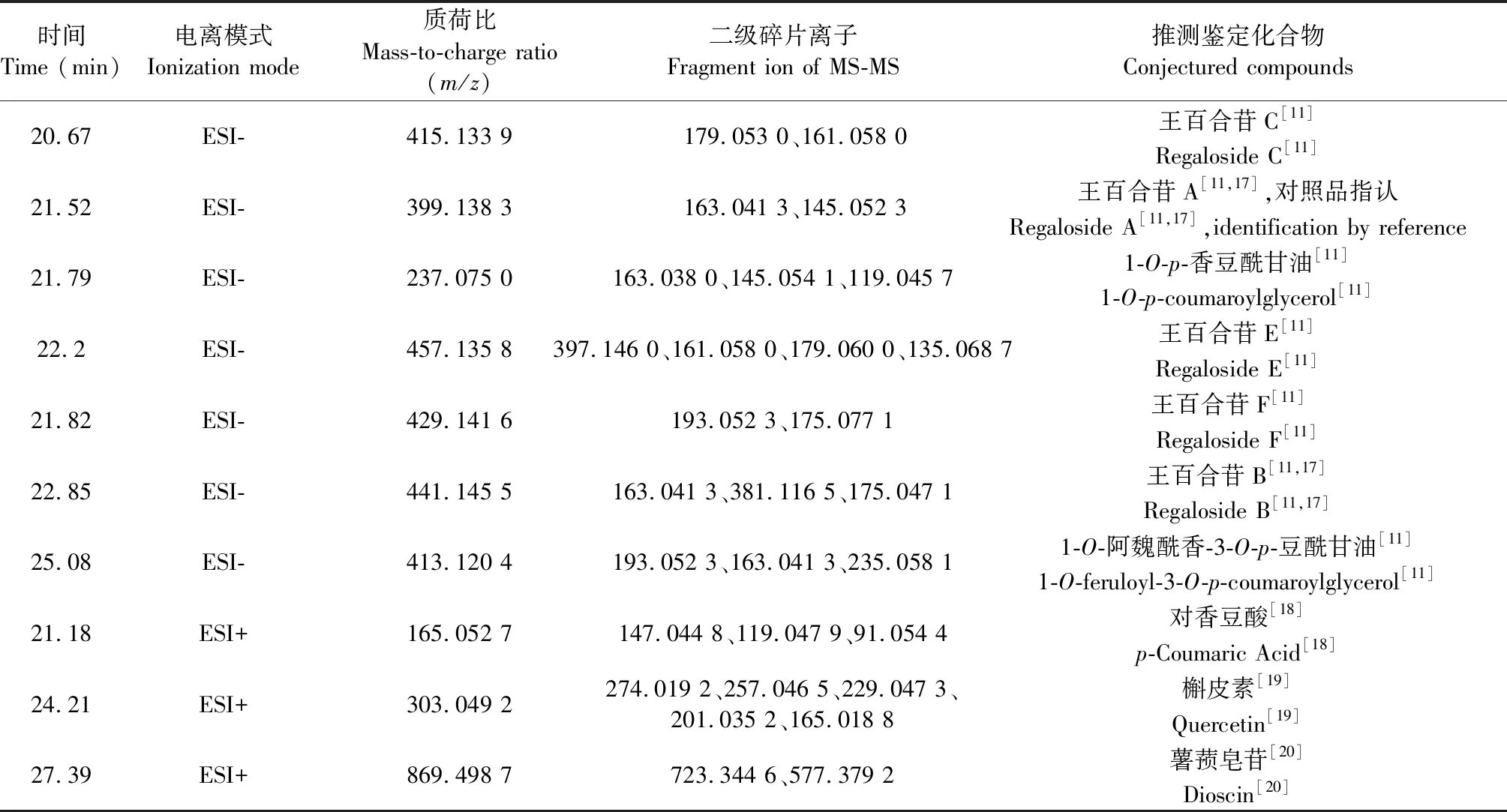
表3 百合珠芽UPLC-Q-TOF-MS分析结果
表4 Dio对肺癌A549细胞增殖的影响
注:与对照组比较,*P<0.05,**P<0.01,***P<0.001。
Note:compared with the control group,*P<0.05,**P<0.01,***P<0.001.
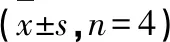
表5 Dio对胃癌HGC-27细胞增殖的影响
注:与对照组比较,*P<0.05,**P<0.01,***P<0.001。
Note:compared with the control group,*P<0.05,**P<0.01,***P<0.001.

