基于大鼠在体肠灌流模型研究白及有效部位在肠道的可吸收及代谢成分
陈 浩,王昌权,夏 涛,李月婷,王永林,黄 勇,李勇军,郑 林*
1贵州医科大学贵州省药物制剂重点实验室 药用植物功效与利用国家重点实验室;2贵州医科大学民族药与中药开发应用教育部工程研究中心;3 贵州医科大学药学院,贵阳 550004
白及为兰科植物白及Bletillastriata(Thunb.) Reichb.F.的干燥块茎,别名苞舌兰、连及草、白根等,是《中国药典》收载的常用药材,其味苦、甘、涩、微寒,归肺、肝、胃经,具有收敛止血、消肿生肌的功能。常用于治疗皮肤皲裂、烫灼伤、痈疮及各种出血性疾病[1,2]。现代药理研究表明,白及作为一种传统的中药材,药用价值高,用药广泛,具有抗病原微生物、止血活血、抗肿瘤、促进创面愈合、抗胃溃疡、调节免疫等药理作用[3]。但白及研究主要涉及白及的种植加工、成分提取分离与性质研究、抗氧化活性、药理活性以及药理作用和临床应用等[4]。而其在体内发挥疗效的物质基础一直未能明确[5],导致其产品工艺和质量控制水平低,使其在产品开发和临床应用受到一定的局限性。经高分辨质谱分析指认发现,其有效部位主要成分为1,4-二[4-(葡萄糖氧)苄基]-2-异丁基苹果酸酯(militarine)、4-(葡萄糖氧)苄基]-2-异丁基苹果酸酯(gymnoside I)、α-异丁基苹果酸(α-isobutylmalic acid)、 4-(葡糖糖氧基)-肉桂酸葡萄糖氧基苄酯(blestroside)、 二氢菲5 (dihydrophenanthrene 5)、 二氢菲1 (dihydrophenanthrene 1)、 1,4-二[4-(葡萄糖氧)苄基]-2-异丁基苹果酸酯-2-[4-O-肉桂酰基-6-O-乙酰基]葡萄糖苷(gymnoside Ⅸ)[6,7]。传统中药主要是经口服给药,而肠道是口服药物在体内代谢的重要场所,虽然某些中药在血浆中的原形成分和生物利用度不高,但却有很好的疗效,究其原因可能为其代谢物发挥了疗效[8,9]。因此,通过对白及在肠道的代谢研究,可以明确其进入体内的成分和存在形式,进而阐明白及的代谢途径和推测其机制,进一步的明确其药效物质基础,但有关白及在肠道的吸收和代谢的文献鲜有报道。肠道是药物的吸收的主要器官,同时还具有代谢药物的功能。其上皮细胞中不仅存在大量影响药物吸收的转运体,还含有多种与肝脏中相同的代谢酶[10]。而在体肠灌流模型不仅是研究药物吸收的简单可行的研究方法,更能够应用于药物肠道代谢特征的研究,相较于各种体外代谢研究方法,更接近于正常生理条件,其结果更加直观、可靠[11,12]。因此,该研究采用大鼠在体肠灌流模型研究白及有效部位在大鼠循环肠灌流液中可吸收成分及其代谢产物,对其在肠道中可能的吸收成分和代谢物进行初步研究,以期为阐释白及药材的药效物质基础提供理论依据。
1 仪器与材料
1.1 仪器
UPLC-Q-TOF/MS (Xevo G2-XS 美国沃特世公司,电喷雾四级杆串联飞行时间质谱仪、MassLynx V4.1质谱工作站,UNIFI数据库),KQ-300DE数控超声波清洗器(四川沃特尔科技发展有限公司),NA-5L氮空一体机(北京中兴汇利科技发展有限公司),EL204电子天平(梅特勒-托利多仪器有限公司),GILSON移液器(丹麦凯博),DK-98-IIA恒温水浴锅(天津泰斯特仪器有限公司);HL-2S蠕动泵(上海青浦沪西仪器厂)。
1.2 材料
氯化钠(天津市恒兴化学试剂制造有限公司,批号 160110);磷酸二氢钠(天津市复兴科技发展有限公司,批号 151110);无水氯化钙(西陇科学股份有限公司,批号 1705222);葡萄糖(天津科密欧化学试剂有限公司,批号 20150910);碳酸氢钠(西陇化工股份有限公司,批号 151106);氯化镁(汕头市西陇化工股份有限公司,批号 151209);氯化钾(汕头市西陇化工股份有限公司,批号 151103);乙腈为色谱纯(德国Merck 公司)、甲酸为色谱纯、水为纯净水、其他试剂均为分析纯。葛根素对照品(批号:110752-201615,含量95.4%)购自中国食品药品检定研究院,1,4-二[4-(葡萄糖氧)苄基]-2-异丁基苹果酸酯(militarine)对照品(批号:PS180413-03,含量≥98%)购自成都普思生物科技股份有限公司;天麻素(Gastrodin) 对照品(批号:110807-201608,含量97.6%)购自中国食品药品检定研究院;4-(葡萄糖氧)苄基]-2-异丁基苹果酸酯(gymnoside I); α-异丁基苹果酸酯(α-isobutylmalic acid); 4-(葡糖糖氧基)-肉桂酸葡萄糖氧基苄酯(blestroside);二氢菲5 (dihydrophenanthrene 5);二氢菲1 (dihydrophenanthrene 1);1,4-二[4-(葡萄糖氧)苄基]-2-异丁基苹果酸酯-2-[4-O-肉桂酰基-6-O-乙酰基]葡萄糖苷(gymnoside Ⅸ)对照品均为实验室自制(采用1NMR、13MR、MS、UV、IR波普进行结构鉴定,用UPLC-PDA在多个检测波长下测定,其峰面积归一化均大于98)。
1.3 动物
健康SD大鼠,雌雄兼用,体重为250±20 g,由重庆腾鑫生物技术有限公司提供,合格证号:SCXK (渝)2015-0001。
饲养条件:大鼠引进到实验室后,按每个饲养笼分装8只,雌鼠与雄鼠分开饲养,动物房内光照充足,空调和通风设备系统良好,温度控制在18~25 ℃,相对湿度在50%~60%。实验室定期对动物房进行消毒和消毒,大鼠在动物房饲养1周,待适应动物房环境之后再用于动物实验。
2 方法
2.1 溶液配制
2.1.1 标准溶液的配制
精密称取Militarine、gymnoside I、α-isobutylmalic acid、blestroside、dihydrophenanthrene 5、dihydrophenanthrene 1、gymnoside Ⅸ对照品适量,加甲醇溶解,摇匀,获得各对照品的储备液。用甲醇将各对照品的储备液稀释成所需浓度,得混合标准溶液。UPLC-Q-TOF/MS进样分析。
2.1.2 Krebs-Ringer’s(K-R)营养液的配制[13]
精密称取 CaCl20.37 g,葡萄糖 1.40 g,分别加少量蒸馏水使溶解,再称取NaCl 7.80 g、KCl 0.35 g、NaHCO31.37 g、NaH2PO40.32 g、MgCl20.02 g,加蒸馏水溶解后与溶解的 CaCl2及葡萄糖混匀,蒸馏水定容至1 L。
2.1.3 白及有效部位供试液的制备的制备
参照文献方法[14],称取白及药材用适量,用4倍量95%乙醇溶液回流提取3次,2 h/次,滤过,合并滤液,浓缩至浸膏,浸膏用水溶解后上D101大孔吸附树脂柱色谱,水洗脱后,用80%乙醇溶液洗脱,收集洗脱液,减压浓缩,残留物微波真空干燥,得白及有效部位,备用。称取白及提取物1 g,用15 mL无水乙醇溶解,取1 mL逐滴加入到5 mL 10%吐温80水溶液中,混匀后用K-R营养液稀释定容至100 mL,超声10 min,5 000 rpm离心10 min,取上清液,得666 μg/mL的供试液。取1 μL UPLC-Q-TOF/MS进样分析。
2.2 色谱条件
保护柱为Waters VanGuard BEH C18(2.1 mm×5 mm,1.7 1.7 μm);色谱柱是Waters BEH C18(2.1 mm×50 mm,1.7 μm)柱;流动相0.01%甲酸水溶液(A)-0.01%甲酸乙腈(B)进行梯度洗脱(0~2 min,5%B;2~5 min,5%~15%B;5~8 min,15%~15%B;8~10 min,15%~45% B;10~14 min,45%~95%B;14~15 min,95%~5%B)流速:0.5 mL/min;柱温:35 ℃;进样体积为1 μL。
2.3 质谱条件
电喷雾离子源;扫描方式为负离子扫描(ESI-,m/z50~1 200);毛细管电压1.5 kV;离子源温度 100 ℃;锥孔电压 30 V;脱溶剂气温度 300 ℃;锥孔气流量50 L/h;碰撞能量20~30 V;脱溶剂气流量 10 L/min;数据采集模式:MSEContinuum;甲酸钠校正;校正模式:sensitivity;质谱数据采集及处理软件为:Masslynx V4.1工作站。扫描方式为MS Centroid 模式。
2.4 白及有效部位在大鼠循环肠灌流试验中灌流液、血清和胆汁的收集[15,16]
取健康SD大鼠,实验前禁食12 h(不禁水),30 %乌拉坦(1.4 g/kg)麻醉大鼠,仰卧固定。实验分为两组:空白组和给药组。将给药组大鼠,固定于37 ℃恒温手术台,剃去大鼠腹部的毛,然后沿大鼠的腹部中线打开腹腔,开口大概3~4 cm,结扎总胆管;然后从大鼠胃后顺延找到幽门底部的十二指肠,在十二指肠前端剪一个小口并插入硅胶管,扎紧;然后通过盲肠找到回肠底端,在回肠底端同样剪一个小口并插入硅胶管,扎紧。使其与恒流泵形成一个回路。在灌流前,先将恒流泵调至1.0 mL/min 的流速并用37 ℃的生理盐水冲洗肠道,冲至肠道无内容物为止,然后排空肠道内的水分。取37 ℃白及有效部位溶液60 mL,以5.0 mL/min 的流速循环平衡15 min后,此时记为0时。调节流速,再以2.5 mL/min的速度继续循环,收集3 h时白及有效部位循环肠灌流液;与此同时,实施胆管插管手术,开腹,找到胆管,于胆管切口,选用内径小的硅橡胶(1.5 mm)插入胆管,收集3 h含药胆汁;实验结束后,立即实施腹主动脉取血,于37 ℃水浴孵育后,收集含药血清。空白组大鼠按照给药组方法进行空白胆汁、空白循环肠灌流液、空白血清。以上样品均放置-20 ℃保存,备用。
2.5 样品处理方案
2.5.1 血清样品处理方法
取大鼠血清1 mL,置于5 mL进口塑料离心管中,补加4 mL甲醇,涡混震荡2 min后,超声5 min,15 000 rpm离心10 min,取上清液于37 ℃ 氮气吹干 ,加入1 mL甲醇于吹干的样品中,按上述处理方法加入1 mL甲醇二次沉淀蛋白,加入200 μL 50%甲醇水溶液溶解残留物,涡混震荡2 min后,超声5 min,15 000 rpm离心10 min,取上清液UPLC-Q-TOF/MS进样分析。
2.5.2 胆汁样品处理方法
取大鼠胆汁1 mL,加入1 mL 1%甲酸水,然后加入2 mL乙酸乙酯萃取3次,合并萃取液于37 ℃氮气吹干,加入200 μL 50%甲醇水溶液溶解残留物,涡混震荡2 min后,超声5 min,15 000 rpm离心10 min ,取上清液UPLC-Q-TOF/MS进样分析。
2.5.3 灌流液样品处理方法
取肠灌流循环液1 mL,加入1 mL 1%甲酸水,然后加入2 mL乙酸乙酯萃取3次,合并萃取液于37 ℃氮气吹干,加入200 μL 50%甲醇水溶液溶解残留物,涡混震荡2 min后,超声5 min,15 000 rpm离心10 min ,取上清液UPLC-Q-TOF/MS进样分析。
3 结果与分析
运用Masslynx V4.1软件得到K-R液+药液、空白血清、含药血清及两者差异图谱;空白胆汁、含药胆汁及两者差异图谱;空白灌流液、含药灌流液及两者差异图谱。图谱见图1~图3,主要代谢产物信息表见表1。各成分在ESI-模式下得到较好的响应信号。

图1 白及有效部位在大鼠血清中的代谢产物ESI-基峰图Fig.1 Base peak chromatograms of active fraction from Bletilla striata metabolites in rats serum sample in negative mode注:(A) K-R液+药液;(B) 空白血清;(C) 含药血清;(D)含药血清与空白血清差异图谱;Y1:militarine;Y2:gymnoside I;Y3.α-isobutylmalic acid;M1.gastrodin脱糖后硫酸化的代谢产物;M2.dihydrophenanthrene 5葡萄糖醛酸化的代谢产物。Note:(A) K-R liquid + liquid medicine (B) blank serum;(C) serum with drug ;(D) different chromatograms of A and B ;Y1.militarine;Y2.gymnoside I;Y3.α-isobutylmalic acid;M1.Sulfated metabolites after gastrodin de-sugar;M2.Dihydrophenanthrene 5 glucuronidation metabolite.

图2 白及有效部位在大鼠胆汁中的代谢产物ESI-基峰图Fig.2 Base peak chromatograms of active fraction from Bletilla striata metabolites in rats bile sample in negative mode注:(A) 空白胆汁;(B) 含药胆汁;(C) 含药胆汁与空白胆汁差异图谱;Y2.gymnoside I;Y3.α-isobutylmalic acid ; M1.gastrodin脱糖后硫酸化的代谢产物;M2.dihydrophenanthrene 5葡萄糖醛酸化的代谢产物。Note:(A) blank bile;(B) bile with drug;(C) different chromatograms of A and B;Y2.gymnoside I;Y3.α-isobutylmalic acid ;M1.Sulfated metabolites after gastrodin de-sugar;M2.Dihydrophenanthrene 5 glucuronidation metabolite.

图3 白及有效部位在大鼠在体循环肠灌流液中的代谢产物ESI-基峰图Fig.3 Base peak chromatograms of active fraction from Bletilla striatat metabolites in rats intestinal perfusion sample in negative mode注: (A) 空白循环肠灌流液;(B) 含药循环肠灌流液;(C) 含药循环肠灌流液与空白循环肠灌流液差异图谱;M2.dihydrophenanthrene 5葡萄糖醛酸化的代谢产物。Note:(A) blank intestinal perfusion;(B) intestinal perfusion with drug;(C) different chromatograms of a and b;M2.ophenanthrene 5 glucuronidation metabolite.

表1 白及有效部位在大鼠循环肠灌流液、血清、胆汁中的代谢产物分析
注:S:血清,B:胆汁,I:肠灌流液。
Note:S:serum,B:bile,I:intestinal perfusate.
3.1 原型与代谢产物鉴定
3.1.1 原型产物鉴定
Y1:在10.06 min处存在m/z725.264 8 [M-H]-峰的化合物,显示m/z457.174 0的主要碎片离子峰,由Single Mass Analysis预测的化学式分为C34H45O17,与militarine对照品相同,由此确定TR10.06 min的Y1为militarine。
Y2:在8.71 min处存在m/z457.171 0 [M-H]-峰的化合物,显示m/z285.102 5的主要碎片离子峰,由Single Mass Analysis预测的化学式分为C21H29O11,与gymnoside I对照品相同,由此确定TR8.71 min的Y2为gymnoside I。
Y3:在4.26 min处存在m/z189.075 6 [M-H]-峰的化合物,显示m/z129.055 6的主要碎片离子峰,由Single Mass Analysis预测的化学式分为C8H13O5,与α-isobutylmalic acid对照品相同,由此确定TR4.26 min的Y3为α-isobutylmalic acid。
3.1.2 代谢产物鉴定
M1:在0.62 min处存在m/z203.002 3 [M-H]-峰的化合物,显示m/z123.042 0的主要碎片离子峰,由Single Mass Analysis预测的化学式分为C7H7O5S,推测M1为gastrodin脱糖后硫酸化的代谢产物。由于具体信息不够全面,因此不能确定发生代谢和转化的位点。
M2:在6.23 min处存在m/z417.117 4 [M-H]-峰的化合物,质量数比dihydrophenanthrene 5多176,显示m/z241.083 4的主要碎片离子峰,由Single Mass Analysis预测的化学式分为C21H21O9,推测M2为dihydrophenanthrene 5葡萄糖醛酸化的代谢产物。由于具体信息不够全面,因此不能确定发生代谢和转化的位点。
3.1.3 白及有效部位在大鼠循环肠灌流液、血清、胆汁中的代谢物生物转化途径
根据以上代谢产物的鉴定结果,白及有效部位在大鼠循环肠灌流液、血清、胆汁中的代谢产物的生物转化途径见图4。
4 讨论
小肠不仅是药物吸收的主要部位,同时小肠黏膜的上皮细胞也是药物肝外代谢的主要部位之一,而小肠自身所表达的药物代谢酶会影响到药物的首关代谢和生物利用度,对口服药物的毒性及疗效有着潜在的影响[17]。研究药物吸收和代谢特性的模型有体内、在体和体外3种,但体内和体外的的操作方法均较为繁琐,实验要求高,难以达到良好的效果[18]。故本实验采用在体循环肠灌流模型,研究白及有效部位在肠中可能吸收的成分及代谢产物。从图谱中可以发现存在其他未检识出的丰度较高的化学成分,但目前对白及醇提后的非多糖成分能够确认的成分较少。只能根据已鉴别确认的化学成分来对其实验谱图中的峰图进行鉴别。而对其它丰度较高的化学成分与目前已鉴别确认的化学成分进行对比分析后,还是无法对其进行鉴别和归属,但是其未检识出的丰度较高的化学成分有可能源自原型药材、内源性物质、代谢物,具体是何种成分还有待继续深入研究。
在肠道环境中代谢产物不仅仅是小肠黏膜的上皮细胞对药物进行代谢,同时排入肠道的胆汁也会对药物进行代谢。结果显示,在胆汁中检测到了代谢产物M1,而在肠灌流液中未检测到M1,故推测代谢产物是由胆汁的影响或其经过肝脏代谢排入胆汁中,进而对血清进行检测发现M1存在于血清中,这表明M1能够吸收入血。通过单独对肠灌流液和胆汁的检测,推测产生代谢产物的来源,而对血清进行检测,则为了推测在肠道中可吸收的成分,同时为研究白及有效成分在各个肠段中的吸收及代谢情况奠定实验基础。目前有关白及有效部位的相关代谢文献尚未见报道,因此本实验基于大鼠在体肠灌流模型收集大鼠循环肠灌流液、血清、胆汁全面的分析白及有效部位在肠道中的变化,实验结果显示,在血清、胆汁中共检测出3个原型产物,在肠灌流液、血清、胆汁2个代谢产物,其代谢物主要发生水解和葡萄糖醛酸化反应。该实验结果,将为阐释白及药材的药效物质基础和进一步的研究提供实验依据。
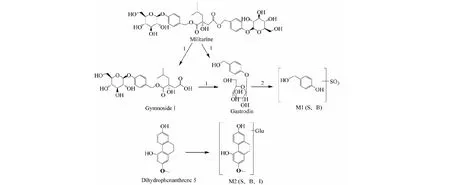
图4 白及有效部位在大鼠在体循环肠灌流实验中可能的代谢途径Fig.4 Possible metabolic pathway of Bletilla striata (Thunb.) Reichb.F.extract in human intestinal flora注:1.酯键水解;2.酯键水解部位脱糖后硫酸化 3.葡萄糖醛酸化;S.血清 B.胆汁 I.肠灌流液。Note:1.Ester bond hydrolysis;2.Esterification of the ester bond hydrolysis site after de-sugarization 3.Glucuronidation;S:Serum B:Bile I:intestinal perfusion.

