罗伊氏乳杆菌发酵对酸乳营养价值的影响
温夏萍,王呈,弓耀忠
(1.山西省农业科学院畜牧兽医研究所,太原 030032; 2.山西省食品质量安全监督检验研究院,太原 030012)
随着人们生活质量的不断提高,在饮食消费方面,消费者更加注重选择既营养又健康的食品。发酵乳以其丰富的营养和多样的功能性越来越受到人们关注。发酵乳是益生菌理想的载体,益生菌在发酵乳中使用日益普遍,其产品比重不断扩大。罗伊氏乳杆菌(Lactobacillus reuteri)是目前已报道的所有脊椎动物和哺乳动物肠道内天然存在的乳酸菌之一[1]。我国卫生部于2003年批准了罗伊氏乳杆菌可作为人类保健品的微生物菌种,且该菌是国际上公认的新型益生乳酸菌,具有很高的理论研究和生产应用价值[2]。
在牛乳中,罗伊氏乳杆菌单种发酵能力较弱,因而本课题采用混菌发酵方式,探讨罗伊氏乳杆菌的发酵作用对牛乳营养成分的影响,为罗伊氏乳杆菌的应用及罗伊氏乳杆菌牛乳发酵制品的研发奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌种
所选取的乳酸菌罗伊氏乳杆菌(Lactobacillusr e u t e r i)L A-0 2、德氏乳杆菌保加利亚亚种(Lactobacillus delbrueckii subsp. bulgaricus)LD-02、嗜热链球菌(Streptococcus thermophilus)LS-11均由本实验室分离、选育和保存。鼠李糖乳杆菌(Lactobacillus rhamnosus)ATCC 7469由本实验室购买和保存。
1.1.2 培养基
脱脂乳培养基:取牛场新鲜无抗牛乳脱脂后,加入1%自制营养添加剂,分装于50mL玻璃瓶中,无氧条件下硅胶塞密封后,115℃、15min灭菌备用。
MRS肉汤培养基、MRS培养基:北京陆桥技术有限责任公司。
1.1.3 主要仪器设备
生物洁清工作台,苏净集团苏州安泰空气技术有限公司;紫外可见光分光光度计,上海成光仪器有限公司;荧光光度计,北京吉天仪器有限公司;隔水式电热恒温培养箱,上海贺德实验设备有限公司;不锈钢立式电热蒸汽消毒器,上海三申医疗器械有限公司;电热恒温鼓风干燥箱,上海跃进医疗器械厂;电子天平,上海民桥精密科学仪器有限公司;多功能红外炉,广东美的生活电器制造有限公司;电动乳脂分离机,青海农牧机械制造有限公司;涡旋振荡器,上海沪析实业有限公司。
1.2 方法
1.2.1 菌种的活化
从-80℃取出菌株复苏纯化,LA-02、LD-02培养温度37℃,LS-11培养温度40℃;将其在MRS肉汤培养基分别活化培养三代;将LA-02、LD-02和LS-11分别按1%的接种量接种于MRS肉汤培养基中,培养18h,作为菌种备用,使用时摇匀。
1.2.2 接种及发酵条件
将制备好的脱脂乳培养基分成两组。厌氧条件下,A组接入0.5% LA-02、0.5% LD-02和0.5% LS-11;B组接入0.75% LD-02和0.75% LS-11。将两组同时置于37℃下培养,培养周期为脱脂乳培养基凝固终止发酵。
1.2.3 活菌计数
从培养0时起,每隔1h取A、B组发酵液各一瓶分别进行活菌计数。厌氧条件下,取发酵液1mL进行适度稀释,用灭菌的玻璃涂布棒将稀释好的发酵液100μL,涂布于MRS培养基平板上,37℃培养48h,计算活菌数(cfu/mL) 。活菌计数具体方法及数据处理参照国标GB4789.35—2010。
1.2.4 酸度的测定
从培养0时起,每隔1h取A、B组发酵液各一瓶分别进行酸度测定。厌菌条件下取10mL发酵液,加入20mL蒸馏水,摇匀后加入2~3滴酚酞指示剂,用0.1mol/L NaOH滴定样品呈粉红色且30s不褪色,读出所用的NaOH体积数,乘以10即为样品的滴定酸度值(°T)。
1.2.5 游离氨基酸含量的测定
样品前处理:取样品乳5mL置于50mL容量瓶中,加入2mL乙酸锌溶液和2mL亚铁氰化钾溶液,摇匀,定容至刻度,静置沉淀后,过滤,弃去最初少量滤液,滤液备用[3]。游离氨基酸含量的测定,参照GB/T 8314—2013的方法进行。
1.2.6 硫胺素、核黄素及叶酸含量:分别参照国标 GB5009.84-2016[4]、 GB5009.85-2016[5]、GB5009.211-2014[6]中相关方法进行测定。
2 结果
2.1 活菌总数变化
本项试验测定A、B两组活菌总数的变化。通过比较进一步了解罗伊氏乳杆菌在牛乳中的生长状态,试验结果见表1、图1。

表1 牛乳发酵过程中活菌总数的变化
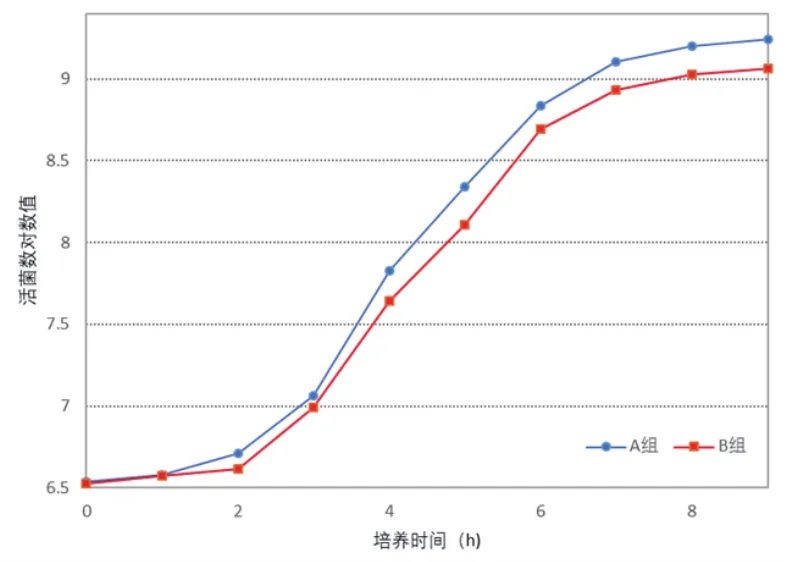
图1 牛乳发酵过程中活菌总数的变化
从图1可看出,与B组相比,含有罗伊氏乳杆菌LA-02的A组生长较为旺盛,活菌总数最高达到1.75×109,发酵9h时A组活菌数与B组相差最大,达到5.9×108个。
2.2 酸度变化
本项试验测定A、B两组酸度的变化。通过比较进一步了解罗伊氏乳杆菌在牛乳中的生长状态,并了解其在牛乳中的产酸能力。试验结果见表2、图2。
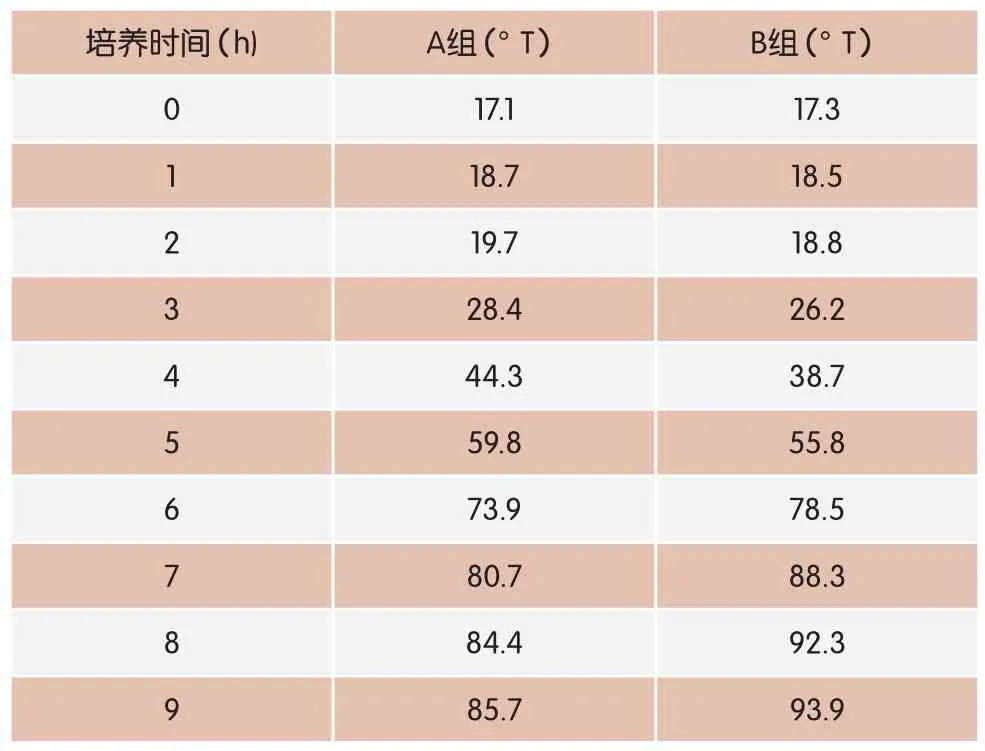
表2 牛乳发酵过程中的酸度变化
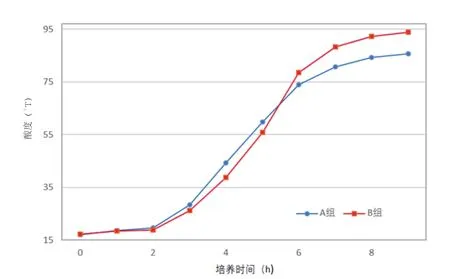
图2 牛乳发酵过程中的酸度变化
从图2可看出,A组与B组酸度曲线约在5.5h发生交叉,0~5.5h阶段,A组的酸度要高于B组;5.5~9h阶段,B组的酸度要高于A组。培养9h乳凝固发酵终止时,B组的酸度达到93.9°T,而A组的酸度只有85.7°T 。
2.3 牛乳发酵前后游离氨基酸总量和硫胺素、核黄素、叶酸含量的变化

表3 牛乳发酵前后游离氨基酸总量和硫胺素、核黄素、叶酸含量的变化
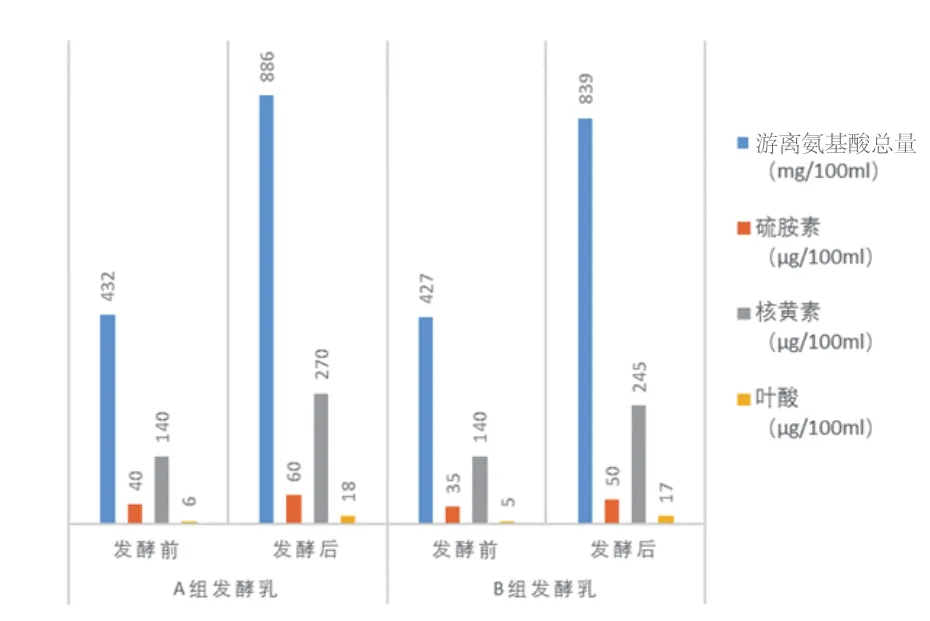
图3 牛乳发酵前后游离氨基酸总量和硫胺素、核黄素、叶酸含量的变化
从表3、图3可知,总体上看脱脂乳培养基经乳酸菌发酵后其游离氨基酸总量和硫胺素、核黄素、叶酸含量均有不同程度的提高,只是由于发酵菌种的不同,增加幅度不同。从组间比较分析可看出,游离氨基酸和核黄素增加幅度A组要明显高于B组,而两组间硫胺素和叶酸增加幅度差别不明显。
3 讨论
在混菌发酵体系中,生长曲线可反映整个体系微生物在培养介质中的生长状态。对图1分析可得到以下结论:在脱脂乳培养基中,A组混菌发酵体系的生长状态要优于B组;与B组相比,A组中多了罗伊氏乳杆菌LA-02,也就是说,罗伊氏乳杆菌LA-02的接入可改善LD-02和LS-11混菌发酵体系在脱脂乳培养基中的生长状态。
酸度变化曲线可反映发酵体系的产酸能力,也可印证其在培养基中的生长状态。对图2分析可将酸度变化分成两个阶段,培养0~5.5h为第一阶段,培养5.5h至结束为第二阶段。第一阶段A组的酸度要高于B组,这与图1的结果相一致。第二阶段酸度变化发生了反转,B组高于A组。究其原因,主要是罗伊氏乳杆菌LA-02产酸特性所确定的。LA-02发酵乳糖主要产生乳酸、碳酸和乙酸,碳酸不稳定易分解成二氧化碳挥发,致使培养基酸度增长速度降低。
有资料显示,酸乳中的游离氨基酸量主要取决于发酵菌株的乳蛋白水解能力[7];酸乳中硫胺素和核黄素提高量与发酵剂组分成正相关[8]。因而,对图3分析可得出:在菌株LD-02、LS-11组成的发酵剂中,加入LA-02能明显提高发酵乳核黄素的含量。

