荧光定量 PCR检测原料乳中粘质沙雷氏菌
姜鸿瑞,韩紫音,夏海磊,王梦琦,冀德君,毛永江,杨章平,张慧敏
(扬州大学动物科学技术学院,扬州 225009)
粘质沙雷氏菌(S.marcescens)属于革兰氏阴性菌,亦称灵杆菌[1],是一类肠道杆菌,普遍存在于水和土壤中,可在低温下生长繁殖,低温食品极易受其污染,如乳制品、水产品、禽类产品等。此外,S. marcescens是一种条件性致病菌,当机体免疫功能低下时就会引起肺炎、败血症、脑膜炎等各种疾病,并且对多种抗生素产生耐药性。近年来,S. marcescens引发感染的事件越来越多,逐渐引起人们的重视。
S. marcescens可分泌多种胞外水解酶,如耐热脂肪酶及蛋白酶,这些酶可水解牛奶中的蛋白质和脂类,进而导致牛奶变质,产生苦味、异味、不洁味等。牛奶的热处理工艺虽然可以杀灭微生物,但对耐热酶没有作用,耐热酶的活性基本不受影响,给乳制品安全带来巨大的隐患[2,3]。研究发现,S. marcescens是原料乳低温贮藏期间的主要嗜冷菌之一,由此可见,快速、准确地检测原料乳中S. marcescens对保障原料乳质量安全有重要意义。
近年来,随着分子生物学技术的发展,荧光定量PCR技术被广泛地应用于原料乳中致病菌的检测,如金黄色葡萄球菌、沙门菌属等[4]。为了准确、高效地检测原料乳中的S. marcescens,本研究选取对S. marcescens有特异性的S-核糖基高半胱氨酸酶(luxS)基因作为检测的靶基因[5],建立原料乳中S.marcescens的高灵敏、高特异的实时荧光定量PCR快速检测体系,为原料乳的质量安全提供技术支撑。
1 材料与方法
1.1 材料与仪器
粘质沙雷氏菌ATCC14756、荧光假单胞菌ATCC13525、鲁氏不动杆菌ATCC15309、阪崎肠杆菌ATCC29544购自美国模式培养物集存库;金黄色葡萄球菌ATCC29213、大肠杆菌JM109由本实验室提供;沙门氏菌ATCC13076、李斯特菌ATCC15313由扬州大学兽医学院药理与毒理实验室提供;pUCm-T和大肠杆菌感受态细胞购自上海Sangon公司;Taq酶、DNA纯化试剂盒、SYBR® Premix Ex Taq™ II (TliRNaseH Plus)和DNA Marker均购自大连TaKaRa公司;细菌基因组DNA提取试剂盒DP302购于天根生化科技有限公司;其他试剂均为国产或进口分析纯。梯度PCR仪及ND-1000微量紫外可见光度计为美国赛默飞世尔科技公司产品;荧光定量PCR扩增仪7500为美国ABI公司产品;凝胶成像分体系统为SYNGENE公司产品。
1.2 试验方法
1.2.1 引物设计及合成
根据文献中报道的对S. marcescens有特异性的luxS基因(GenBank登录号:EF164926.1,AJ628150.1)设计特异性引物[5]。引物由上海生物工程公司合成,引物序列见表1。
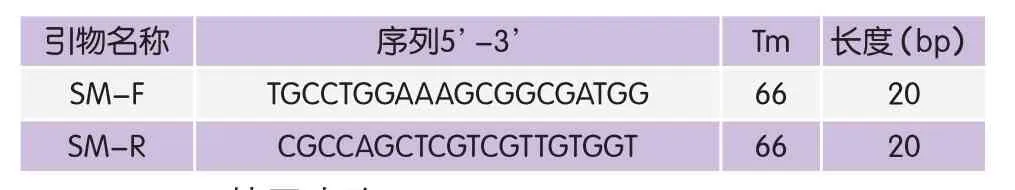
表1 引物序列
1.2.2 luxS基因克隆
S. marcescens在LB培养基中培养12h,取1mL离心收集菌体,参照细菌DNA提取试剂盒说明书提取DNA。以S. marcescens的DNA为模板,SM-F、SM-R为引物进行PCR,然后将PCR产物用2%琼脂糖凝胶电泳分析,割胶回收后连入pUCm-T质粒,转化大肠杆菌感受态细胞,经平板筛选和酶切鉴定正确后,送上海生物工程公司测序。
1.2.3 荧光定量PCR标准曲线的建立
将S. marcescens在LB培养基中培养过夜,用平板菌落记数法定量,采用LB培养基进行10倍梯度稀释,得到不同浓度菌液。提取梯度浓度菌液的基因组DNA,然后采用实时定量PCR试剂盒进行扩增。PCR扩增反应体系为20μL:SYBR Premix Ex TaqⅡ 10μL;SM-F 0.8μL,SM-R 0.8μL;DNA模板 2.0μL;ddH2O 6.0μL;Rox Reference Dye Ⅱ 50×0.4μL。PCR反应条件为:95℃ 30s;95℃ 5s,61℃ 34s,40个循环;在61℃退火阶段收集荧光值,并在上述扩增条件后增加60~95℃的融解曲线分析。每个样本3个平行,进行荧光定量PCR后得到相应的Ct值,以菌落数的lg值和Ct值制作标准曲线。
1.2.4 特异性试验
提取6种乳中常见微生物(金黄色葡萄球菌、大肠杆菌、沙门氏菌、李斯特菌、阪崎肠杆菌、荧光假单胞菌)的基因组DNA,并分别以其为模板,采用1.2.3中的荧光定量PCR方法进行扩增,以S. marcescens作为阳性对照,检测该方法的特异性。
1.2.5 灵敏度评价
以1.2.3中获得的梯度浓度S. marcescens基因组DNA为模板,SM-F和SM-R为引物进行常规PCR,其反应条件为:95℃ 3min,30个循环(95℃ 30s,61℃30s,72℃ 30s),72℃ 10min。评价荧光定量PCR与普通PCR检测方法的灵敏度。
1.2.6 人工阳性样品乳检测
将1.2.3中已经定量的菌液,采用灭菌全脂乳进行10倍梯度稀释,得到不同浓度菌液。离心去脂肪,沉淀用无菌生理盐水洗涤两次,然后采用文献中报道的方法提取人工阳性样品乳中的DNA[6],并按照1.2.3中的方法进行荧光定量PCR扩增。
1.2.7 荧光定量PCR检测原料乳中的S. marcescens
在不同的月份(2015年的11月、12月份及2016年的1月份),从江苏省扬州市周边8个奶牛场中采集原料乳样品,提取奶样DNA,进行荧光定量PCR及常规PCR检测,确定每个牧场的原料乳是否污染了S.marcescens,以此监控每个牧场的奶源质量。
2 结果与分析
2.1 PCR产物的凝胶电泳
首先以S. marcescens的DNA为模板,利用引物SM-F和SM-R进行PCR,扩增产物经琼脂糖凝胶电泳鉴定,结果如图1(泳道1)所示。图1显示,在180bp处有一特异性条带。将目标条带进行割胶回收后连入质粒pUCm-T进行测试,测序结果显示luxS部分基因片段长度为175bp,与拟克隆的基因序列只有1个碱基不同,与理论片段同源率为99.43%。
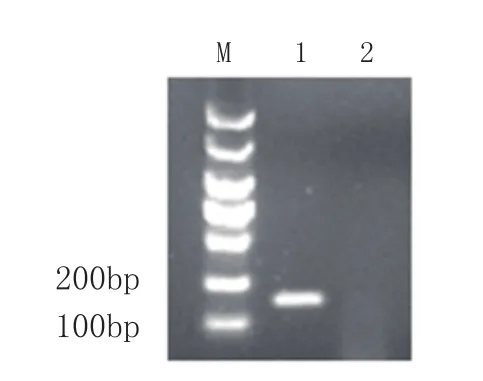
图1 luxS基因 PCR产物琼脂糖凝胶电泳
2.2 荧光定量PCR标准曲线
将S. marcescens过夜培养,采用菌落平板记数法定量菌液浓度为6.9×109cfu/mL,经稀释后,得到不同浓度菌液(6.9×101、6.9×102、6.9×103、6.9×104、6.9×105、6.9×106、6.9×107cfu/mL)。以细菌数的lg值和Ct值制作荧光定量PCR的标准曲线(y=-1.864x+31.32,相关系数为0.999),结果表明不同梯度浓度细菌数的lg值与Ct值之间具有良好的线性关系[7~9],荧光定量PCR的Ct值与初始模板在6个lg浓度范围内(菌落数为6.9×107~6.9×102cfu/mL)呈现良好的线性关系。当菌落数达到6.9×101cfu/mL进行扩增后,其Ct值大于水的Ct值(图2),故该浓度下不能对luxS基因进行有效的检测。由此可知,该检测方法的最低检测限可达到6.9×102cfu/mL。
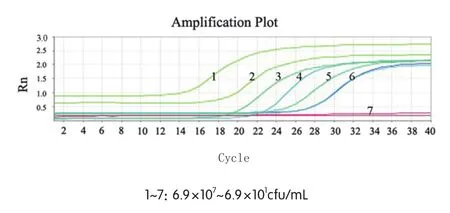
图2 荧光定量PCR扩增
2.3 荧光定量PCR试验的敏感性
通过试验可以确定荧光定量PCR检测的最低菌落数(6.9×102cfu/mL),然后以试验中获得的不同浓度菌液的基因组DNA为模板,SM-F和SM-R为引物进行常规PCR,比较荧光定量PCR与常规PCR的敏感性[10],如图3所示,常规PCR检测S. marcescens的灵敏度是6.9×103cfu/mL,由此可见荧光定量PCR的灵敏度较高。
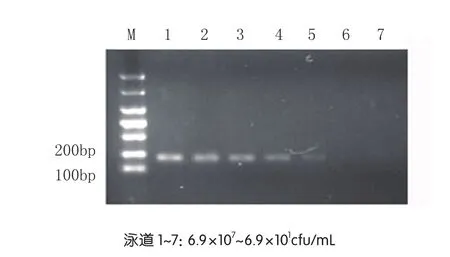
图3 常规PCR检测luxS的灵敏度
2.4 荧光定量PCR试验的特异性
如图4所示,荧光定量P C R结果显示只有S.marcescens样品出现了较强的荧光信号,而其余6种乳中常见微生物均未出现相应的荧光扩增曲线。经过溶解曲线分析,特异性溶解曲线呈现单一峰形。说明该方法检测S. marcescens具有良好的特异性。
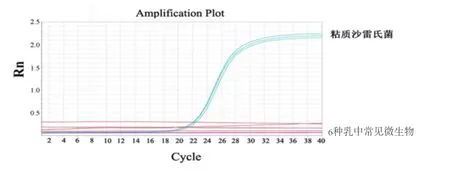
图4 荧光定量PCR方法特异性验证
2.5 荧光定量PCR方法的应用
在不同的月份,从江苏省扬州市8个奶牛场中取样原料乳,提取奶样DNA,进行荧光定量PCR及常规PCR检测,结果如表2所示,所有样品的Ct值均不在检测范围中,说明这8个牧场这三个月里都没有感染S.marcescens。同时,常规PCR检测结果也未检出阳性样品。
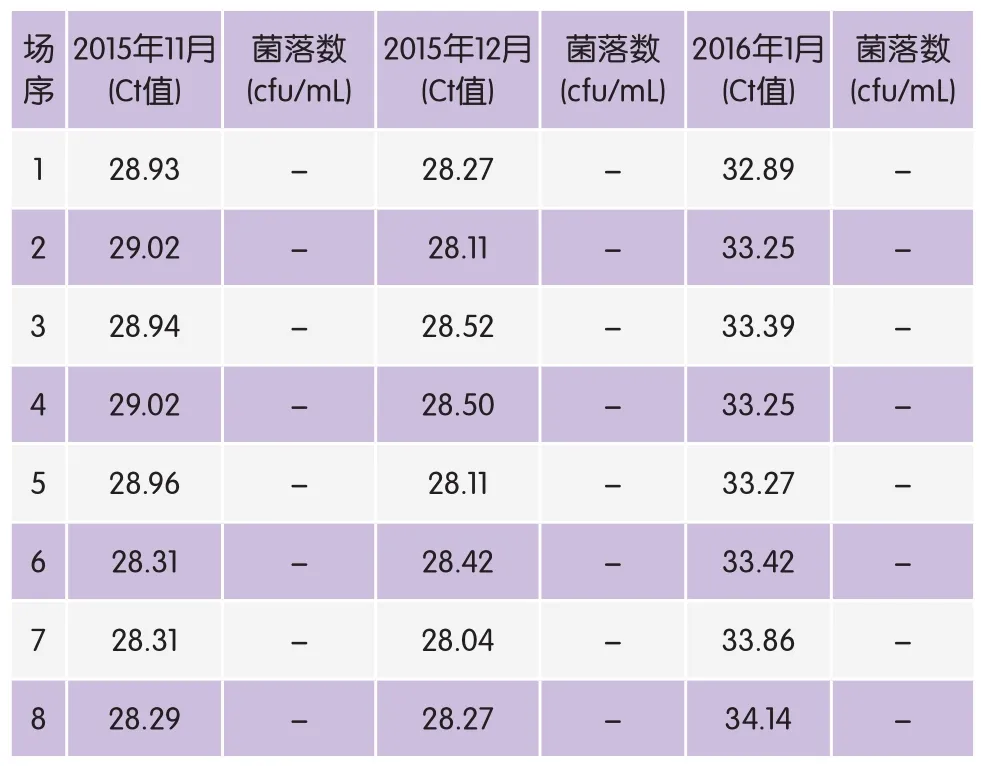
表2 不同牧场不同月份原料乳中S. marcescens荧光定量PCR检测结果
3 讨论与结论
本研究建立了S. marcescensluxS基因的SYBR Green Ⅰ实时荧光定量PCR检测方法,通过此方法,得出了人工污染奶样的标准曲线y=-1.864x+31.32,相关系数为0.999,菌液浓度为6.9×107~6.9×102cfu/mL,对应的Ct值范围是16.70~26.02[11]。本研究中荧光定量PCR对S. marcescens的最低检测限是6.9×102cfu/mL,而常规PCR的检测限是6.9×103cfu/mL。李一松等[12]用荧光定量PCR检测乳中携带sea基因金黄色葡萄球菌,结果表明,该方法可以快速稳定地检测出乳中的金黄色葡萄球菌,并确定了有效检测限是8.3×102cfu/mL。由此可见,荧光定量PCR方法的检测限范围比常规PCR要广。
在采样的8个牧场的原料乳中,所有样品的Ct值均不在检测范围内,说明这8个牧场这三个月的原料乳均未感染S. marcescens。可能是因为这三个采样月正值冬季气温较低,不利于微生物的生长。
本试验建立了荧光定量PCR检测原料乳中粘质沙雷氏菌的方法,方法灵敏度为6.9×102cfu/mL,比常规PCR方法的灵敏度高,且特异性强。与常规PCR相比,荧光定量PCR不仅完成了PCR从定性到定量的提升,更由于灵敏度高、特异性强而降低了相互污染的风险。本试验可以快速检测原料乳中的S. marcescens,可有效提升原料乳的质量安全检测水平,促进乳制品行业的健康可持续发展。

