生后营养过剩对雌性SD大鼠生长的影响
陈丹纯,唐本玉,郭 蕾,李茵雅,李 丹,林 娟,朱顺叶
(中山大学附属第三医院儿科,广东广州510630)
社会的进步与物质的丰富让人们更加关注儿童的营养及生长发育等问题。生命早期营养的质量以及营养的变化可能会永久性地影响器官乃至系统的成熟,并且与生后的一些非传染性疾病(尤其是高血压等心血管疾病,糖尿病、胰岛素抵抗等代谢紊乱和碳水化合物不耐受等疾病)存在与否相关[1-3]。国内外研究均表明生命早期营养状态与后续健康息息相关,但关于宫内发育迟缓生后营养是否过剩对后续生长影响的研究相对匮乏。因此,本研究通过孕期限食法建立宫内发育迟缓模型;采用哺乳期小窝模型[4]及断乳后45%脂肪供能的高脂饲料[5]的方法,创造生后营养过剩条件,旨在研究生后营养过剩对生后生长的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 SD大鼠(雌性30只,体质量230~280 g;雄性15只,体质量280~320 g),购自中山大学实验动物中心(许可证号SCXK(粤)2016-0029)。普通饲料由中山大学实验动物中心提供,许可证号SCXK(京)2014-0010。高脂饲料由广东省实验动物中心提供,许可编号SCXK(粤)2013-0002。原材料包括:酪蛋白、蛋白、L-胱氨酸、玉米淀粉、麦芽糖糊精、蔗糖、纤维素、豆油、矿物质AIN-93、维生素AIN-93及氯化胆碱;各组饲料成分含量比及占总热能百分比为:碳水化合物35%,脂肪45%,蛋白质20%,总热量4.73 kcal/g。饲养条件:屏障环境中,温度20~26℃,相对湿度40%~70%,分笼饲养,均自由摄水,自由摄食(除实验条件要求)。本次研究经中山大学实验动物伦理委员会批准,批准批号为IACUC-DB-2017-0913。
1.1.2 药物与试剂 过氧化物酶法血糖浓度测定试剂盒、血清IGF-1、IGF-BP3、胰岛素ELISA试剂盒,购自上海酶联生物科技有限公司;10%水合氯醛购自广州广誉生物科技有限公司。
1.2 动物实验
1.2.1 动物模型 将实验SD(Sprague Dawley)大鼠适应性喂养1周后,将雌雄鼠随机按2∶1(雌鼠30只,雄鼠15只)合笼交配,合笼第2天起每天做雌鼠阴道分泌物涂片,普通光学显微镜下观察,以阴道涂片发现精子为受孕第1天。确认受孕后,将受孕父母代雌鼠随机分为限食组和正常饮食组,且均单只单笼喂养,自由摄食摄水;受孕第7天起,限食组雌鼠每日每只饲料5~7 g喂养,自由摄水;正常饮食组雌鼠仍自由摄食摄水。分娩后,从限食组选择体质量较对照组平均体质量低2个标准差或以上的子代大鼠作为宫内发育迟缓大鼠模型。以体质量及鼻肛长位于正常对照组平均身长及体质量-2SD(标准差)以上者,定义为发生追赶。
1.2.2 实验分组 分别选择58只子代雌性IUGR大鼠作为宫内发育迟缓组(即I组),58只对照组子代雌性大鼠作为宫内正常发育组(即C组);再将宫内发育迟缓组随机分为小窝组(S组,4只一笼,n=28)和对照组(C组 10只一笼,n=30),即IS组、IC组;对照组随机分为小窝组(S组,4只一笼,n=28)和对照组(C组 10只一笼,n=30),即CS组、CC组。每笼配一只父母代哺乳雌鼠,子代大鼠自由摄水,父母代雌鼠自由摄食摄水,哺乳21 d后断乳。断乳后父母代雌鼠与子代雌鼠分笼饲养,其中IS组与CS组继续原4只一笼饲养,IC组与CC组分别随机分为4只一笼饲养。另,IS组、CS组均予以高脂饲料喂养,IC组、CC组均予以普通饲料喂养。
1.2.3 观察指标 ①每周测量子代雌鼠体质量及鼻肛长,并记录;②在大鼠各生长发育期(生后21、35、45和75 d)从各组中取出6~8只大鼠,禁食12 h,依次称重记录后,予以3~5 mL/kg水合氯醛腹腔注射麻醉大鼠,开腹行腹主动脉取血,后采用过氧化物酶法测大鼠空腹血糖(fasting blood glucose,FBG),ELISA法检测外周血空腹胰岛素(fasting insulin,FINS)、胰岛素样生长因子1(insulin-like growth factor-1,IGF-1)及胰岛素样生长因子结合蛋白3(insulin-like growth factor binding protein 3,IGF-BP3);③计算胰岛素敏感指数(insulin sensitivity index,ISI):ISI=ln[1000/(FINS×FBG)];其中,FINS为空腹胰岛素(mU/L),FBG为空腹血糖(mmol/L)[6]。
1.3 统计学方法
应用SPSS 20.0统计软件进行统计分析,符合正态分析的计量资料以均数±标准差()表示,所有计量数据均保留至小数点后3位。各组之间的差异比较,符合正态分布且方差齐的数据,采用两组间t检验,不符合正态分布的数据,采用两组间秩和检验。多组计量资料数据比较,数据呈非正态或方差不齐时采用Kruskal-Wallis H检验。变量间采用多元线性回归分析(逐步法),以FINS、FBG、ISI、IGF-1及IGF-BP3等指标分别为因变量,以发育周期、宫内发育情况、生后喂养情况等指标为自变量。均设定P<0.05为差异有统计学意义。
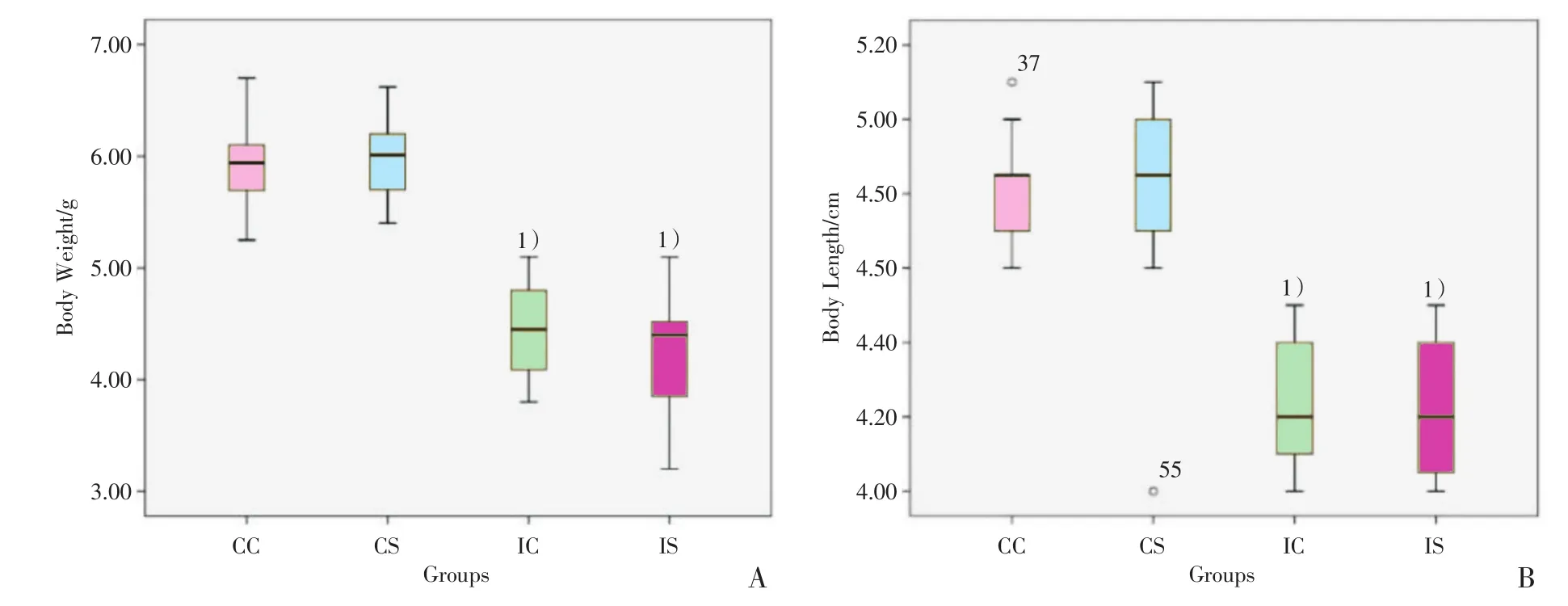
图1 各组大鼠出生体质量及鼻肛长箱式图Fig.1 Birth weight and birth length of rats in each group
2 结果
2.1 宫内发育情况对大鼠出生状态及体格发育的影响
观察宫内发育迟缓的仔鼠生后行动较迟缓,皮肤光泽稍暗,吮乳反应较迟钝,对照组大鼠行动敏捷,皮肤光滑,膘肥体壮,吮乳反应良好。CC组与CS组出生体质量及出生鼻肛长均数分别比较,均无统计学意义;IC组与IS组出生体质量及出生鼻肛长均数分别比较,也无统计学意义(图1)。而IC组及IS组的出生体质量均比CC组出生体质量低2个标准差,提示宫内发育迟缓(IUGR)大鼠造模成功。
2.2 哺乳期小窝喂养和断乳后高脂饮食对大鼠体格发育的影响
各组大鼠出生后每周测量其体质量及鼻肛长,IS组大鼠在生后第1周体质量及鼻肛长即追赶甚至超过了CC组(P<0.05,图2),其体质量及鼻肛长明显高于IC组,且差异随着周数的增长而变得明显(P <0.05,图2);IC组大鼠的生后第2周,体质量及鼻肛长相较于CC组大鼠实现了追赶,以后两组每周的体质量及鼻肛长的差异均无统计学意义(P>0.05,图2)。另外,CS组大鼠的体质量及鼻肛长均随着周数的增大,分别与CC组大鼠体质量及鼻肛长的差异愈发明显(P<0.05,图2)。说明宫内发育迟缓生后正常饮食的大鼠亦可实现了体质量及鼻肛长的追赶,但宫内发育迟缓生后营养过剩,不仅可使IS组较IC组在更短时间内实现体质量及鼻肛长的追赶,且明显超过IC组;另外,正常宫内发育的大鼠生后的营养过剩,使得CS组生后每周的体质量及鼻肛长随着营养的增加,逐渐超过CC组。
2.3 不同发育周期各组大鼠血清空腹胰岛素、空腹血糖、IGF-1和IGF-BP3水平的比较
表1可见,将宫内发育情况、生后喂养情况、发育周期作为自变量,将FINS、FBG、ISI、IGF-1、IGF-BP3分别作为因变量,进行多元线性回归分析,对于 FINS、FBG、IGF-1和 IGF-BP3,有直线关系的均只为生后喂养情况,且回归系数为正值(P<0.05,表1);ISI而言,也仅跟生后喂养情况具有直线关系(P<0.05,表1),回归系数为负值。即表明,生后营养过剩可对血清FINS、FBG、IGF-1、IGF-BP3产生正向影响,而对ISI产生反向影响。
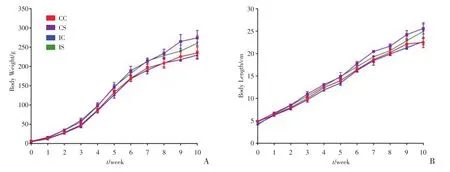
图2 各组大鼠体质量和鼻肛长增长趋势图Fig.2 Body weight and body length trend
以上为线性回归分析结果,为了进一步表明各组间各指标之间的差异,绘制柱状图如下:
进一步进行统计分析,IS组血清胰岛素及血糖在不同发育期均明显高于IC组(P<0.05,图3A-C),即IS组在不同发育周期均出现了胰岛素且血糖升高,观察胰岛素敏感指数亦可发现,IS组的ISI明显低于IC组(P <0.05,图3A-C);CS组的血清胰岛素及血糖在生后75天高于CC组,即成年期出现了胰岛素和血糖比对照组升高的情况,同时在生后75天亦出现ISI水平的降低。
IS组的IGF-1及IGF-BP3水平在不同发育周期均较IC组高(P<0.05,图3D-E);而CC组与CS组、CC组与IC组在不同发育周期中,IGF-1及IGF-BP3水平差距不明显,经统计学分析亦提示差异无统计学意义(P<0.05,图3D-E)。
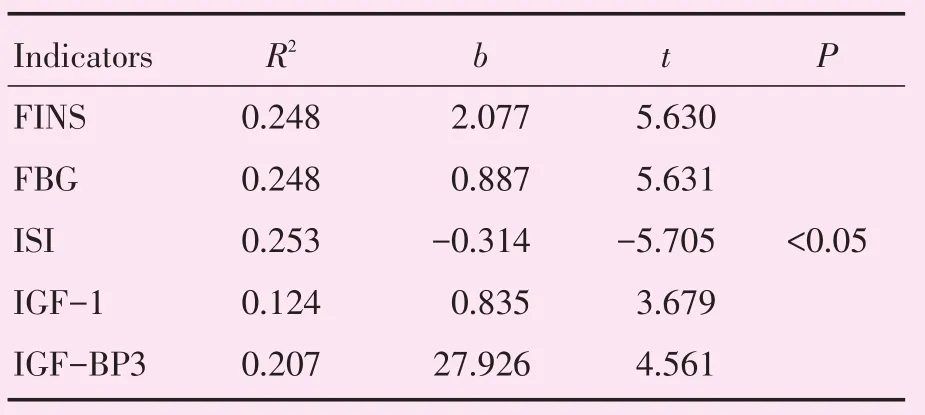
表1 各指标线性回归分析结果Table 1 Regression analysis of various indicators
3 讨论
宫内发育的营养情况直接影响仔鼠出生时的体格发育指标。宫内营养的限制不仅使出生仔鼠体质量下降,鼻肛长缩短,并且影响了仔鼠的状态、行动以及反应。多项研究表明,出生时的低体质量与成人后的多种心血管疾病及糖尿病的发生密切相关[7],因此宫内发育的营养需要格外关注。
无论是宫内发育正常组还是宫内发育迟缓组,生后的营养过剩,均可引起体质量和鼻肛长相比生后正常喂养的大鼠同期时增加。提示无论宫内发育迟缓与否,生后早期的营养过剩可加速生长发育,生后营养是生长发育的关键因素之一。而IUGR大鼠中,生后营养过剩的大鼠和普通喂养的大鼠均出现了生长性追赶,但生后普通喂养的大鼠实现生长追赶的时间较营养过剩的大鼠推迟一周。提示IUGR大鼠生后即使普通正常喂养,也可实现生长追赶,最终成年时还是可达到总体的平均水平。临床资料表明,大多数的SGA患儿生后早期可出现快速的生长追赶[8]。
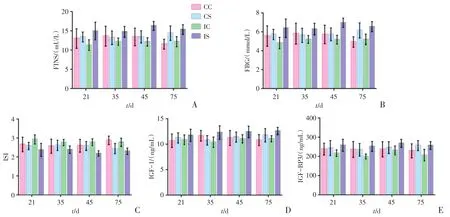
图3 各组大鼠血清各指标水平误差条形图Fig.3 Error bars of serum indicators in rats of each group
IGF-1对正常的胎儿和胎盘生长和分化至关重要,且与生后的生长发育密切相关;IUGR被认为是IGF-1缺乏的新病症[9]。生后IGF-1水平与幼年期的生长发育密切相关[10]。IGF-BP3有运送和调节IGF-1的功能,其合成受GH-IGF轴的调控,因此IGF-1及IGF-BP3均为反映GH-IGF轴功能的指标,机体通过GH-IGF轴的调节促进体格生长[11]。研究结果显示,IUGR大鼠中,生后营养过剩的大鼠在各个不同发育期的IGF-1及IGF-BP3水平均较生后正常喂养的大鼠高;而在宫内发育正常的大鼠中,无论生后正常喂养还是高脂喂养,IGF-1及IGF-BP3均无差异。提示IUGR大鼠可能在宫内已经实现代谢途径的调整来适应慢性营养不足,且生后可适应正常喂养而实现追赶性生长;过高的能量供给导致IGF-1和IGF-BP3升高,可实现快速的生长追赶。但在快速追赶的同时,因宫内代谢途径的调整导致生后在过度喂养的情况下,储存尽可能多的能量,最终引起代谢紊乱,与Roth等[12]研究结果一致。
在SGA患儿中低出生体质量状态与胰岛素抵抗相关,而生后第一年的营养干预和胰岛素抵抗无关,是否发生追赶与胰岛素抵抗无关,SGA患儿的胰岛素抵抗是宫内就存在的,并持续到生后一段时间[13]。但也有研究[14-15]认为,小于胎龄儿脐带血的胰岛素水平与适于胎龄儿婴儿的脐带血胰岛素水平无差异,IUGR患儿在新生儿期就可出现胰岛素水平的升高及胰岛素敏感度的下降。国内更多研究[16]认为SGA患儿出现生长追赶后,有胰岛素抵抗的倾向,且胰岛素抵抗程度与生长追赶程度相随,而未出现生长追赶的并未出现胰岛素抵抗。本研究发现,IUGR大鼠中生后营养过剩的大鼠较生后正常喂养的大鼠在各个发育期,均出现了空腹胰岛素、空腹血糖水平的同步增高,且ISI水平下降;而在宫内发育正常的大鼠中,生后营养过剩的大鼠仅在生后75 d(即成年期)出现空腹胰岛素和空腹血糖水平的增高,ISI的下降。经多元线性回归分析亦表明,生后营养过剩可对FINS、FBG、IGF-1、IGF-BP3的升高产生促进作用,而对胰岛素敏感性产生抑制作用。
综上,本研究中宫内发育迟缓的大鼠均实现了生长性追赶,生后营养过剩的大鼠出现整个生长发育期的胰岛素敏感指数下降。我们推测,小于胎龄儿生后正常的喂养,其可通过自身调整来达到生长追赶,同时不出现胰岛素敏感性下降;而生后营养过剩,无论宫内发育迟缓与否,均可能导致胰岛素敏感性下降,且对于IUGR大鼠,胰岛素敏感性下降可贯穿整个生长发育期及成年期,而宫内发育正常的大鼠仅在成年期出现,即宫内发育迟缓对于高能量饮食的适应力更差,其需要付出更大程度代谢紊乱的代价来调整机体的生长发育。我们建议,在临床中无论是宫内发育正常还是宫内发育迟缓的儿童,均需要更加关注生后的营养,防止营养过剩引起幼儿期或成年期发生代谢性紊乱,影响生命质量;IUGR生后正常喂养的大鼠也可实现生长追赶且未出现胰岛素敏感性下降,因此对于小于胎龄儿需要定期监测生长发育情况,及时评估决定是否干预,在保证适度的生长追赶同时减少日后代谢紊乱的风险。孕母需要科学妊娠,预防IUGR发生。

