盐酸小檗碱对2型糖尿病大鼠血管平滑肌细胞增殖、迁移的影响
殷文贤,赵 萌,吴知桂,顾 立,陈美娟△
(1.西南医科大学附属中医医院药剂科,四川泸州 646000;2.西南医科大学药理学教研室,四川泸州 646000)
2型糖尿病(type 2 diabetes mellitus,T2DM)因其慢性并发症而具有较高致残、病死率。黄连治疗消渴病古有记载,盐酸小檗碱为黄连提纯物,主要用于胃肠道感染。近年发现盐酸小檗碱可用于T2DM治疗,机制涉及降压、降脂、减重、抗血小板聚集、胰岛素增敏等[1-3],但尚少见盐酸小檗碱对T2DM模型动物血管平滑肌的作用报道。故本研究拟通过观察不同浓度盐酸小檗碱对T2DM大鼠血管平滑肌细胞(vascular smooth muscle cells,VSMCs)增殖、迁移及转化生长因子β1(transforming growth factor β1,TGF-β1)的影响,探讨其对T2DM大鼠VSMCs的保护作用及可能机制,为小檗碱用于T2DM并发症提供实验依据。
1 材料与方法
1.1试验药物 盐酸小檗碱,中国食品药品检定研究院提供,黄色粉末,批号115-53-7;卡托普利(汕头金石制药厂),批号091023;链脲佐菌素(美国Sigma公司),批号S0130。
1.2动物 30只体质量(200±20)g的6~7周龄健康雄性SD大鼠,购自西南医科大学实验动物中心,Ⅰ级动物,合格证号:川实动字第017号。实验经西南医科大学动物实验伦理委员会批准(2016-021)。
1.3试剂 胰蛋白酶,美国Sigma公司;DMEM/F12培养基,美国Gibco公司;CCK-8,碧云天生物技术研究所;Transwell小室,北京Vigorous公司;TGF-β1 ELISA试剂盒,上海蓝基生物科技有限公司;胰岛素放疫试剂盒,北京普尔伟业生物科技有限公司。
1.4仪器 倒置相差显微镜,日本Olympus公司;CO2培养箱,日本Sanyo公司;一次性6、24、96孔培养板(美国Corning公司);酶标分析仪(北京普朗新技术有限公司)。
1.5方法
1.5.1T2DM模型的构建 大鼠适应性喂养1周后,随机选取20只造模,高糖高脂饲料(蔗糖20.0 g,猪油10.0 g,胆固醇2.5 g,胆酸盐1.0 g,常规饲料66.5 g)喂养2个月,1个月时腹腔注射链脲佐菌素25 mg/kg;另10只为正常组,常规饮食喂养2个月,1个月时腹腔注射等量柠檬酸盐缓冲液。两组实验同时进行。2个月后进行评价,以空腹血糖大于7.0 mmol/L、餐后2 h血糖大于11.1 mmol/L且伴有胰岛素敏感指数(insulin sensitivity index,ISI)下降(P<0.05)的判定为造模成功,ISI=ln[1/(Ins×FPG)]。
1.5.2VSMCs培养及分组 分别将正常鼠和T2DM模型鼠脱颈处死后,迅速取出胸主动脉,除去结缔组织并刮去内膜后剪成1 mm×l mm×l mm左右的组织小块,放入加了3 mL DMEM培养基(含20%胎牛血清)的培养瓶,在CO2培养箱(37 ℃、5%CO2)内进行原代培养并完成传代。分别选取鉴定后的形态良好、生长旺盛的4~6代对数生长期的传代细胞备用。正常组为正常大鼠的VSMCs;T2DM模型大鼠的VSMCs分别用于模型组、阳性对照组、治疗组1~5。
1.5.3细胞增殖实验 将正常鼠和T2DM模型鼠的VSMCs悬液细胞浓度均调整至1×105/mL,接种于96孔板中,90 μL每孔,8个组每组5个复孔,正常加90 μL含10%血清的DMEM培养基。CO2培养箱(37 ℃、5%CO2)中培养24 h后,空白组、模型组和正常组每孔各加10 μL无血清DMEM,阳性对照组加50 μg/mL的卡托普利10 μL,治疗组1~5加100、50、25、12.5、6.25 μg/mL的盐酸小檗碱各10 μL[4],放CO2培养箱中培养48 h。48 h后,每孔加入CCK-8 10 μL,培养1 h后在450 nm波长下酶标仪检测各孔的吸光度A值。细胞增殖抑制率=[1-(A加药-A空白孔)/(A不加药-A空白孔)]×100%。
1.5.4细胞迁移实验 选用二十四孔培养板放入Transwell小室,上室加入细胞浓度调整为2.0×105/mL的无血清DMEM培养基200 μL,下室治疗1~5组依次加入浓度为100、50、25、12.5、6.25 μg /mL的盐酸小檗碱样品各60 μL,阳性对照组加50 μg/mL的卡托普利60 μL,正常组加等体积无血清DMEM培养基,CO2培养箱(37 ℃、5%CO2)孵育48 h,从小室取出后擦去上室滤膜内表面及基质胶残存的细胞,然后用PBS液清洗迁移到滤膜外表面的细胞,固定、染色后,置镜下随机选5个高倍视野,记录膜上细胞总数目。重复3次,取平均值。
1.5.5双抗体夹心ELISA测定TGF-β1水平 将细胞浓度均调整为1×105/mL,分别接种于96孔板中,分组、加药方法同1.5.3。CO2培养箱(37 ℃、5%CO2)培养48 h后用无菌管收集细胞悬液,3 000 r/min离心20 min,取上清液。每孔所得上清液均分为3份,分别将各组上清液加入反应孔中,洗涤后加入生物素化的抗大鼠TGF-β1抗体孵育60 min,然后加入辣根过氧化物酶(HRP)标记的亲和素,孵育30 min后加入显色剂37 ℃避光显色15~20 min,随后加入终止液,混匀后5 min内测量A值,通过绘制标准曲线求出TGF-β1水平。上述各步骤加入的试剂均为100 μL/孔。

2 结 果
2.1T2DM大鼠模型的建立 模型大鼠经高糖高脂喂养2个月+腹腔注射链脲佐菌素后,食量、饮水量、尿量增加明显,活动减少,体质量较正常组明显降低(P<0.01);与正常组比较,血糖(空腹、餐后2 h)、血胰岛素明显增加(P<0.01),ISI明显降低(P<0.05)。见表1。

表1 大鼠体质量、血糖、胰岛素敏感指数比较
*:P<0.05,#:P<0.01,与正常组比较
2.2VSMCs鉴定
2.2.1形态学 正常大鼠VSMCs需6~8 d由组织块中爬出,需20 d铺满培养瓶。显微镜下细胞呈细扇形、梭形、三角形或不规则形,胞质密度高,胞浆丰富,不透明,有多个细胞突起,核卵圆居中,有多个核仁。细胞生长致密平行排列成束状,重叠生长区域呈“峰-谷”状。T2DM大鼠VSMCs需3~4 d就能从组织块中爬出,只需8~12 d铺满培养瓶。细胞形态、胞浆、胞质、胞核均与正常大鼠VSMCs相似,但细胞生长更为致密,重叠生长成束、成网、呈旋涡状。见图1。

A:正常大鼠VSMCs排列呈“峰-谷”状;B:T2DM大鼠VSMCs排列呈旋涡状
图1 倒置相差显微镜下正常大鼠及糖尿病大鼠VSMCs(×100)
2.2.2生长曲线 VSMCs生长曲线近似“s”形,前3 d增殖旺盛,呈对数生长,3~5 d生长速度减慢,5~7 d后细胞逐渐死亡。T2DM大鼠胸主动脉VSMCs生长速度明显快于正常组,呈异常增殖状态。见图2。

图2 正常组和模型组大鼠VSMCs生长曲线
2.2.3SM α-actin鉴定 大鼠VSMCs的胞浆经α-actin特异性染色呈棕黄色,胞核苏木素染呈蓝色,低倍镜下见细胞大小不等、形态各异(长梭形、扇形、三角形及不规则形);高倍镜下胞浆内见大量棕黄色、与细胞长轴平行的α-actin。模型组与正常组细胞比较胞浆棕黄色更深,同一视野下细胞数更多。见图3。
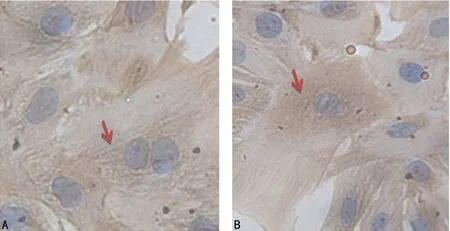
A:正常组;B:T2DM
图3 大鼠VSMCs的SM α-actin鉴定(×400)
2.3不同浓度盐酸小檗碱对T2DM大鼠VSMCs增殖的影响 不同浓度盐酸小檗碱对正常组大鼠和T2DM大鼠VSMCs的增殖均可产生抑制作用,抑制强度与浓度呈正相关。见图4。

图4 不同浓度盐酸小檗碱对正常组和模型组VSMCs增殖的抑制率曲线
与正常组比较,模型组大鼠VSMCs增殖显著增强(P<0.01);与模型组比较,各治疗组及阳性对照组均VSMCs增殖明显受抑制(P<0.01);各治疗组间比较差异有统计学意义(P<0.05);与阳性对照组比较,治疗组1、2的抑制作用较强(P<0.01),治疗组3则与之相当(P>0.05),治疗组4相对较弱(P<0.05)。见表2。
2.4不同浓度盐酸小檗碱对T2DM大鼠VSMCs迁移的影响 模型组穿膜细胞数较正常组明显增加(P<0.01);各治疗组穿膜细胞数均少于模型组(P<0.01),盐酸小檗碱各组穿膜细胞数均减少,且与浓度呈负相关(P<0.01);治疗组1穿膜细胞数明显小于阳性对照组(P<0.01),治疗组3~5对糖尿病VSMCs迁移的抑制作用不及阳性对照组(P<0.05)。见表2。

表2 盐酸小檗碱对T2DM大鼠VSMCs增殖、迁移、TGF-β1水平的影响
a:P<0.05,aa:P<0.01,与正常组比较;b:P<0.01,与模型组比较;c:P<0.01,与阳性对照组比较;d:P<0.05,与治疗组1比较;e:P<0.05,与治疗组2比较;f:P<0.05,与治疗组3比较
2.5不同浓度盐酸小檗碱对T2DM大鼠VSMCs培养液中TGF-β1水平的影响 与正常组相比,模型组TGF-β1水平明显增高(P<0.01);与模型组相比,阳性对照组及治疗组1~4 TGF-β1水平均较低(P<0.05),治疗组5差异无统计学意义(P>0.05)。与阳性对照组相比,治疗组1、2 TGF-β1水平较低(P<0.05),治疗组3~5与之差异无统计学意义(P>0.05)。见表2。
3 讨 论
T2DM的慢性并发症(如糖尿病肾病、视网膜病、外周血管及冠脉动脉粥样硬化)是其致残致死的主要原因,其病变基础多为动脉粥样硬化(atherosclerosis,AS)。VSMCs的过度增殖、迁移及表型转变作为AS进程的关键因素,而成为T2DM慢性并发症的发病基础。TGF-β1是调控VSMCs增殖凋亡平衡的重要细胞因子,能诱使细胞外基质沉积和成分改变,促进细胞生长、迁移。研究发现干预TGF-β1能从基因水平抑制P-53和c-jun的表达,从而延缓T2DM大血管病变[5-6]。
《血管紧张素转换酶抑制剂在冠心病患者中应用中国专家共识》[7]建议,卡托普利适用于所有确诊的冠心病或其他AS患者。也有研究发现卡托普利能调节VSMCs增殖、凋亡因子表达[8],故本实验选用卡托普利作为阳性对照。本研究结果发现,盐酸小檗碱可减少T2DM大鼠VSMCs增殖与迁移,作用强度与其浓度呈正相关,与LEE等[9]发现小檗碱能抑制大鼠VSMCs增殖的结果一致,且100 μg/mL盐酸小檗碱的作用明显强于卡托普利(P<0.01)。结果提示盐酸小檗碱从抑制VSMCs的增殖迁移来防治T2DM并发症可能是有效的;实验进一步发现盐酸小檗碱能显著降低T2DM大鼠VSMCs中TGF-β1水平,盐酸小檗碱100、50 μg/mL组效果优于阳性对照组(P<0.01),提示盐酸小檗碱抑制T2DM大鼠VSMCs增殖迁移可能与下调TGF-β1水平有关。Smad依赖性信号通路是TGF-β1诱导纤维化的最经典的信号通路[10],其通过Smads蛋白将信号由细胞外传导到细胞内,在细胞水平发挥诱导细胞凋亡、促进新生血管形成、调控细胞迁移、调节细胞周期等作用。盐酸小檗碱下调TGF-β1是否通过该通路或是通过其他通路[11](如P38MAPK通路、SGK1通路、Notch、Wnt等)有待进一步研究。
综上所述,盐酸小檗碱对T2DM大鼠VSMCs有明显抑制增殖、迁移的作用,该作用可能与降低TGF-β1水平有关。抑制作用随盐酸小檗碱浓度增加而增强,高浓度盐酸小檗碱(>50 μg/mL)的作用强于卡托普利,该发现为盐酸小檗碱用于T2DM并发症治疗提供了新的实验依据。

