HIF-1α经TRAP1调节肝癌细胞HepG2的EMT作用研究
杨 柳,赵英琦,黄晓妍,王梦璇,陈文君,孙 易,吕元明
(桂林医学院公共卫生学院卫生毒理,广西桂林 541000)
肝癌是最常见的恶性肿瘤之一,其全球发病率位居癌症第6位,肝癌的发生、发展是一个多基因、多途径、多阶段的复杂过程,因此只有深入研究肝癌分子作用机制并从中寻找作用靶点才能达到彻底治愈肝癌的目的[1]。肿瘤坏死因子受体相关蛋白1(TRAP1)是热休克蛋白90(HSP90)家族的成员之一,在癌症、神经变性和其他疾病中具有不同的作用[2]。研究表明TRAP1是参与调节癌细胞能量代谢的分子伴侣,在肿瘤细胞的异常增殖、药物耐受及抗凋亡信号通路活化等方面有着重要的作用。上皮细胞-间充质转化(EMT)是指上皮细胞通过特定程序转化为具有间质表型细胞的生物学过程[3],缺氧和EMT都是肿瘤侵袭转移中的重要事件,缺氧导致的EMT与肿瘤的进展密不可分[4]。本文旨在对正常肝细胞和肝癌细胞中TRAP1的表达水平,以及TRAP1在缺氧诱导因子-1(HIF-1α)触发的EMT中的作用进行研究,探讨HIF-1α是否是经TRAP1调节肝癌的EMT过程。
1 材料与方法
1.1材料与试剂 肝癌细胞株 HepG2及人正常肝细胞株 LO2由贵阳医科大学马璐教授馈赠;DMEM 高糖培养基(美国Gibco公司);胰酶(美国Life Technologies公司) ;胎牛血清(美国Sera Pro公司);小鼠抗β-actin单抗和HRP标记的山羊抗小鼠IgG(北京中杉金桥),TRAP1兔抗人多克隆抗体和HRP标记的兔抗鼠IgG(美国Cell Signaling Technology公司);高灵敏化学发光检测试剂盒(上海七海复泰公司);TRizol和 DEPC (美国Invitrogen公司) ;RT-PCR试剂盒(日本TOYOBO公司),QPCR试剂盒(天根公司);噻唑蓝(MTT)和二甲亚砜(DMSO)(美国Sigma公司);DAPI(美国Sigma公司);4%多聚甲醛(美国Solarbio公司);exa Fluor594-conjugate Goat anti-Rabbit IgG(H+Lp,美国Proteintech公司);Triton X-100(美国Solarbio公司)。
1.2实验方法
1.2.1细胞培养 肝癌细胞株HepG2和正常肝细胞株LO2,37 ℃、饱和湿度、5%CO2条件下用含10%灭活胎牛血清DMEM高糖培养基培养,每2~3天传代1次。取对数生长期细胞用于实验。
1.2.2MTT检测细胞存活率 取对数生长期的HepG2细胞和LO2细胞接种于96孔板,细胞接种密度为1×104/孔,分别培养0、24、48、72、96 h后每孔加入5 mg/mL MTT溶液20 μL,继续培养4 h,离心弃上清液,加入100 μL DMSO,振荡混匀5 min, 使用酶标仪于490 nm波长下检测各孔吸光度(A)值。每组设5个复孔,实验重复3 次。根据A值和时间绘出细胞的生长曲线。
1.2.3细胞划痕实验 在6孔板中分别接种HepG2细胞和LO2细胞,细胞接种密度为5×105/孔。接种后24 h用移液器枪头划痕,使用PBS清洗3~5次,完全除去脱落细胞。随后加入2 mL基础培养基,于37 ℃,5%CO2条件下在培养箱内培养。划痕后0、24、48 h时间点对细胞划痕结果拍照。ImageJ软件处理图片并测量划痕面积。伤口愈合百分比=(初始划痕面积-某时间点划痕面积)/初始划痕面积。
1.2.4免疫荧光实验 HepG2和LO2细胞按3×104/孔接种于放有细胞爬片的12孔板,37 ℃,5%CO2培养箱培养24 h,至细胞融合度达到50%。使用4%多聚甲醛固定细胞20 min,PBS清洗5 min×3次。0.2% Triton X-100的PBS溶液通透15 min,PBS清洗5 min×3次后,1%BSA的PBS室温封闭1 h。使用TRAP1一抗孵育,4 ℃过夜后PBS清洗,二抗Alexa Fluor594室温避光孵育1 h,PBS清洗。鬼笔环肽Phalloidin-DMSO工作液室温染色90 min,PBS清洗后,DAPI染色15 min,PBS清洗。取出爬片,缓冲甘油封片,荧光显微镜激发光波长488 nm下观察拍照。 Image J软件对图片进行溶图和定量分析。
1.2.5Western Blot检测细胞蛋白表达 取对数生长期HepG2和LO2细胞用胰酶消化,加裂解液裂解细胞,提取总蛋白。10%十二烷基硫酸钠-聚丙烯酰胺(SDS-PAGE)电泳分离并转膜,5%胎牛血清白蛋白封闭孵育1 h,加入β-actin,TRAP1的一抗,4 ℃孵育过夜后用TBST漂洗3次;二抗37 ℃孵育1 h,TBST 漂洗3次,化学发光,曝光显影后存取胶片拍照带并使用Image J软件进行灰度值分析。
1.2.6实时荧光定量 PCR(RT-qPCR) 取对数生长期 HepG2细胞和LO2细胞经胰酶消化,加入Trizol提取总RNA,反转录合成cDNA,进行RT-qPCR检测。使用Primer 5.0进行引物设计,ABI7500仪器进行检测。扩增条件为:55 ℃ 10 min、95 ℃ 30 s;95 ℃ 30 s、55.0 ℃ 30 s;72 ℃ 1 min、60 ℃ 1 min,共40个循环。GAPDH作为内参照,采用2-ΔΔCt方法分析检测结果,实验重复3 次。

表1 TRAP1及GAPDH引物序列
2 结 果
2.1HepG2细胞增殖能力高于LO2MTT实验结果表明,肝癌细胞株HepG2的增殖能力高于人正常肝细胞株LO2,特别是第5天测得HepG2细胞和LO2细胞的A值分别为1.591±0.036和1.043±0.007,HepG2的活力比LO2高1.525倍(P<0.01),见图1。
2.2Hep2的细胞迁移能力高于LO2细胞划痕实验表明,LO2和HepG2的24 h伤口愈合百分比统计结果分别为(27.03±0.15)%和(49.68±0.84)%;LO2和HepG2的48 h划痕面积统计结果分别为(40.55±0.69)%和(70.04±2.27)%。结果表明LO2细胞划痕愈合速度明显低于HepG2细胞。与0 h相比,24、48 h的细胞伤口愈合百分比差异有统计学意义(P<0.001),见图2。
2.3HepG2中的TRAP1免疫荧光强度高于LO2通过对细胞骨架、细胞核及TRAP1定位免疫荧光染色,发现TRAP1明显定位于细胞核周围,并且与正常肝细胞LO2相比,肝癌细胞HepG2内的荧光强度显著增加,见图3。
2.4HepG2中TRAP1的蛋白及mRNA表达水平高于LO2在HepG2细胞中,TRAP1在蛋白和mRNA表达水平均高于LO2,其中TRAP1在LO2和HepG的WB灰度定量结果分别为0.591 3±0.008 0和0.728 7±0.005 4,TRAP1在LO2和HepG2细胞中的mRNA水平表达结果分别为1.000±0.000和6.274±0.215,TRAP1在肝癌细胞HepG2中的表达高于在正常肝细胞LO2中的表达,差异有统计学意义(P<0.01)。见图4。
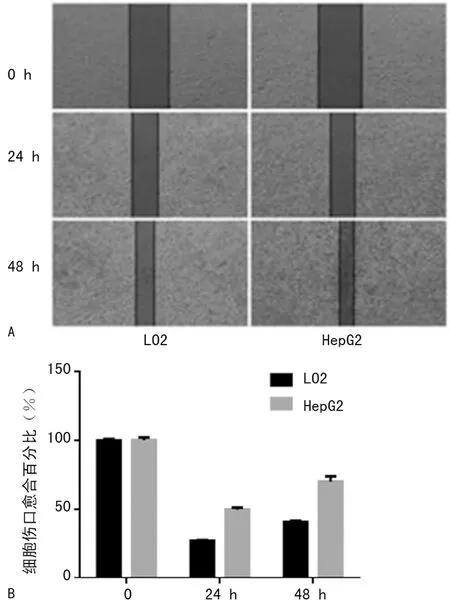
A:细胞划痕实验图;B:细胞划痕愈合能力定量分析图
图2 HepG2细胞和LO2细胞在各时间点伤口愈合能力
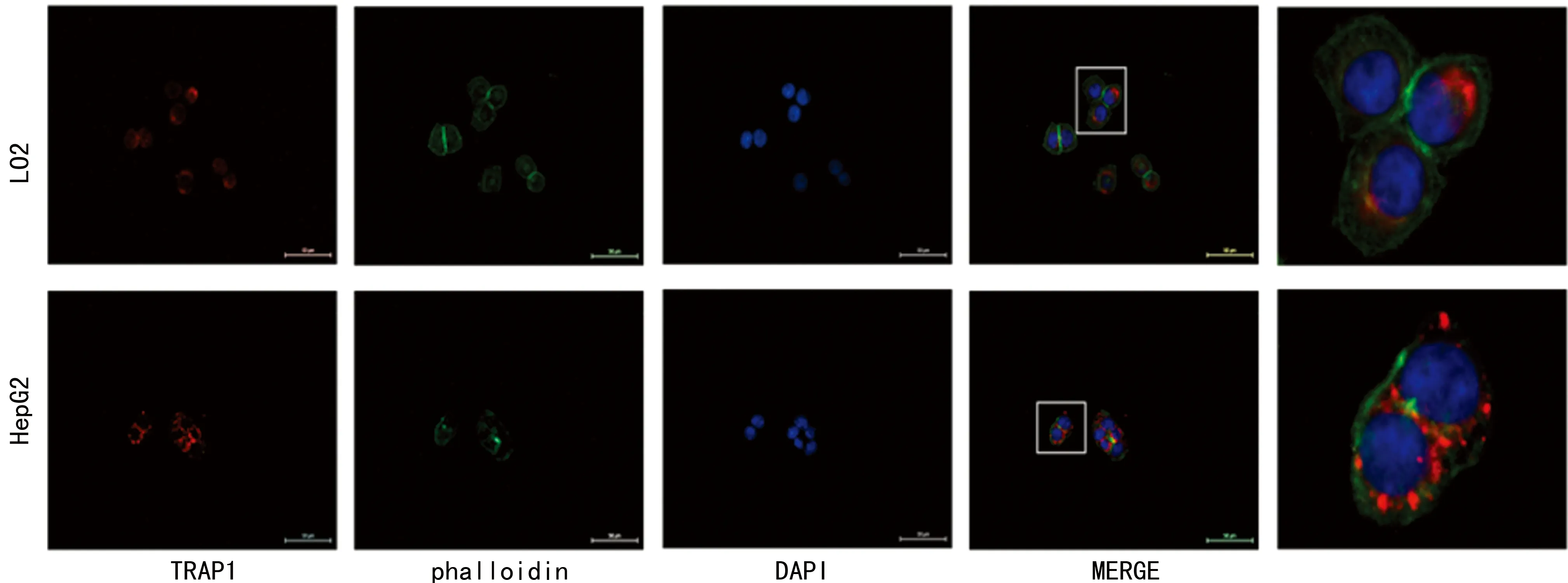
图3 TRAP1在HepG2和LO2细胞中的荧光定位(400×)
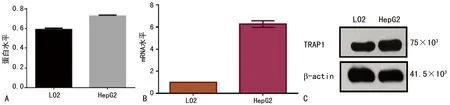
A:蛋白水平表达图;B:灰度定量分析图;C:mRNA水平表达图
图4 TRAP1在LO2和HepG2细胞中蛋白及mRNA水平的表达
2.5HepG2和LO2细胞中EMT相关基因表达变化与TRAP1表达关系 与EMT相关基因E-Cadherin在HepG2中的表达低于LO2(P<0.01);Vimentin在HepG2中的表达高于LO2(P<0.01);HIF-1α在HepG2中的表达高于LO2(P<0.01);见图5、6。

图5 与EMT相关基因在LO2和HepG2细胞中的表达结果

A:HIF-1α;B:E-cadherin;C:Vimentin
图6 与EMT相关基因在LO2和HepG2细胞中的表达结果定量分析
3 讨 论
本研究使用肝癌细胞HepG2和正常肝细胞LO2对HIF-1α是否经TRAP1调解肝癌的EMT过程进行研究。RT-qPCR、Western Blot及免疫荧光实验结果均表明,与正常肝细胞LO2相比,在增殖和迁移能力更强的肝癌细胞HepG2细胞中TRAP1表达增加。Western Blot结果表明,与LO2细胞相比,HepG2细胞的TRAP1的表达变化伴有EMT相关基因E-Cadherin表达下调和Vimentin表达上调,同时HIF-1α表达也出现上调。
在EMT过程中,原发灶的癌细胞由静止的上皮细胞转变成具有迁移能力的间充质细胞,从而具有了极强的侵袭性。细胞发生EMT之后,形态及生物学行为均发生了改变,在这个过程中钙黏蛋白中的E-cadherin是发生EMT的生物标志物之一,会随着EMT的发生而表达下降[5];同时,细胞骨架成分的Vimentin的增高也伴随着迁移能力增加,因而两者常用来标记EMT的发生[6]。缺氧是实体瘤最重要的微环境特点之一,缺氧的微环境促使肿瘤发生一系列的适应性变化,其中就包括肿瘤的侵袭转移能力增加和EMT过程[5]。缺氧条件下产生的最关键的转录因子HIF-1具有调节体内的能量代谢,促进血管生成等功能,它可以通过调节相关的转录因子(Snail、Slug、Twist、ZEB1、SIP1等),经转化生长因子-β(TGF-β)、Notch、Wnt/β-catenin等多个通路来促进肿瘤细胞迁移侵袭能力的增加[7-8]。HIF-1α高表达能引起乳腺癌、胰腺癌、口腔癌和肝细胞癌等多种肿瘤细胞发生EMT特征的转变,提高其侵袭转移能力[7,9-10]。TRAP1主要在线粒体内膜上表达,在维持线粒体的完整和功能、调节线粒体凋亡及参与调节线粒体呼吸和能量代谢转化中具有重要作用[11]。以往研究表明TRAP1的异常表达与多种肿瘤的发生、发展密切相关,在包括结肠癌、乳腺癌、前列腺癌和肺癌等多种癌症中表达上调[12]。干预TRAP1功能虽然可导致肿瘤细胞的死亡,但对正常细胞没有影响。在卵巢癌细胞MCF-7中过表达TRAP1基因可以抑制线粒体有氧呼吸,影响肿瘤细胞能量代谢,调控肿瘤恶性生物学行为[13]。TRAP1过表达与上皮性卵巢癌分化差,国际妇产科联盟分期、淋巴结转移和远处转移有关,导致其恶性表型的增加[14]。TRAP1的过表达参与结直肠癌的局部浸润,影响疾病发展和特异性生存。在非小细胞肺癌中,TRAP1表达上调导致该疾病复发风险增加[15-16]。本研究表明在肝癌细胞中,TRAP1高表达与EMT相关基因和HIF-1α表达变化同时存在,这说明TRAP1的变化可能是HIF-1α调节EMT的可能途径之一。但关于TRAP1在影响HIF-1α调节EMT的具体机制作用还需进行大量的深入研究。
综上所述,本研究结果初步表明HIF-1α可能是通过上调TRAP1影响肝癌细胞的EMT过程,TRAP1可能是一个潜在的肝癌生物标志物的筛选候选基因。该结果为今后肝癌的精准治疗寻找相应的治疗靶点提供了相关理论依据。

