miR-1197负调控Smad3抑制结肠癌细胞SW620的增殖、侵袭、迁移能力及S期细胞周期的聚集相关研究
张隆陶,王 劲,张贻庆,崔贵医
(焦作市人民医院 肝胆胰疝外科,河南 焦作454000)
结肠癌是常见的消化系统恶性肿瘤,目前手术是结肠癌主要的治疗手段,但术后复发和转移限制了治疗效果[1]。因此探究结肠癌的侵袭转移分子机制、寻找有效靶点对结肠癌的诊疗具有重要意义[2]。microRNA(miRNA)是近年来研究较多的一类内源性小分子非编码RNA,其在多种人类恶性肿瘤中出现表达异常,充当癌基因或抑癌基因,在恶性肿瘤的演进过程中发挥重要作用。经大量研究证实,在结肠癌细胞中存在多个miRNA分子表达异常,且与结肠癌患者的Dukes分期、分化程度、远处转移及生存预后等临床病理特征之间存在相关性,提示miRNA分子可能参与结肠癌的演进[3,4]。Smad3是转化生长因子β(TGF-β)信号通路中重要的转运蛋白[5],而TGF-β/Smads信号通路介导的EMT加速肿瘤细胞的侵袭及转移。本研究旨在分析miR-1197的表达水平与结肠癌的相关性,研究miR-1197与Smad3对结肠癌细胞增殖,迁移,侵袭能力及细胞周期的影响,探寻miR-1197在结肠癌中发挥的作用及其相关机制,为诊断及治疗结肠癌寻找新靶点。
1 材料与方法
1.1 研究样本采集
实验组织标本来自本院病理科2016年8月至2018年5月结肠癌患者的结肠癌组织及癌旁正常组织共50例,其平均年龄(65.04±12.38),均经组织病理学检查证实,未接受化疗和/或放疗,所有组织标本采集时先切成小块,迅速置于冻存管中液氮保存,6h 后移至-80℃冰箱备用。
1.2 外周血采集
纳入研究的结肠癌患者均于清晨空腹状况下进行外周静脉血抽取,采用一次性血清分离胶管,抽取外周静脉血约3 ml;待血清析出后以1 000 g离心10 min,取上层血清保存至-80℃冰箱待检测。
1.3 细胞培养
人类结肠癌细胞系SW620用含10%的胎牛血清(fetal bovine serum,FBS)、100 u/ml青霉素-链霉素溶液的DMEM培养基,置于含5%CO2,温度维持在37℃中的恒温箱中培养。
1.4 细胞转染
将生长状态良好的SW620细胞以约 5×105/孔铺于6孔板,待细胞在6孔板中的生长融合度达60%时,按照转染试剂LipofectamineTM2000 试剂说明书,分别转染 negative control miRNA mimics,miR-1197 mimics及共转染miR-1197 mimics和Smad3,分别作为对照组,miR-1197 mimics转染组和miR-1197 mimics+Smad3转染组。
1.5 qRT-PCR检测
按照Trizol试剂盒说明书中步骤提取细胞和组织总RNA,按照反转录试剂盒的说明书将总RNA进行RNA逆转录,合成cDNA。按照qRT-PCR 试剂盒说明书进行进行 PCR 反应。miR-1197水平以 U6 为内参,Smad3的mRNA水平以GAPDH 为内参,qRT-PCR结果以2-△△Ct表示,每个样本重复3次。
1.6 荧光素酶报告基因法检测
利用miRBase预测miR-1197与Smad3可能的作用位点。构建Smad3野生型3’-UTR荧光素酶报告基因质粒pMIR-Smad3-wt和突变型报告基因质粒pMIR-Smad3-Mut。将pMIR-Smad3-wt、pMIR-Smad3-Mut与miR-1197 mimics和negative control miRNA mimics共转染进SW620细胞,转染24 h后,去除培养基,每孔加入100 μl被动裂解液(Passive Lysis Buffer,PLB),室温下将培养,待细胞裂解后,将每组20 μl样本转移至发光用96孔板上,使用酶标仪配套软件进行结果分析。相对荧光素酶活性 (Relative luciferase activity)=萤火虫荧光素酶活性(Firefly luciferase activity)/海肾荧光素酶活性(Renilla luciferase activity)。
1.7 Western Blot
采用RIPA裂解液提取细胞或组织蛋白,通过BCA法测定蛋白浓度,按每泳道以50 μg总蛋白进行10% SDS-PAGE电泳分离蛋白,采用PVDF膜转移蛋白,5%脱脂奶粉室温封闭2 h。加入一抗兔抗Smad3(1∶500),内参GAPDH(1∶1 000),4℃孵育过夜。加入辣根过氧化物酶标记的羊抗兔二抗(1∶3 000)室温孵育1 h。ECL液暗室发光显影,采集图像并分析。
1.8 Tranwell实验检测细胞侵袭
将Matrigel凝胶置于4℃过夜;次日将液化的Matrigel与培养基以1∶6的比例稀释。在上室加入50 μl Matrigel 稀释液,以包被滤膜;将培养板置于孵箱中4 h,令包被液晾干。取生长状态良好的各组细胞,胰蛋白酶消化并使用含10% BSA的培养基重悬细胞,调整细胞密度为1×106/ml。将滤膜孔径为8 μm 的Transwell小室放置于24孔板中;在下室加入600 μl 含10%血清的培养基;在上室加入100 μl 细胞悬液;将培养板放入孵箱,常规培养24-48 h。取出小室,用PBS淋洗3次;将小室置于95%乙醇中固定 5 min;在0.5%结晶紫染色液中染色10 min后,用 PBS 漂洗去除未结合细胞的染色液。用棉签轻拭去小室滤膜上层的细胞,在显微镜下观察滤膜下层细胞并拍照并计数。
1.9 CCK8检测细胞增殖
取各组细胞用培养液配成单细胞悬液,调整细胞数为1.5×104个/ml,将细胞均匀铺于96孔板中,每孔200μl细胞悬液,置于37℃培养箱中培养。24 h后每孔加CCK8溶液20 μl,继续孵育4 h。酶标仪设定波长450 nm,进行吸光度检测。
1.10 细胞划痕实验检测细胞迁移
将生长状态良好的各组细胞以2×105个/ml接种于6孔板内,每孔2 ml。待细胞长成单层弃去培养液,在每孔中央划出一个划痕,洗去死亡细胞,显微镜下拍照,观察12 h时细胞划痕处细胞运动变化。
1.11 流式细胞法检测细胞周期
各组细胞以每孔5×105个接种于6孔板中,转染48 h后收集细胞并用预冷的PBS洗涤细胞1次,然后设定1 200 RPM离心5 min,用预冷的PBS重悬,逐滴将细胞悬液加入预冷的70%乙醇中,置于4℃ 固定过夜。去除乙醇后用PBS洗涤2次并加入100 μl RNase A,37℃水浴30 min,接着添加400 μl PI染色并混匀,4℃避光 30 min,最后用流式细胞仪检测细胞周期。
1.12 构建结肠癌裸鼠移植瘤模型
选用SPF 级 BALB/c雄性裸鼠8只,4-5周龄,体重13-16 g。动物饲养于22℃恒温,40-75%湿度,12 h光/暗周期条件下,自由获取水和食物。所有裸鼠随机分为对照组(n=4)和miR-1197处理组(n=4)。取转染了miR-1197 mimics,negative control miRNA mimics的SW620细胞配置成浓度约为 2×107个/ml 单细胞悬液,每只裸鼠左前肢腋窝皮下接种0.2 ml细胞悬液。接种后每3天用游标卡尺测量每只裸鼠移植瘤的最大直径a和最小径b,计算瘤体积,计算公式为:V=1/2×a×b2,3周后采用颈椎脱臼法处死全部裸鼠,剥离瘤体,称重,拍照,甲醛固定。
1.13 免疫组化
将组织标本置于4%多聚甲醛固定液中固定48 h后,常规石蜡切片脱蜡水化。滴加3% H2O2室温孵育10 min以消除内源性过氧化物酶活性。使用PBS冲洗5 min×2次,切片置于柠檬酸盐缓冲液并采用微波加热法以修复抗原。加入5% 的正常羊血清封闭,室温孵育20 min。加入Ki67抗体(1∶100),4℃过夜。加入辣根过氧化物酶标记的羊抗兔二抗(1∶200),37℃孵育30 min。滴加辣根酶标记链霉卵白素工作液,37℃孵育30 min。采用DAB显色后,苏木精室温染色2 min,而后进行脱水和中性树脂封片。显微镜观察切片阳性信号,并进行计数统计。
1.14 统计学方法

2 结果
2.1 miR-1197在结肠癌患者血清中的表达与临床特征的相关性
qRT-PCR检测结果显示,结肠癌患者血清中miR-1197表达水平与肿瘤分化程度,淋巴转移,远端转移,肿瘤浸润深度和肿瘤直径相关临床指标发展程度呈负相关(P<0.05),与性别和年龄无关(表1)。

表1 miR-1197在结肠癌患者临床特征的相关性
2.2 miR-1197在结肠癌肿瘤组织和癌旁正常组织的表达
qRT-PCR检测结果显示,相比癌旁正常组织,结肠癌肿瘤组织中miR-1197的表达水平显著降低(P<0.01)(图1A),并且miR-1197在发生远端转移肿瘤组织中的表达水平显著低于未转移肿瘤组织(P<0.01)(图1B)。提示miR-1197可能与结肠癌的发生及发展有关。

图1 miR-1197在结肠癌肿瘤组织和癌旁正常组织的表达
注:A.miR-1197在结肠癌肿瘤组织和癌旁正常组织的表达水平;B.miR-1197在发生远端转移肿瘤组织和未转移肿瘤组织的表达;(**,表示P<0.01,差异具有统计学意义)。
2.3 miR-1197对Smad3的靶向调控作用
采用miRBase预测miR-1197的潜在靶基因,结果显示,Smad3的 3′-UTR区域存在与miR-1197形成互补结合的位点(图略)。在SW620细胞中共转染miR-1197mimics,negative control miRNA mimics (miR-NC)以及构建的Smad3野生型3′-UTR荧光素酶报告基因质粒pMIR-Smad3-wt和突变型报告基因质粒pMIR-Smad3-Mut,双荧光素酶检测结果显示,miR-1197高表达可明显抑制pMIR-Smad3-wt的荧光素酶活性(P<0.01),但对pMIR-Smad3-Mut的荧光素酶活性无明显影响(图2A)。另外,qRT-PCR检测结果显示,相比对照组,转染miR-1197 mimics的细胞中Smad3的mRNA水平明显降低(P<0.01)(图2B)。Western blot检测结果也表明,miR-1197高表达可明显下调Smad3蛋白的表达(图2C)。上述实验结果表明,miR-1197通过结合Smad3的 3′-UTR来靶向调控Smad3的mRNA及蛋白表达。
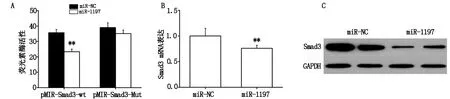
图2 miR-1197结合Smad3的 3′-UTR来抑制Smad3的表达
注:A.双荧光素酶报告基因法检测荧光素酶活性;B.qRT-PCR实验检测Smad3的mRNA水平;C.Western blot检测Smad3蛋白的表达水平;(**,表示P<0.01,差异具有统计学意义)。
2.4 Smad3在结肠癌肿瘤组织和癌旁正常组织的表达
采用Western blot检测结肠癌肿瘤组织和癌旁正常组织中Smad3的蛋白表达。结果显示,肿瘤组织中Smad3的蛋白表达显著高于癌旁正常组织(图3A)。同时,qRT-PCR检测结果也显示结肠癌肿瘤组织中Smad3的mRNA表达水平显著升高(P<0.01)(图3B)。
2.5 miR-1197与Smad3对结肠癌细胞增殖、侵袭、迁移及细胞周期的调控
在SW620细胞中转染negative control miRNA mimics (miR-NC),miR-1197 mimics和Smad3,采用CCK8法检测各组细胞增殖能力,结果显示,miR-1197 mimics转染组的OD值显著低于对照组,而miR-1197 mimics+Smad3转染组的OD值显著高于miR-1197 mimics转染组(P值均<0.01)(图4A)。流式细胞法检测结果显示,miR-1197 mimics转染组S期细胞比值显著降低,而miR-1197 mimics+Smad3转染组S期细胞比值显著升高(P值均<0.01)(图4B)。采用Tranwell实验检测细胞侵袭能力,结果显示,转染miR-1197 mimics后,侵袭细胞计数显著降低。而共转染miR-1197 mimics和Smad3后,侵袭细胞计数显著升高(P值均<0.01)(图4C)。细胞划痕实验结果显示,miR-1197 高表达可显著降低细胞迁移能力,而同时上调miR-1197 mimics和Smad3的表达后,细胞迁移能力显著上升(P值均<0.01)(图4D)。上述结果表明,miR-1197可抑制SW620细胞的增殖、侵袭、迁移及S期细胞周期的聚集,但Smad3过表达可逆转这种抑制效果。
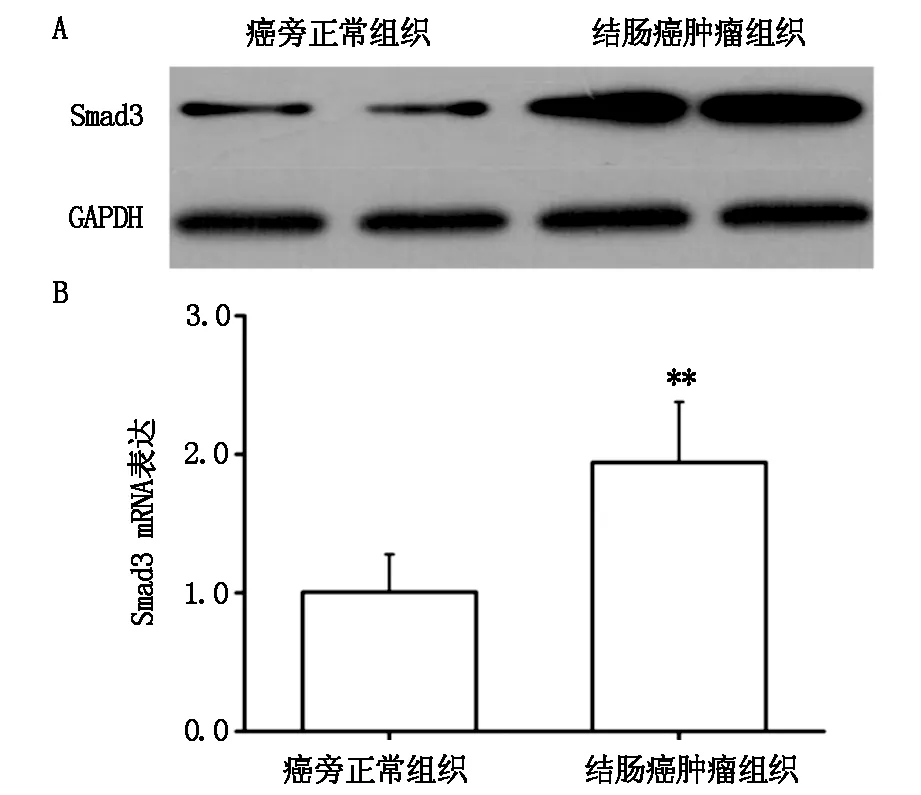
图3 Smad3在结肠癌肿瘤组织和癌旁正常组织的表达
注:A.Western blot检测结肠癌肿瘤组织和癌旁正常组织中Smad3的蛋白表达量;B.qRT-PCR检测结果结肠癌肿瘤组织和癌旁正常组织中Smad3的mRNA表达量;(**,表示P<0.01,差异具有统计学意义)。
2.6 miR-1197在结肠癌裸鼠移植瘤模型中的作用
将negative control miRNA mimics (miR-NC),miR-1197 mimics转染进SW620细胞并注射到裸鼠皮下以构建结肠癌裸鼠移植瘤模型。细胞接种21天后,检测结果显示,miR-1197 mimics处理组的肿瘤体积及重量均显著低于对照组(P值均<0.01)(图5A-B)。Ki67染色结果显示,相比对照组,miR-1197 mimics处理组裸鼠中细胞增殖能力显著降低(图5C)。上述结果表明,在结肠癌裸鼠移植瘤模型中,上调miR-1197的表达可抑制结肠癌细胞的增殖及肿瘤生长。
3 讨论
结肠癌是常见的消化道恶性肿瘤之一,具有发病率高,5年生存率低等特点肿瘤侵袭和转移是导致结肠癌患者死亡及影响预后的重要因素,但具体机制尚不清楚,因此寻找并研究结肠癌新靶点非常重要[6]。MicroRNAs(miRNAs)是一类小分子高度保守的非编码RNA[7]。近年来大量研究数据表明,其其突变、异位或表达水平的变化影响恶性肿瘤发展过程[8,9]。同时多种miRNAs 已被证实在结肠癌的发生及发展发挥了重要作用,例如,Wang等研究发现miR-106a通过直接调控TGFER2而促进结肠癌的转移[10];Zhang 等人的研究发现miR-7能够靶向YY1蛋白的表达调节结肠癌的发生[11]。在本研究中,首先发现了结肠癌患者血清中miR-1197表达水平与肿瘤分化程度,淋巴转移,远端转移,肿瘤浸润深度和肿瘤直径相关临床指标呈负相关;并且miR-1197在结肠癌肿瘤组织中的表达水平显著低于癌旁正常组织,在发生远端转移肿瘤组织中的表达水平显著低于未转移肿瘤组织。上述结果提示miR-1197可能与结肠癌的发生及发展存在相关性。

图4 miR-1197与Smad3对结肠癌细胞增殖、侵袭、迁移及细胞周期的调控
注:A.CCK8法检测SW620细胞增殖能力;B.流式细胞法检测SW620细胞S期细胞比值;C.Tranwell实验检测SW620细胞侵袭能力;D.细胞划痕实验检测SW620细胞的迁移能力;(**,表示P<0.01,差异具有统计学意义)。

图5 miR-1197在结肠癌裸鼠移植瘤模型中的作用
注:A.miR-1197模拟物的肿瘤体积;B.miR-1197模拟物的肿瘤重量;C.Ki67染色观察miR-1197模拟物的SW620细胞中阳性信号及增殖效果;(**,表示P<0.01,差异具有统计学意义)。
miRNAs主要与其靶基因的mRNA 3′UTR(untranslated region)非编码区域结合,通过翻译抑制或下调靶基因的mRNA来影响蛋白质的翻译,从而调控不同的生理及病理过程。因此,为明确miR-1197在结肠癌中的作用机制,首先需确定其在结肠癌中调控的靶基因。本研究使用miRBase发现 Smad3的 3′-UTR区域存在与miR-1197形成互补结合的位点,并通过双荧光素酶报告基因实验进行了验证。并且我们还进一步发现在SW620细胞中,miR-1197高表达可以下调Smad3的mRNA及蛋白的表达水平。表明miR-1197可负向调控靶基因Smad3的表达水平。
Smad3是Smad家族的成员,其不仅在TGF-β信号通路中起着细胞内调控作用,而且在多种人类肿瘤细胞的侵袭及转移中扮演重要角色[12]。研究证明TGF-β/Smads信号通路在维持和促进上皮间充质转化(epithelial-mesenchymal Wansition,EMT)过程中起重要作用[13],而后者被认为是肿瘤转移的关键启动步骤[14,15]。本研究发现,在结肠癌肿瘤组织中Smad3的mRNA和蛋白表达水平均明显高于癌旁正常组织,并且其与miR-1197表达水平的变化与结肠癌细胞的生物学行为密切相关。我们发现miR-1197高表达能抑制SW620细胞的增殖、侵袭、迁移能力及S期细胞周期的聚集,但上调Smad3的表达水平可以逆转miR-1197的这种抑制效果。表明miR-1197是通过抑制靶基因Smad3的表达水平参与调控结肠癌细胞的生物学行为。进一步,我们通过构建结肠癌裸鼠移植瘤模型观察miR-1197在结肠癌中的作用,结果显示,miR-1197可作为抑癌基因在结肠癌裸鼠移植瘤模型中抑制结肠癌细胞的增殖及肿瘤生长。
综上所述,本研究阐述了miR-1197的异常低表达与结肠癌的发生及发展密切相关,揭示了miR-1197通过负调控靶基因Smad3的表达水平抑制结肠癌细胞的生物学行为及肿瘤的生长,在结肠癌中发挥抑癌基因作用。因此,miR-1197可能成为结肠癌诊断及治疗的新靶点及研究方向。

