新西兰大白兔佐剂性关节炎模型的评价
陈芳 刘琴 王丽平 陈利锋 张宜 杨鸿*
类风湿性关节炎(RA)是一种慢性自身性免疫性疾病,其病因和发病机制尚未完全明确,在治疗方面亦无特效治疗措施[1]。全球有0.5%~1%的人群受到此疾病的影响,该病不仅致残率高,还可引起血管炎、心包炎等并发症,严重影响患者的生活质量,造成巨大的家庭和社会负担[2]。寻找安全、有效缓解RA 病情的药物是目前治疗RA 的重点[3]。佐剂性关节炎(adjuvant arthritis,AA)动物模型已经广泛用于类风湿性关节炎发病机制的研究和评估潜在的抗类风湿性关节炎药物的临床应用[4]。而从报道文献来看,兔RA 动物模型普遍存在标准不一、流程各异和细节不清的问题,特别是检测指标不统一等,甚至只是从肉眼来判断,诸多设计思路也值得商榷。如何复制出更接近RA 的动物病理模型一直成为困扰风湿免疫科研工作者的难题,因此寻找发病机制更接近RA 的动物模型具有重要的临床意义[5]。本研究旨在建立一个较完整的兔佐剂性关节炎动物模型,为研究关节疾病的发病机制、病理变化以及药物疗效、作用机制提供一个实验平台。
1 材料与方法
1.1 实验动物
健康新西兰大白兔16 只,雌雄不限,体质量2.5 ~3.0 kg,清洁级,由武汉市新洲区万千佳禾实验动物养殖场提供[SCXK(鄂)2017-0045],本实验在广州军区武汉总医院医学实验科动物实验设施内进行[SYXK(鄂)2014-0082]。本实验经中国人民解放军中部战区总医院(中国人民解放军武汉总医院)伦理委员会批准进行[武总动(福)第2018038 号]。
1.2 实验试剂及仪器
弗式完全佐剂(Sigma 公司,美国);苏木素、伊红Y(水溶性)、无水乙醇、二甲苯、盐酸、包埋石蜡、中性树脂等由国药集团提供;脱钙液(硝酸-甲醛液,按甲醛15 mL,蒸馏水90 mL,纯硝酸20 mL 比例来配制),硝酸和甲醛由武汉市洁洋盛科技公司提供;病理切片机(Leica RM2016轮转式切片机,德国),组织摊烤片机(武汉俊杰JK-6 生物组织摊烤片机),显微镜(尼康E100 型生物显微镜),倒置荧光显微镜(奥林巴斯,日本),软皮尺等。
1.3 实验方法
1.3.1 AA 兔模型的建立[6]
新西兰兔16 只,1 只/笼进行分笼喂养,随机分组为正常组(8 只)和模型组(8 只),饲养间温度18 ~24℃,相对湿度40%~60%。新西兰兔适应性喂养1 周后,足爪剃毛称体重,测足趾部的周径。模型组初次诱导:将家兔背部肩胛骨间及双膝关节以下的毛用脱毛剂脱去,每只新西兰兔右跖部皮下注射弗氏完全佐剂0.4 mL,同时注射背部4 点,每点0.2 mL。加强诱导:注射后7 d 加强注射弗式完全佐剂1 次,每只新西兰兔右跖部皮下注射弗氏完全佐剂0.4 mL;背部任意2 点,每点注射0.2 mL。
1.3.2 AA 兔模型的鉴定
1.3.2.1 双侧足趾周径测定
采用软皮尺于造模前、造模后24 d 分别测定各组家兔双足跖周径变化。测量时注意取相同松紧度,于足趾肿胀最高点进行测量。
1.3.2.2 兔双足X 线片变化
随机抽取正常组和模型组兔各3 只,于我院放射科行双足斜位X 线片。并对其足趾软组织肿胀度、关节变化情况进行评价。
1.3.2.3 滑膜组织HE 染色
在取材之前对兔肉眼所见拍照,并在取材过程中拍下一些典型的病变特征。实验动物脱臼处死,取踝关节,修剪整齐后,放入10%的甲醛固定液中,固定1 周后,转入甲酸脱钙液中,脱钙至骨质变软,用小刀切取软骨,修剪成0.5 cm×0.4 cm×0.3 cm,并包埋(梯度乙醇脱水、二甲苯脱水、透明,石蜡包埋切片,分别用苏木精-伊红染色)。
1.4 统计学方法
用SPSS 19.0 统计软件进行统计学处理,数据以均数±标准差表示,P<0.05 为差异有统计学意义。
2 结果
2.1 AA 兔足趾周长的影响
表1 结果显示,造模前,各组间右足趾周长差异无统计学意义(P>0.05),造模各组右足趾周长差异无统计学意义(P>0.05),具有可比性;造模组足趾周长均较正常组明显升高(P<0.05)。
表1 各组实验兔致炎侧足趾周长比较
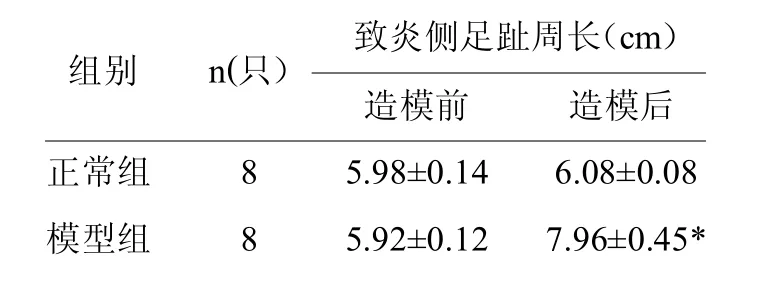
表1 各组实验兔致炎侧足趾周长比较
注:*与正常组比较<0.05。
组别 n(只) 致炎侧足趾周长(cm)造模前 造模后正常组 8 5.98±0.14 6.08±0.08模型组 8 5.92±0.12 7.96±0.45*
2.2 AA 兔X 线片表现的影响
X 线片结果显示,与正常组比较,模型组AA 兔软组织肿胀明显,关节间隙变窄甚则模糊,骨皮质变薄(见图1)。
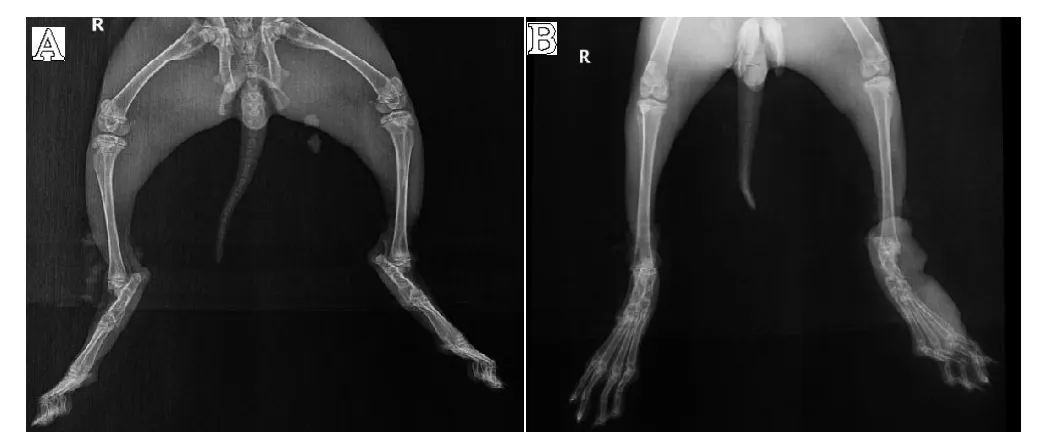
图1 各组实验兔双足X 线片:A.正常组;B.模型组
2.3 AA 兔足关节外部观察及HE 染色结果
新西兰兔造模24 d 后,外部观察足关节及足趾部明显肿胀变形(见图2A、图2B),解剖可见踝关节腔有明显的积液(见图2C、图2D),解剖可见模型兔足趾部有明显微血管增生和炎症(见图2E、图2F);滑膜组织切片HE 染色显示,正常组的滑膜细胞呈现“串珠样”规则排列(见图3A),而模型组的滑膜细胞排列紊乱,而且还出现细胞水肿现象(见图3B),模型组的滑膜层出现大量的炎性细胞和多核巨噬细胞(见图3D)而正常组无炎性细胞(见图3C),提示AA 兔模型制备成功。
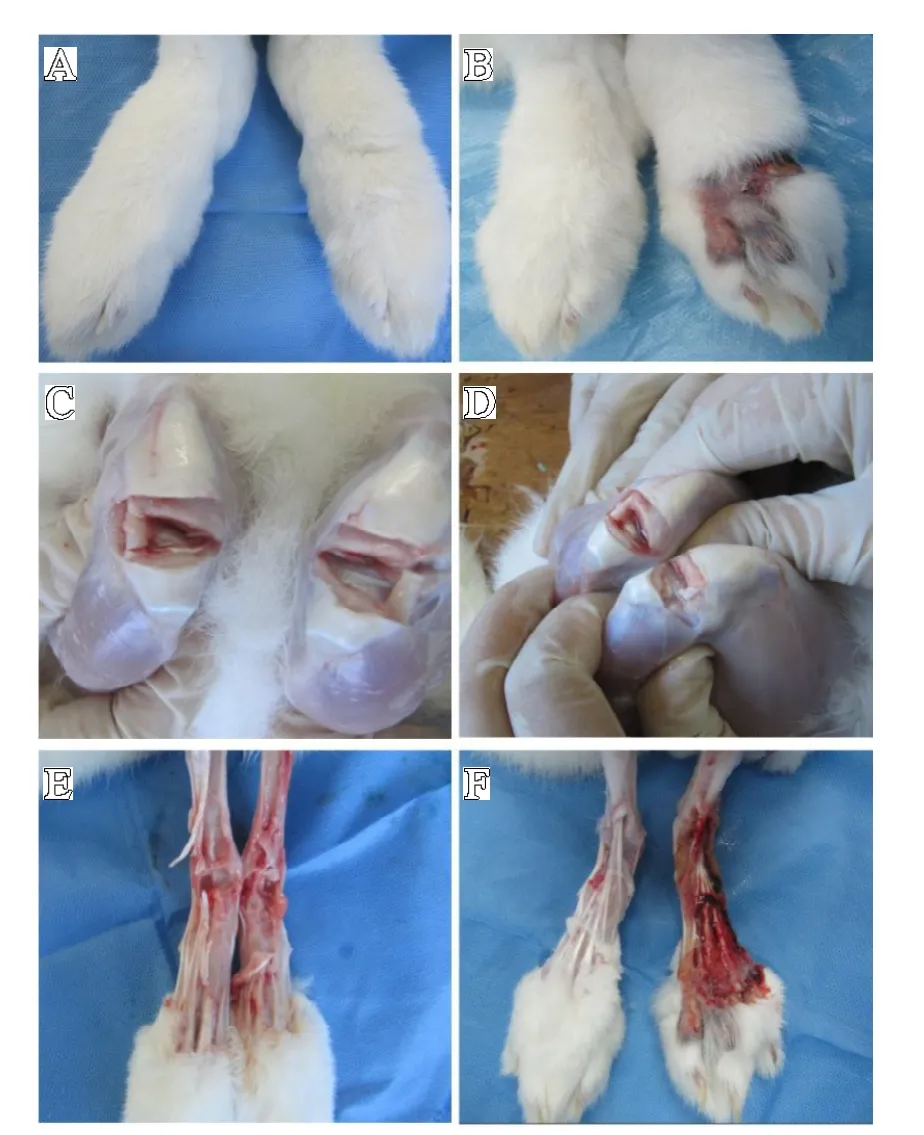
图2 新西兰兔的足爪、关节腔及足关节的病变特征:A.正常组足;B.模型组足;C.正常组足关节;D.模型组足关节;E.正常组爪解剖面;F.模型组爪解剖面
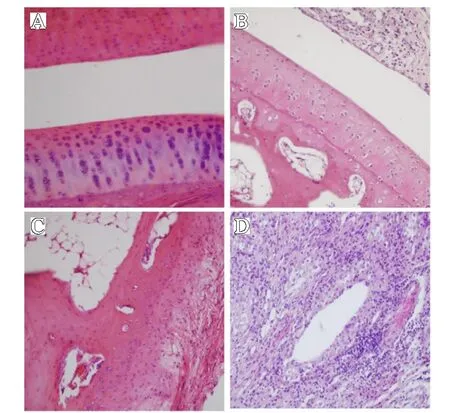
图3 新西兰兔足关节滑膜组织HE 染色:A.正常组滑膜组织HE 染色呈现“串珠样”规则排列(×200);B.模型组滑膜组织HE染色出现细胞水肿现象(×200);C.正常组滑膜组织HE 染色无炎性细胞(×200);D.模型组滑膜组织HE 染色,滑膜层出现大量的炎性细胞和多核巨噬细胞(×200)
3 讨论
虽然目前对RA 的研究已经深入到细胞水平、分子水平以及基因水平,但RA 的病因和发病机制极其复杂,为医学上仍未解决的难题[7]。其临床表现为对称性的多关节肿胀、疼痛,最终可造成关节结构破坏、功能障碍,甚至致残[8]。据临床观察,RA 的主要病理特征为:关节滑膜炎,滑膜组织增生以及对骨和软骨的结构性损伤。RA 的病理过程主要是关节炎症细胞及浸润和滑膜细胞增殖和侵袭,形成侵袭性血管翳,导致骨和软骨破坏[9]。动物模型是研究RA 的发病机制和药效学的重要手段之一。常用于制备模型的动物主要是大鼠,其次是兔,但是由于小动物在生理学和免疫学方面与人类有很大的不同,相比大鼠关节炎模型,弗氏完全佐剂(complete Freund's adjuvan,CFA)诱导的兔关节炎模型在病理变化方面更接近人[10-11],这就使得探索建立大动物模型变得尤为必要。AA 兔模型又称弗氏佐剂关节炎兔模型,是一种使用广泛的风湿性关节炎动物模型,可用于预测多种药物对RA 的临床疗效。早期动物的炎症反应的部位常出现在四肢并不断加重,活动不便,尾部溃烂,出现类风湿结节,体重下降,特别是继发性自身免疫性肿胀,这些表现与人的RA 表现相似。AA 兔模型是RA 的经典模型,已较为成熟,与人的病理过程十分的相似。本研究中将兔作为研究对象,采用多次多点于新西兰兔右跖部皮下注射CFA 诱导AA 兔模型,造模3 周后,外部观察足关节及足趾部明显肿胀,严重致跛行,解剖可见模型兔足趾部有明显微血管增生和炎症,滑膜组织切片HE 染色显示,正常组的滑膜细胞呈现“串珠样”规则排列,而模型组的滑膜细胞排列紊乱并出现水肿,这些表现与类风湿性关节炎相符。
成功的AA 动物模型除了在病理学上与临床一致,同时需要具备操作简单、可重复性等特点,并且用于造模的实验动物、试剂易购买等[12]。本研究旨在寻求一种较为稳定的AA 兔模型制作体系,只有规范了动物模型,后续的实验研究才具有科学性。因此笔者在实验过程中体会到AA 兔模型的规范化需要做大量工作。一是实验动物质量和伦理的程序化要求。应重视实验动物质量合格证号及单位伦理审核号。二是实验设计的科学性要求。皮下注射CFA 的量及时间都应慎重,在前期的预实验过程中发现CFA 的量少,造模不成功,量多导致兔状态极差,影响后续实验的开展,发现皮下注射CFA 后,前1 周有一个急性期,而加强1 周后趋于稳定。脱钙是骨组织制片中的重要步骤,也是病理技术难点,而脱钙剂的选择十分重要。关节结构既包含致密的骨组织,又包含周围的肌肉、韧带等软组织,因此对其病理制片前期处理的要求更高,即要充分脱钙又不能损伤软组织形态结构[13-14]。在取材脱钙的过程中,脱钙液的配制以及脱钙时间也需要去探索,室温越高作用效果越明显,也就是夏天的脱钙效果比冬天脱钙效果好,否则脱钙不完全或脱钙太过,会对切片造成影响。三是有效性指标的要求。在实验中评价一个模型的建立是否成功,应该由病理特征为依据,而不是通过肉眼观察,前期实验过程中,很容易被急性期迷惑。病理特征为依据应当与临床类风湿性关节炎的病变特征相结合来考虑,这样建立的模型才能更好地为临床中西药研究服务。

