细胞自噬在神经胶质瘤治疗中的研究进展*
王京萍,曾令公,武世伍,马 莉,柴大敏
(蚌埠医学院第一附属医院临床病理科,蚌埠医学院病理学教研室,安徽 蚌埠 233000)
1 自噬概述
“Autophagy”即自噬,这个词是de Duve等[1]于1966年发现溶酶体的同时创造出来的,描述的是具有单层或双层膜的结构吞噬受损的蛋白质和细胞器等功能失调的细胞组分形成自噬体,之后与溶酶体融合形成自噬溶酶体,最后将包裹物降解的一个过程。通过自噬降解的包裹物包括糖、核苷酸、氨基酸和脂肪酸,最终自噬体会同溶酶体进行融合进而将细胞器降解,这一过程可以为细胞提供大量的营养物质以及用于细胞再生的结构基础。直到1992年Takeshige等[2]首次报道营养缺乏条件下诱导酵母细胞液中细胞成分的广泛自噬降解,才鉴定出自噬机制中涉及的分子,并在随后研究中阐明酵母细胞中自噬发生的分子机制并且将自噬相关基因统一命名为ATG(autophagy-related genes)。
1999年Liang 等[3]鉴定出的beclin-1(也称为ATG6)是第1个被发现的具有介导自噬作用的哺乳动物基因,强制表达自噬基因不仅促进营养剥夺诱导人乳腺癌细胞的自噬,而且抑制其肿瘤形成潜力,表明自噬可能是防止肿瘤细胞失调生长的基本机制;自噬作为应激反应机制保护癌细胞免受低营养供应或治疗的损伤,还通过触发非凋亡性细胞死亡程序参与癌细胞的消除,在肿瘤发展中具有负面作用;另一方面,越来越多的证据表明自噬在肿瘤的发展过程中起着促进作用,当肿瘤细胞在能量不足、缺氧和生长因子缺失等应激条件下,自噬可以对细胞内损伤的蛋白质和细胞器进行吞噬降解,这一过程可以为肿瘤细胞提供能量[4]。从目前所知自噬与肿瘤之间存在着双重的关系,如何使用好这把“双刃剑”使其在肿瘤治疗中将伤害降到最小化,我们还需更深入探讨自噬的功能。
1.1自噬的分型和功能 自噬主要有3种类型:巨自噬、微自噬和伴侣介导自噬,其中巨自噬被认为在细胞内降解中起主要作用,目前所说自噬即巨自噬。自噬是细胞降解并回收细胞成分的稳态过程,可以作为细胞存活和细胞死亡之间的平衡机制,自噬是通过在饥饿条件下使用细胞内资源而在细胞存活中起作用的。这种动态过程包括隔离膜的形成,隔离膜的成核,延伸以及细胞成分的吞没及双膜的封闭4个步骤。调控自噬的分子机制是高度保守的,在酵母中它的调控机制也证实与哺乳动物细胞中保持高度一致[5]。
自噬过程是由一系列ATG严格调控,是一种动态细胞再循环系统,可降解细胞质内容物、异常蛋白质聚集体以及过量或受损的细胞器,从而可以使用氨基酸等构建模块来创建新的细胞成分。当待降解的蛋白质、细胞器或细胞质内容物被一小部分膜包围时,就会发生自噬,从而形成自噬体。然后将自噬体与溶酶体融合,产生自噬溶酶体并通过溶酶体酶导致细胞组分降解。其中自噬的核心部分是自噬体,就是由膜运输介导的独特的双膜结构,同时也是检测自噬发生的金指标之一。自噬通常通过营养缺乏的条件激活,但也与生理以及病理过程相关,例如发育、分化、神经变性疾病、压力、感染、肥胖和肿瘤;一方面自噬可以通过促进蛋白质分解代谢为肿瘤细胞及时提供能量而延长肿瘤细胞的寿命;而另一方面过度的自噬会引起自噬性程序性细胞死亡,即Ⅱ型程序性细胞死亡,从而起到抑制肿瘤生长的作用[6-7]。
1.2自噬的过程 自噬的分子机制主要在酵母中发现,并由许多ATG指导[8]。UNC-51样蛋白激酶(UNC-51-like kinase 1, ULK-1)起到与酵母ATG1相似的作用,其作用于哺乳动物雷帕霉素靶蛋白(the mammalian target of rapamycin,mTOR)复合物的下游[9]。ULK与ATG13和支架蛋白FIP200形成大的复合物。ATG通过ATG12-ATG5和微管相关蛋白1轻链3-B(microtubule-associated proteein 1 light chain 3-B,LC3-B)复合物控制自噬体形成。ATG12在泛素样反应中与ATG5缀合,这一过程需要ATG7和ATG10的参与;然后,ATG12-ATG5缀合物与ATG16非共价结合形成大的复合物。第2种复合物LC3/ATG8在其C末端被ATG4蛋白酶切割以产生胞质LC3-A。 LC3-A与泛素样反应中的磷脂酰乙醇胺(phosphatidylethanolamine,PE)缀合,这一过程需要ATG7和ATG3的参与,即LC3-B以脂质形式附着于自噬体膜。Sequestosome 1是一种由SQSTM1基因编码的蛋白质,也被称为泛素结合蛋白p62(SQSTM1/p62)是一种结合LC3/ATG8的泛素结合蛋白,通过将含有SQSTM1/p62的蛋白质聚集体带到自噬体中来促进自噬,从而完成降解[10],见图1。
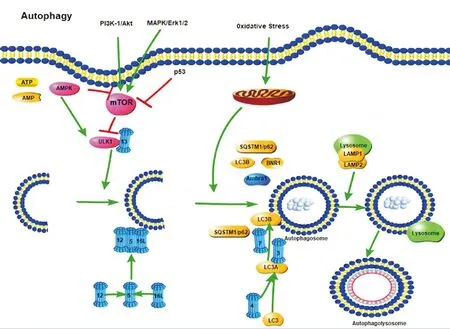
Figure 1.The basic processes of autophagy and related pathways.
图1 自噬的基本过程和有关通路
1.3自噬的调控 LC3存在于胞质中,LC3-B始终稳定地黏附在自噬体膜上,直到自噬体与溶酶体相融合,因此相对于LC3-A,LC3-B更稳定,可以作为自噬体的标志物。磷脂酰肌醇3-激酶(phosphatidylino-sitol 3-kinase,PI3K)/蛋白激酶B(protein kinase B,PKB,即Akt)/mTOR信号通路在众多细胞生物学过程中均起到至关重要的作用,包括细胞凋亡、自噬、代谢及血管新生。mTOR是自噬诱导的关键调节因子,其中活化的mTOR[Akt和丝裂原激活蛋白激酶(mitogen-activated protein kinase,MAPK)信号传导]抑制自噬,并且mTOR的负调节(AMPK和p53信号传导)促进其自噬[11]。雷帕霉素(rapamycin)是mTOR的特异性抑制剂,沉默或抑制mTOR激酶的活性可以增强雷帕霉素的抗肿瘤作用[12]。
2 自噬与神经胶质瘤
2.1神经胶质瘤的标准化治疗 肿瘤是由于调节细胞分化、增生和存活通路的失调节引起的。神经胶质瘤是来源于神经上皮的一种最常见的肿瘤,占所有原发性脑和中枢神经系统肿瘤的24%。这些肿瘤在组织学上差异很大,从良性室管膜瘤到最具攻击性和致命性的IV级多形性胶质母细胞瘤(glioblastoma multiforme,GBM)。毛细胞型神经胶质瘤预后尚好,10年生存率可以达到90%;但是由于GBM生长呈侵袭性,极易复发、迁移,平均生存时间仅为15~18个月,患者5年生存率仅为5%[13]。目前较成熟的治疗神经胶质瘤的化疗方案有以下2种:(1)检测O6-甲基鸟嘌呤DNA甲基转移酶(O6-methylguanine-DNA methyltransferase,MGMT)甲基化以预测替莫唑胺疗效;(2)染色体1p/19q杂合性缺失(1p/19qLOH),预测PCV(环己亚硝脲+长春新碱+甲基苄肼)方案(应用最广的疗效最确切的脑胶质瘤化疗方案)预后好。
在美国和其它一些国家,使用贝伐单抗进行抗血管生成治疗被批准用于治疗复发性GBM[14]。最大安全性开颅手术、辅助放疗和替莫唑胺用于新诊断的GBM,贝伐单抗用于复发性GBM。美国食品和药物管理局批准的唯一针对胶质瘤的靶向治疗是贝伐单抗,其靶向血管内皮生长因子,初步研究显示贝伐单抗具有高放射学反应率,可延长无进展生存期(progression-free survival,PFS)。虽然在整体人群中没有观察到贝伐单抗的生存获益,但事后亚组分析确认,为异柠檬酸脱氢酶1(isocitrate dehydrogenase 1, IDH1)野生型GBM亚组添加贝伐单抗后中位生存期可能增加4.3个月[15]。目前在国内乃至国际上关于贝伐单抗的使用依然充满争议。
2.2自噬相关的神经胶质瘤的分子生物学研究 目前与自噬相关的神经胶质瘤的分子生物学研究有如下3种:(1)TP53突变,在星形细胞瘤起源的胶质瘤中,TP53基因突变率达65%以上;(2)表皮生长因子受体Ⅷ(epidermal growth factor receptor,EGFRⅧ),采用特异性EGFRⅧ单抗检测高级别胶质瘤,作为靶向治疗的突破,EGFRⅧ第3阶段实验失败,疫苗正在研发;(3)IDH1,80%以上的低级别胶质瘤存在IDH1基因第132位点杂合突变。胶质瘤的放疗、化疗和光疗均涉及自噬。详细阐明细胞自噬机制,开发新的自噬诱导剂或抑制剂以及应用策略促使胶质瘤细胞发生自噬性死亡,已经成为胶质瘤治疗的新方向。
据报道,与低级星形细胞瘤和正常脑组织相比,GBM中beclin-1和LC3-B水平降低,这表明降低的自噬活性可能促使这些肿瘤进展为更恶性的表型,GBM中beclin-1基因的缺失支持了自噬在该肿瘤发生中起抑制作用的理论[16]。
2.3自噬相关神经胶质瘤的体外研究 有实验证实,胶质瘤和GBM细胞在暴露于电离辐射后表现出对细胞凋亡的强烈抵抗,凋亡相关基因如第10号染色体缺失性磷酸酶-张力蛋白同源蛋白(phosphatase and tensin homolog deleted on chromosome 10,PTEN)的表达状态可能与该现象有关,并且干扰各种信号通路[17]。如上所述,PI3K/Akt/mTOR被认为是调节自噬的主要途径,通过使用Akt/mTOR抑制剂如雷帕霉素类似物抑制 Akt/mTOR活性,加剧了自噬过程[18]。雷帕霉素对氧糖剥夺损伤的人神经母细胞瘤SH-SY5Y细胞具有保护作用,这一过程与激活自噬相关[19]。Akt抑制剂在放射抗性和放射敏感性U87胶质瘤细胞系中诱导自噬死亡,并增强对辐射的敏感性,但不诱导细胞凋亡[20]。还有各种研究着重于自噬抑制的神经胶质瘤放射敏感性:Yuan等[21]的研究表明,使用siRNA抑制ATG5或使用3-甲基腺嘌呤抑制自噬可增强STAT3抑制后神经胶质瘤的放射敏感作用。
2017年Jiang等[22]进行体外和体内研究发现盐酸青藤碱(sinomenine hydrochloride,SH)通过活性氧物质生成和自噬-溶酶体途径激活而抑制人GBM细胞生长;在2种细胞系均发现SH参与活性氧簇(reactive oxygen species,ROS)产生和自噬-溶酶体途径激活,并通过Akt-mTOR和c-Jun氨基末端激酶(c-Jun NH2-terminal kinase,JNK)通路来诱导自噬发生,从而抑制GBM细胞生长。2017年Duan等[23]在U87MG细胞系中发现沉默自噬特异性基因beclin-1有助于减弱神经胶质瘤中缺氧诱导的血管生成拟态。2018年Navone等[24]研究发现阿司匹林可以影响肿瘤血管生成并使人GBM内皮细胞对替莫唑胺、贝伐单抗和舒尼替尼敏感,从而损害VEGF相关信号传导。2018年Zhao等[25]研究发现腺相关病毒2介导血管内皮生长因子陷阱的基因转移可以作为胶质瘤的一种新的治疗选择。这些发现也提供了一个用于治疗人GBM的新型潜在治疗剂。
2.4自噬相关神经胶质瘤的临床研究 BriceZo 等[26]在2003年进行了第一批临床试验,他们将18例患有胶质母细胞瘤且均接受手术、化疗和放疗的患者分成2组进行临床用药治疗,实验组每天服用150 mg的氯喹(一种自噬抑制剂),同对照组相比实验组有明显较长的中位生存期[实验组(33±5)个月,对照组(11±2)个月],并在2006年继续进行临床研究,在123名患有GBM的患者中让其自由选择接受氯喹作为任选的辅助治疗,同时进行常规手术、化疗和放疗,共有41名患者参与到实验组,氯喹在加入GBM的常规治疗时发挥强烈的佐剂作用[氯喹治疗组患者的生存时间为(25.0±3.4)个月,而对照组为(11.4±1.3)个月][27]。随后,Golden等[28]和Lee等[29]再次印证了这一观点并为其找出了理论依据,即替莫唑胺和氯喹联合治疗的协同作用依赖于自噬形成和胶质瘤细胞中的p53状态。干扰性自噬可能确实在治疗胶质瘤和GBM方面有所作为。图2所示为一种假设的方案,主要针对替莫唑胺联合放射治疗期间GBM致敏的自噬[30]。其中,功能性自噬死亡是指由于溶酶体潜能耗尽而导致的过度自噬活动之后的死亡;非功能性自噬死亡指的自噬体与溶酶体无法融合导致自噬体无法承受的累积之后的死亡;细胞凋亡即Ⅰ型程序性死亡,是由DNA或膜损伤引发从线粒体释放半胱天冬酶导致的死亡。
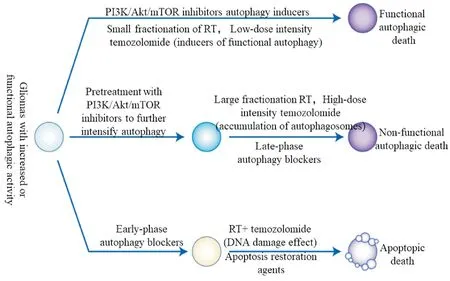
Figure 2.Autophagy for glioblastoma sensitization during temozolomide and radiotherapy.
图2 关于替莫唑胺联合放射治疗期间胶质母细胞瘤致敏的自噬
目前在临床实验研究官网上可以找到的临床实验研究包含5项(autophagy and gliomas;http://clinicaltrials.gov):(1)HIT-HGG研究组在儿童和青少年中用于治疗高级别神经胶质瘤、弥漫性脑桥脑膜瘤和脑胶质瘤的国际合作型III期试验,分别设置替莫唑胺联合氯喹和替莫唑胺联合丙戊酸的试验,属于第3阶段试验(编号NCT03243461);(2)在恶性胶质瘤放化疗中加入氯喹,在新诊断的GBM的同步化放疗时加入氯喹,II期随机对照实验(编号NCT02432417);(3)四氢大麻酚+大麻二酚(tetrahydrocannabinol +cannabidiol,THC+CBD/TN-TC11G)联合替莫唑胺加放疗用于治疗新诊断的GBM,是内部剂量递增临床试验,现处于I期,评估TN-TC11G(THC+CBD)联合替莫唑胺和放射治疗新诊断GBM患者的安全性(编号NCT03529448);(4)DNX2401和替莫唑胺治疗复发性GBM,DNX2401(以前命名的Delta-24-RGD或tasadenoturev,是一种肿瘤选择性的,具有复制能力的溶瘤腺病毒)溶瘤腺病毒联合替莫唑胺,治疗第一次复发的GBM,I期试验(编号NCT01956734);(5)加入氯喹用于新诊断的GBM的同步化放疗,I期试验(编号NCT02378532)。
3 展望
一方面,抑制自噬已经展现出一些前景研究结果,但神经母细胞瘤中明显的肿瘤抑制作用的自噬会提示诱导自噬将是一种更实际的治疗方法,特别是在这些细胞凋亡有缺陷时。此外,如果说诱导自噬在促进免疫系统中发挥实际作用的话,抑制自噬则有破坏免疫监视的风险。因此,我们想要更深入了解癌症干细胞及其在癌症进展及复发中的作用,那么对于胶质瘤干细胞中的自噬过程进行全面分析是非常必要的,可能因此就可以把握改善患者预后的关键点。然而,必须解决的一个关键问题是放射疗法和替莫唑胺是否会引发功能性自噬反应,或者它们只是解除了自噬导致的不可降解的自噬体积聚。这需要在使用递增剂量的放射疗法或替莫唑胺后监测细胞系中自噬流和溶酶体动力学的研究,因为剂量方案可能是定义自噬反应类型的主要因素。
当前新的放射治疗技术允许每个部分向肿瘤递送高剂量,同时减少对周围正常脑组织的剂量。即使在放射抗性细胞系中,阻断自噬通量的大分割是否可以与晚期自噬阻滞剂有效结合以利用非功能性自噬死亡是一个值得研究的问题。替莫唑胺是与放疗联合使用时发挥作用,还是只针对放疗后复发的肿瘤,其机制是不是同放射治疗引起胶质瘤细胞自噬死亡一样?在标准放疗期间或放射治疗失败后,mTOR抑制剂(或增强剂)与低剂量替莫唑胺的组合,会引发功能性自噬死亡,也可能是一种有前景的方法。放疗与替莫唑胺联合对于自噬反应的调节似乎是延长生存和更好地理解GBM治疗之谜的最有希望的方法之一,但仍然缺少需要创建可靠概念的重要见解。
由于自噬与肿瘤之间存在着双重的关系,我们应选取自噬抑制剂还是促进剂应用到神经胶质瘤的治疗中,怎样消除自噬对肿瘤细胞的能量提供,怎样诱发自噬性细胞死亡,都是亟待解决的关键问题。关于自噬在神经胶质瘤的具体机制,还需要更透彻的研究。

