细胞角蛋白8在促肾上腺皮质激素释放因子诱导的肠上皮通透性改变中的作用*
胡 玥,陈超英,张 梦,吕 宾
(浙江中医药大学附属第一医院消化科,浙江 杭州 310006)
肠易激综合征(irritable bowel syndrome,IBS)作为一种临床常见的胃肠功能紊乱性疾病[1],其发病机制尚未完全明确,目前研究指出腹泻型IBS患者存在小肠和结肠肠黏膜屏障的损伤[2-4]。因此,保护肠黏膜屏障的结构和功能完整在防治腹泻型IBS中有着重要的意义。同时,应激在IBS的发病中的作用被日益关注,促肾上腺皮质激素释放因子(corticotropin-releasing factor,CRF)作为应激反应中最重要的内分泌激素,已被发现可以引起肠上皮细胞通透性的改变[5-6],参与IBS的发病。此外,在我们前期研究中,应激IBS大鼠结肠黏膜存在细胞角蛋白8(cytokeratin 8,CK8)的表达上调[7],且伴有肌动蛋白重构及紧密连接蛋白闭锁小带蛋白1(zonula occludens-1,ZO-1)分布紊乱。由此,本研究旨在明确CRF是否是通过上调CK8破坏肠上皮细胞紧密连接引起肠上皮通透性改变及其可能的调节机制,为阐明腹泻型IBS的发病机制及其临床有效诊治提供科学依据。
材 料 和 方 法
1 细胞培养及处理
人结肠腺癌细胞株HT29购自中国科学院上海典型培养物保藏委员会细胞库。细胞培养于含有10%胎牛血清的RPMI 1640培养基,在37 ℃、5% CO2培养箱孵育培养。细胞为贴壁生长,2~3 d 传代1次。当HT29细胞生长并融合形成单层约60%~70%左右,给予100 nmol/L CRF处理,72 h后行相关指标检测。
2 主要试剂
RPMI 1640培养基和胎牛血清购自Gibco;用于细胞转染的慢病毒购自上海吉凯基因化学技术有限公司;抗CK8抗体及PKC活性试剂盒购自Abcam;抗ZO-1抗体购自Life;抗occludin抗体购自CST;抗CRF受体1(CRF receptor 1,CRFR1)及CRFR2 抗体购自Anbobio;Cy3标记的山羊抗兔 IgG (H+L) II 抗购自Sigma;4’,6-二脒基-2-苯基吲哚(4’,6-diamidino-2-phenylindole, DAPI)购自Southern Biotech;CRF购自Tocris Bioscience;抗兔 II 抗购自上海明睿生物技术有限公司;TRIzol及PCR试剂购自TaKaRa;M-MLV逆转录试剂盒购自Promega。
3 主要方法
3.1sh-CK8慢病毒转染 取处于对数生长期的细胞经胰酶消化,完全培养基制成(3~5)×107/L细胞悬液,将2 mL细胞悬液接种到6孔板中,继续培养保证感染时铺板量达到15%~30%左右。待细胞密度为每孔20%时更换感染培养基(Eni.S+polybrene),将CK8干扰慢病毒LV-KRT8-RNAi(37991-1)和阴性对照(negative control,NC)病毒CON053按MOI值20分别加入培养体系中进行感染。感染后16 h更换为常规培养基继续培养,并分为sh-NC组和sh-CK8组。感染后72 h,给予100 nmol/L CRF处理,72 h后行相关指标检测。
3.2免疫荧光检测HT29细胞表面CRFR1和CRFR2的表达情况 将各组HT29细胞调整至每孔5×105,接种于已放圆形爬片的24孔板,37 ℃、5% CO2培养箱孵育,去培养基,按固定、洗涤、封闭、洗涤的顺序处理爬片,分别孵育抗CRFR1(1 ∶50)、CRFR2(1 ∶50)和CK8(1 ∶25 000)的I抗在湿盒中4 ℃过夜,洗涤后在避光环境中,以1 ∶400比例孵育Cy3标记的II抗,PBS洗涤,加入DAPI及抗淬灭剂封片,随后在激光共聚焦显微镜下观察。
3.3Real-time PCR 将各组HT29细胞以TRIzol法提取总RNA,逆转录试剂盒合成cDNA,以此cDNA为模版用荧光定量PCR试剂盒检测CK8的mRNA表达情况。GAPDH 的上游引物序列为5’-TGACTTCAACAGCGACACCCA-3’,下游引物序列为5’-CACCCTGTTGCTGTAGCCAAA-3’,扩增片段为 121 bp;CK8的上游引物序列为5’-ACAAGTTTGCCTCCTTCATAGA-3’,下游引物序列为5’-GAGGACAAATTCGTTCTCCAT-3’,扩增片段为287 bp。反应参数为:95.0 ℃ 30 s; 95.0 ℃ 5 s、60.0 ℃ 34 s,扩增40个循环,60 ℃~95 ℃缓慢升温,产生熔解曲线。实验结果以目的基因和内参照GAPDH的Ct比值来描述。
3.4Western blot 收集各组HT29细胞,用RIPA裂解液裂解细胞收集蛋白;以BCA法测定样本蛋白浓度,上样于10%SDS-PAGE,后转移至PVDF膜,分别孵育CK8(1 ∶25 000)、ZO-1(1 ∶125)及occludin(1 ∶50 000)的I抗4 ℃过夜,次日抗兔 II 抗室温孵育2 h,凝胶成像分析仪进行ECL化学发光显影。实验结果由凝胶成像系统采集图像,数据由Quantity One软件分析。
3.5细胞旁通透性的检测 取对数生长期的各组HT29细胞,按1×105的密度接种到Transwell 培养板上,待Transwell板中细胞形成紧密单层后,按100 nmol/L的CRF加入培养基中,72 h后于Transwell上室加入1 g/L dextran-FITC 100 μL,下室加入500 μL PBS,避光置于37 °C恒温细胞培养箱中, 分别于0.5 h、1 h和2 h后从Transwell板底部取100 μL PBS,置于96孔板上,利用荧光分光光度计测量浓度,激发波长设定在 488 nm,发射波长设定在 525 nm。根据标准曲线计算dextran-FITC浓度。
3.6电镜观察 将2组细胞调整至每孔1×105接种于6孔板,加药72 h后用细胞刮器将细胞刮下后固定细胞于2.5%戊二醛内(>48 h)。按漂洗、固定、脱水、包埋,聚合、修块和切片染色顺序处理细胞。染色后将超薄切片放至单孔铜网上,电镜观察条件:Tecnai 10透射电镜,高压80 kV,照相。
3.7蛋白激酶C(protein kinase C, PKC)活性的测定 对HT29细胞培养至90%融合,加100 nmol/L CRF分别于5 min、10 min、30 min、1 h和2 h收集细胞样本,加入裂解液裂解细胞,收集并测定蛋白浓度。按照PKC活性试剂盒说明书进行检测,并计算PKC活性。并根据此次结果,采用100 nmol/L CRF处理慢病毒感染后的各组HT29细胞并收集细胞样本,进行PKC活性检测。
4 统计学处理
采用SPSS 20.0统计软件对实验数据进行处理,符合正态分布的计量资料用均数±标准差(mean±SD)表示。两组样本均数比较采用独立样本t检验,多组间均数比较采用单因素方差分析及LSD-t检验。以P<0.05为差异有统计学意义。
结 果
1 HT29细胞表面CRF受体的表达
激光共聚焦显微镜显示,红色为CRFR1及CRFR2特异荧光,蓝色为DAPI核染,提示HT29表面存在CRFR1及CRFR2表达,见图1。
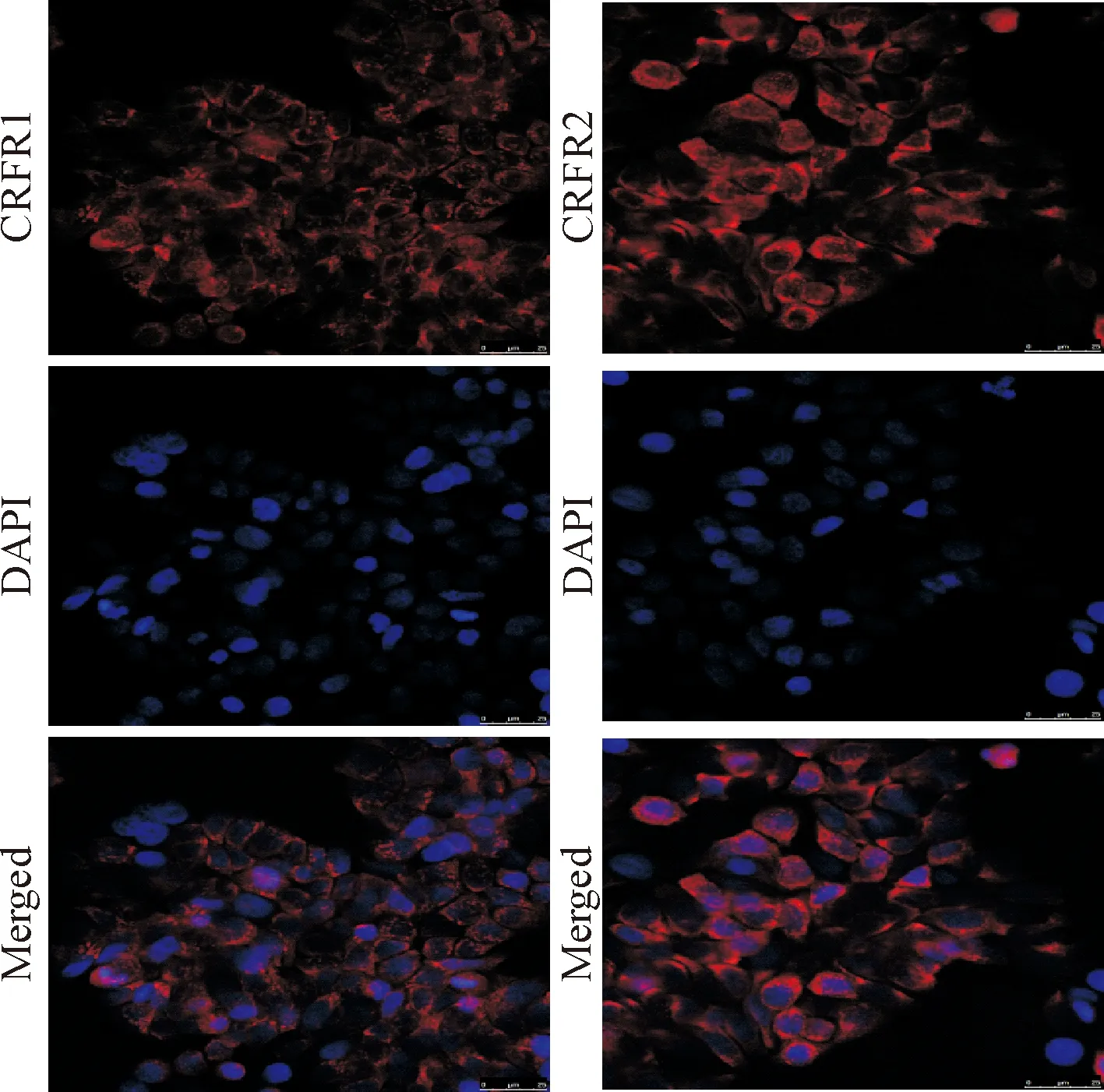
Figure 1.The expression of CRFR1 and CRFR2 in the HT29 cells was examined by immunofluorescence staining(×200). CRFR1 and CRFR2 expression on the HT29 cell membrane was examined after stained with Cy3-labelled antibodies (red). DAPI was used to counterstain the nucleus (blue).
图1 HT29细胞株CRFR1及CRFR2免疫荧光染色观察
2 CRF对HT29细胞旁通透性及细胞紧密连接超微结构的影响
Transwell实验结果提示,与对照组相比,HT29细胞在给予100 nmol/L CRF 0.5 h,细胞通透性改变的差异无统计学显著性,而给药1 h和2 h时,细胞通透浓度均增加(P<0.05),见图2A。电镜观察结果提示,对照组的HT29细胞间的紧密连接结构完整,通道关闭,连接致密(黄色剪头所示),而100 nmol/L CRF处理后细胞紧密连接结构不完整,连接疏松,通道开放(红色剪头所示),见图2B。
3 CRF对HT29细胞CK8及紧密连接蛋白表达的影响
Western blot结果提示,与对照组对比,CRF处理后 HT29细胞CK8的蛋白表达上调,而occludin及ZO-1的蛋白表达均下调(P<0.05),见图3A。共聚焦显微镜提示,红色为CK8特异荧光,蓝色为DAPI核染,与对照组相比,CRF处理后,HT29细胞表面CK8荧光强度增加,并在细胞膜上聚集,见图3B。
4 PKC活性的变化
与对照组相比,HT29细胞在CRF处理后1 h PKC活性降低最为显著(0.44±0.05vs0.27±0.05,P<0.05)。
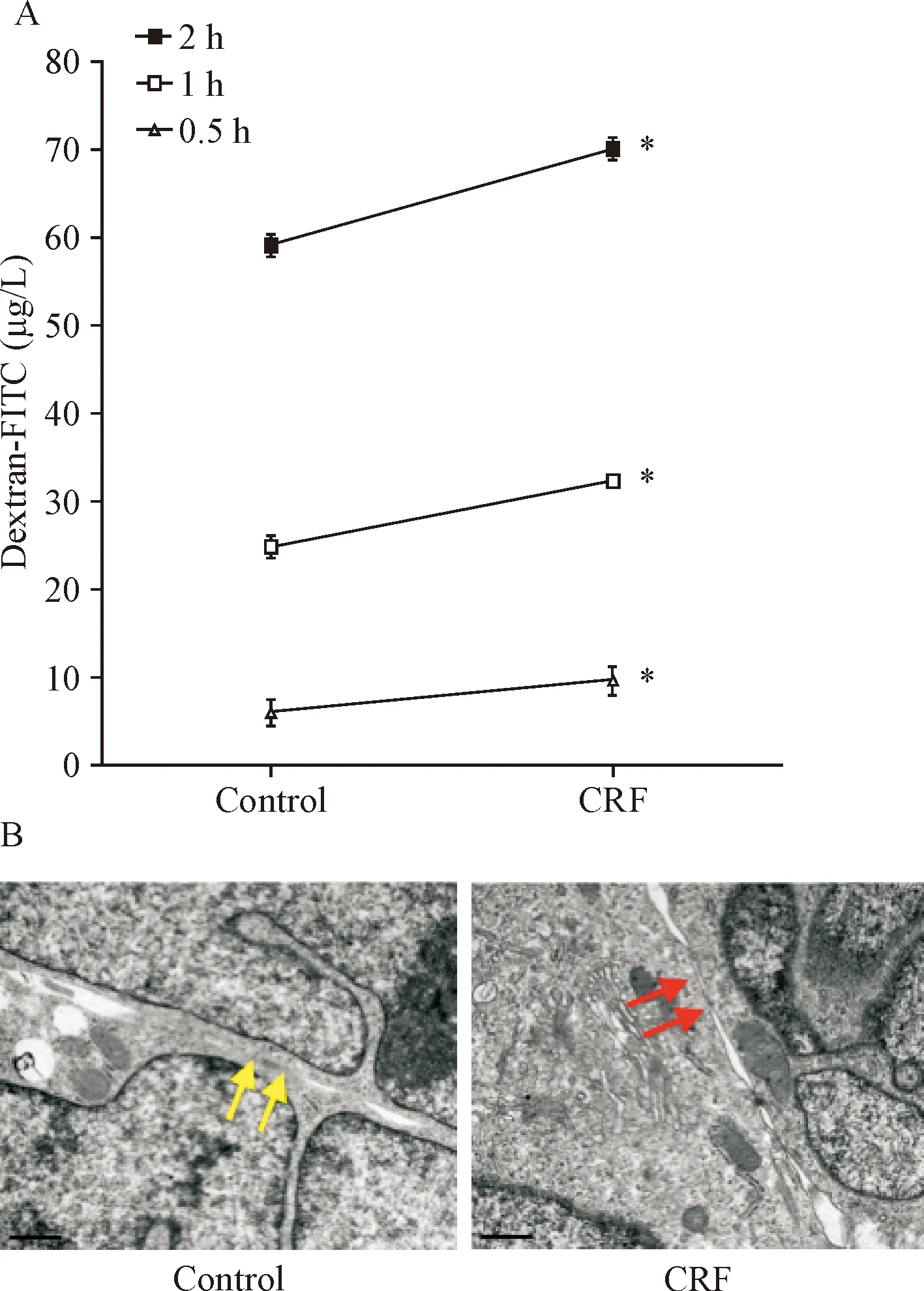
Figure 2.The effects of CRF on the paracellular permeability and ultrastructure of tight junctions (TJs) in the HT29 cells. A: the parancellular permeability of HT29 cells, as indicated by dextran-FITC, was mea-sured using a fluorescence spectrophotometer; B: the ultrastructure of TJs was observed under a transmission electron microscope(×8 300). The cells in CRF group were treated with 100 nmol/L CRF for 72 h. TJs were shown by arrows. Mean±SD.n=3.*P<0.05vsthe respective control group.
图2 CRF对HT29细胞旁通透性及紧密连接结构的影响
5 CK8基因沉默
Real-time PCR结果显示,sh-CK8组CK8 mRNA的表达水平(0.12±0.004)显著低于对照组(1.24±0.05)和sh-NC组(1.00±0.08)(P<0.05)。Wes-tern blot结果显示,sh-CK8组CK8蛋白的相对表达量显著低于对照组和sh-NC组(P<0.05),见图4。这提示感染sh-CK8慢病毒可显著降低CK8的蛋白表达水平。
6 CK8沉默后CRF对HT29细胞旁通透性及相关蛋白的影响
Transwell结果提示,CK8沉默后,sh-NC和sh-CK8组给予100 nmol/L CRF处理72 h,在2 h细胞通透浓度分别为(41.04±1.33) mg/L和(40.58±1.63)mg/L,且差异无统计学意义。Western blot结果表明,sh-CK8+CRF组ZO-1的表达对比sh-CK8组无明显差异,而sh-NC+CRF组ZO-1的表达明显低于sh-CK8+CRF组(P<0.05),见图5A; CRF处理后,各组occludin则表达下调(P<0.05),见图5B。在CRF处理1 h后,sh-NC+CRF组PKC活性对比sh-NC组及sh-CK8+CRF组显著降低(0.48±0.01vs0.41±0.01,P<0.05),sh-CK8+CRF组PKC活性较sh-CK8组无明显差异(0.43±0.004vs0.45±0.04,P>0.05)。
讨 论
IBS是临床常见的功能性胃肠病,其发病率呈现出逐年上升的趋势[8]。近年来,精神心理因素在IBS发病中的作用日益受到人们的关注,作为机体应激反应的重要介质,CRF广泛分布于人类胃肠道,并通过与其受体CRFR1、CRFR2以及CRF肽类家族相结合,参与应激相关胃肠道功能异常,包括内脏高敏感、肠道动力异常以及肠道黏膜通透性改变等[9-11]。有研究证实,急性应激释放的CRF能够直接作用于肥大细胞脱颗粒,通过分泌炎症介质改变黏膜通透性,引起肠屏障功能的破坏以加重IBS腹泻症状[12-13]。其中,肠上皮紧密连接作为肠黏膜屏障中最重要的连接方式,能够通过维持上皮细胞间的结构稳定及修复上皮细胞间物质运输来调节肠黏膜屏障的通透性[14-16]。而跨膜蛋白occludin及细胞质蛋白ZO-1是形成肠上皮紧密连接的关键蛋白,通过与肌动蛋白结合而参与维持其功能稳定[14, 17]。同时,应激IBS动物模型肠黏膜高表达的CK8,属上皮细胞骨架蛋白,在维持胃肠道上皮的结构和功能方面扮演着重要的角色,与紧密连接相关蛋白之间存在紧密联系[10, 18]。因此,探明CRF-CK8途径与IBS的肠黏膜通透性改变之间的关系,可以为明确IBS的病理生理机制提供新的视角。
本研究证实,CRF能够引起肠上皮细胞旁通透性的梯度增加,紧密连接通道开放,结构疏松,同时伴随CK8的表达上调,并在胞质内呈颗粒样改变;而紧密连接蛋白ZO-1和occludin均出现表达降低,表明应激相关因子CRF不仅可以引起CK8表达上调和分布改变,同时伴有紧密连接超微结构破坏,及其相关蛋白在表达水平的不同变化,最终引起肠上皮屏障通透性增高。然而CK8基因沉默却并不能阻断CRF引起的肠上皮细胞通透性增加,细究其具体蛋白变化,我们发现occludin的蛋白表达仍下调,但ZO-1的表达下降被成功抑制。我们知道,紧密连接蛋白按分布部位的不同,分为2类:一类为细胞膜蛋白,存在于细胞膜上,通常为跨膜结构,是构成选择性屏障功能的结构蛋白;另一类为细胞质蛋白,位于细胞质内,能与多种蛋白质结合,起连接膜蛋白与细胞骨架或传递信号分子的作用[14]。有研究指出,胞质蛋白ZO-1在稳定上皮紧密连接中具有关键作用,其PDZ区域可与跨膜蛋白occludin相互连接并相互作用,一旦ZO-1发生破坏,紧密连接的功能多随之改变[15, 19-21]。结合本研究结果,我们推测CRF能够通过上调CK8介导肠上皮紧密连接ZO-1低表达来增加肠上皮通透性。但本研究中,occludin在给予CRF刺激后蛋白表达仍下调,同时,肠上皮细胞通透性也未见明显差异,这说明CRF对肠上皮细胞紧密连接的破坏是多途径的,即使阻断了CRF-CK8途径,但由于仍存在跨膜紧密连接蛋白的破坏,因此并不能逆转CRF刺激后肠上皮通透性的增加。
Figure 3.The effects of CRF (100 nmol/L for 72 h) on the expression and distribution of CK8 and tight junction proteins in HT29 cells. A: Western blot analysis of CK8, occludin, and ZO-1 expression in the HT29 cells with or without CRF treatment; B: the expression levels of CK8 in the HT29 cells examined under confocal microscope(×3 000). The HT29 cells were stained with Cy3-labelled antibody against CK8 (red). DAPI was used to counterstain the nucleus (blue). Mean±SD.n=4.*P<0.05vscontrol group.
图3 CRF对HT29细胞CK8及紧密连接蛋白表达的影响
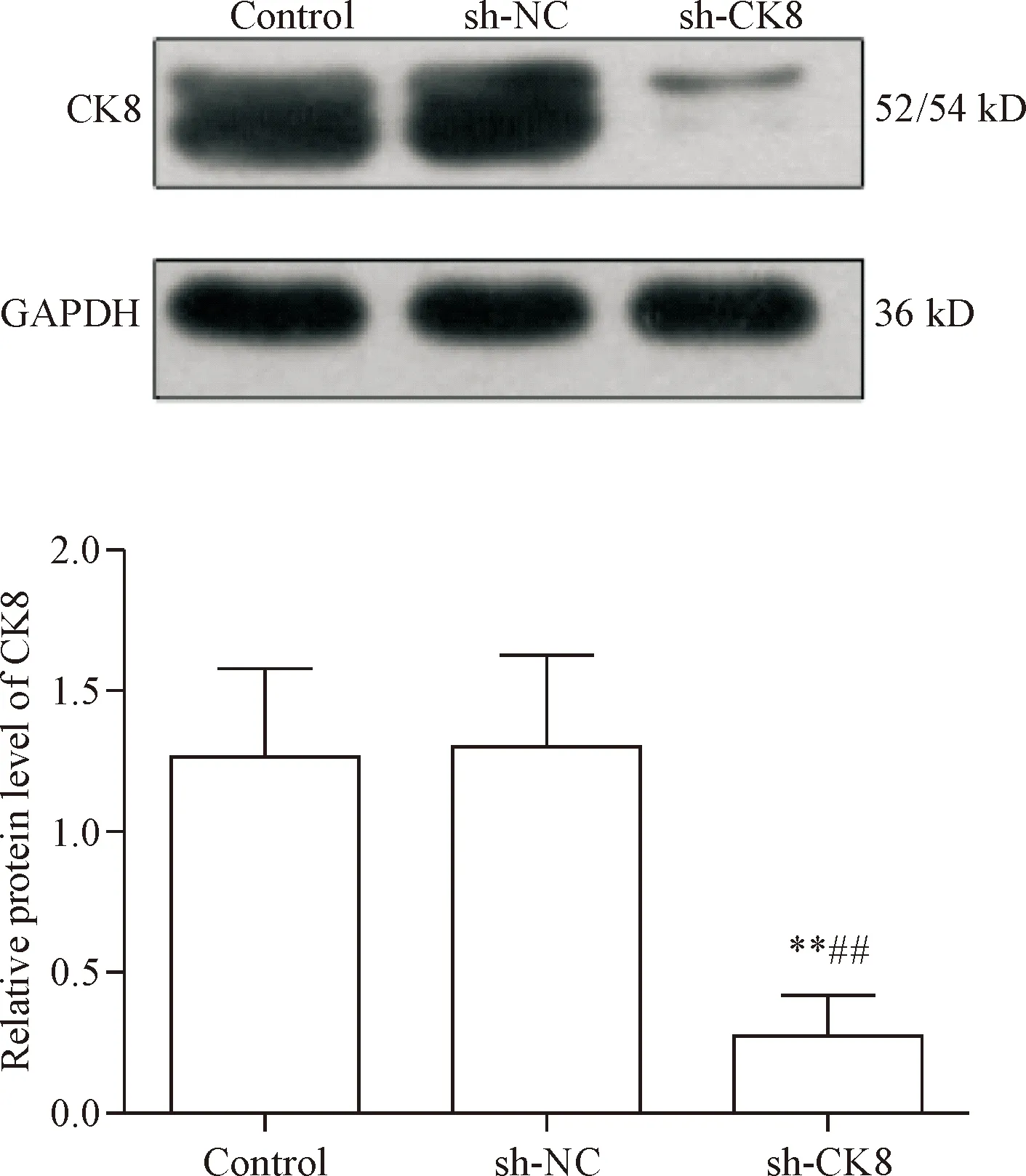
Figure 4.The protein expression of CK8 in the HT29 cells infected with sh-CK8 lentivirus. Western blot analysis revealed the significant down-regulation of CK8 protein expression in the sh-CK8 group. Mean±SD.n=3.**P<0.01vscontrol group;##P<0.01vssh-NC group.
图4 基因沉默后CK8蛋白的表达
PKC属于丝氨酸/苏氨酸激酶超家族一员,通过介导下游信号通路,参与细胞活化、增殖及分化等多种生物学功能。而大量研究显示,PKC介导的信号通路通过诱导紧密连接蛋白表达分布改变,直接调节紧密连接而在上皮屏障中发挥重要作用,同时,ZO-1和occludin等紧密连接相关蛋白上存在PKC的定位位点[22]。有研究报道,佛波酯刺激人结直肠癌上皮细胞T84细胞株24 h后,可以引起PKC活性下调并与其上皮通透性增加相关[23]。而本研究亦发现,CRF 刺激1 h后PKC活性明显下降。同时,CK8被报道可能参与PKC信号通路调控肌动蛋白的改变[24],因此,在CK8基因沉默后CRF并不能引起PKC活性的下调。由此,我们推测,CRF可能通过上调CK8抑制PKC途径介导紧密连接ZO-1低表达及结构紊乱参与调节肠上皮通透性改变。
结合已有的研究结果,我们认为CRF引起的肠上皮通透性增加可能与CK8表达增加有关,即CRF作用于肠上皮细胞可上调CK8表达,从而抑制PKC信号通路,降低紧密连接蛋白ZO-1的表达。同时亦存在其它途径共同参与CRF导致的肠上皮屏障受损,具体机制待进一步阐明。
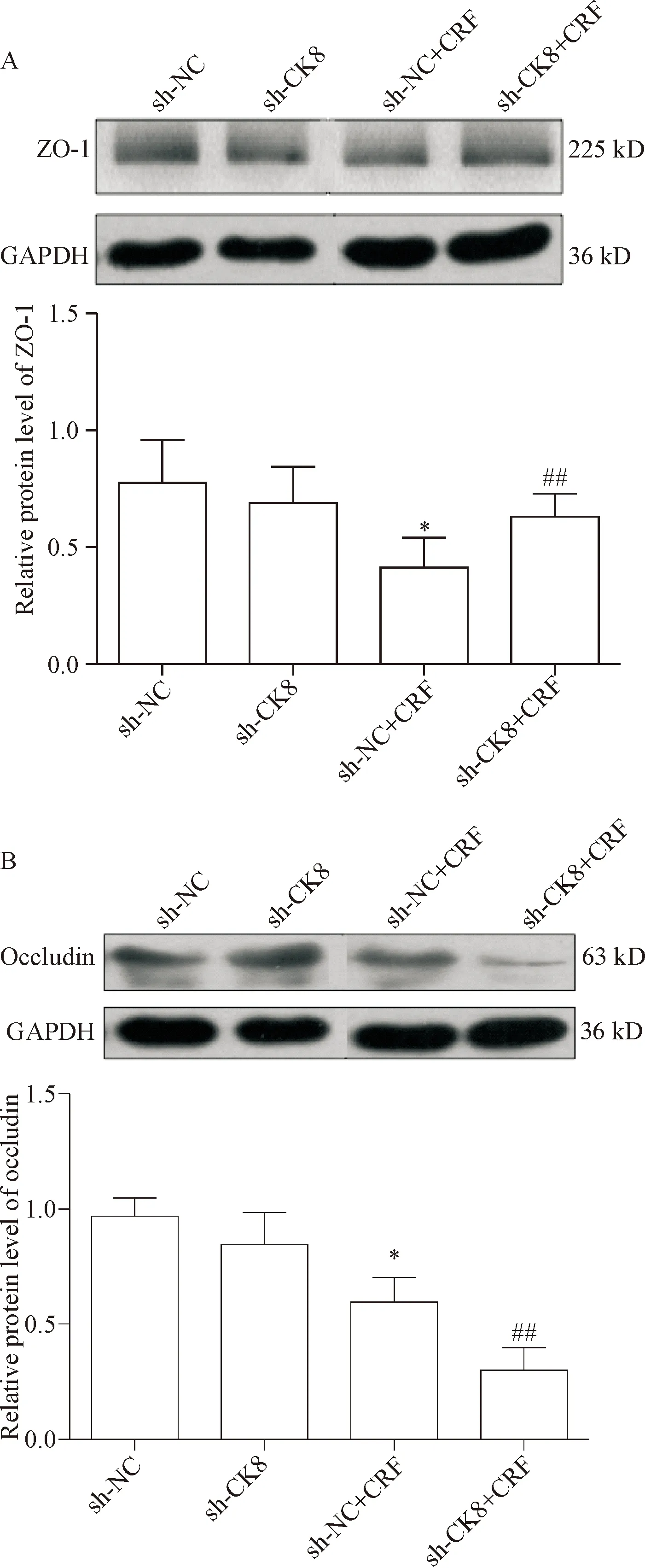
Figure 5.The effects of CRF (100 nmol/L for 72 h) on the expression of tight junction-related proteins inCK8-silencing HT29 cells were detected by Western blot analysis. A: Western blot analysis was used to determine the protein expression of ZO-1 in sh-NC and sh-CK8 HT29 cells with or without CRF treatment; B: Western blot analysis was used to determine the protein expression of occludin in the sh-NC and sh-CK8 HT29 cells with or without CRF treatment. Mean±SD.n=3.*P<0.05vssh-NC group;##P<0.05vssh-NC+CRF group.
图5 CRF对CK8基因沉默后HT29细胞ZO-1及occludin蛋白表达的影响

