青藤碱缓解氧化应激和炎症反应对四氯化碳诱导的急性肝损伤小鼠的保护作用①
郭 华 裴高油 李龙腾 徐文涛
(郑州铁路职业技术学院药学院,郑州451460)
肝脏是人体重要的代谢器官,负责碳水化合物、蛋白质和脂类的代谢,清除血液中的药物和毒素,调节免疫反应等。因此,肝脏经常会受到各种各样的损害,包括病毒性感染、创伤、化学试剂等。这些损害常常会导致细胞死亡和肝脏功能障碍[1,2]。随着中国人口老龄化加剧,医疗需求也在不断增加。药物和保健品的不合理使用使得药物性肝损伤的发生率也在增加[3]。肝损伤已成为临床医学和药物开发的一个重大挑战[4]。加深对肝损伤及其治疗方法的研究对人类医疗健康事业具有重要意义。据报道四氯化碳(CCl4)可诱发急性和慢性组织损伤。由于CCl4诱导的肝损伤机制与肝脏疾病非常相似,因此在实验性肝病中常被用于肝损伤动物模型的建立[5]。通过CCl4建立的急性肝损伤模型往往会产生氧化应激,炎症反应和细胞凋亡的增加[6]。青藤碱是一种从中药材青风藤中提取的异喹啉类物质,对风湿性关节炎有较好的治疗效果,甚至具有抗癌,缓解神经性疼痛及减轻脑出血损伤等功能[7-9]。但关于青藤碱肝脏保护作用的报道还十分罕见,有待进一步研究。本文的主要目的是探究青藤碱对四氯化碳诱导的急性肝损伤小鼠肝损伤、细胞凋亡、氧化应激和炎症反应的影响。
1 材料与方法
1.1材料 40只6周龄小鼠购自郑州大学实验动物中心。青藤碱(Sinomenine,SM)(货号与规格:SS8560-20 mg,纯度:HPLC≥98%)来源于Solarbio。天门冬氨酸氨基转移酶(Aspartate aminotransferase,AST)、丙氨酸转氨酶(Alanine aminotransferase,ALT)、超氧化物歧化酶(Superoxide dismutase,SOD)、丙二醛(Methane dicarboxylic aldehyde,MDA)、谷胱甘肽(Glutathione,GSH)、白细胞介素(Interleukin,IL)-6、IL-1β和肿瘤坏死因子(Tumor necrosis factor alpha,TNF-α)的酶联免疫吸附实验(Enzyme-linked immunosorbent assay,ELISA)检测试剂盒购自武汉默沙克生物科技有限公司。苏木素伊红(Hematoxylin-eosin,HE)染色试剂盒和脱氧核糖核苷酸末端转移酶介导的缺口末端标记(Terminal deoxynucleotidyl transferase-mediated dUTP nick labeling,TUNEL)细胞凋亡检测试剂盒购自碧云天生物技术公司。抗Bcl-2抗体和抗 Bax抗体购自英国Abcam公司。
1.2方法
1.2.1动物分组及药物处理 小鼠随机分为4组:健康对照组(Ctrl),青藤碱组(Sinomenine),CCl4模型组(CCl4),青藤碱处理组(CCl4+Sinomenine),每组10只。首先CCl4模型组和青藤碱处理组皮下注射40%的CCl4橄榄油溶液(1.5 ml/kg),2周一次,连续8周,对照组和青藤碱组皮下注射等量的橄榄油。上述处理的倒数第7天开始,青藤碱组和青藤碱处理组每天腹腔注射青藤碱20 mg/kg体重,连续注射7 d,对照组和CCl4组用生理盐水代替。
1.2.2ELISA检测 青藤碱处理7 d后,收集各组小鼠血清后按照ELISA试剂盒说明书步骤检测ALT、AST、SOD、MDA、GSH、IL-6、IL-1β和TNF-α水平。首先样品加入反应孔, 37℃孵育45 min。洗涤液洗涤4次后加入生物素标记的抗体,37℃孵育30 min。洗涤后再加链霉亲和素HRP混匀,37℃孵育30 min。然后加入显色剂避光显色15 min,最后添加终止液终止反应,450 nm处检测吸光值。
1.2.3HE染色 颈椎脱臼法处死小鼠后取出肝脏组织,用4% 的多聚甲醛对肝脏组织进行固定,4℃ 24 h。PBS清洗3次,用30%、50%和70%的酒精梯度脱水,每个梯度脱水10 min。再经脱水机中脱水后进行石蜡包埋和切片。各组小鼠的石蜡切片按照HE染色液说明书进行HE染色,显微镜下观察肝脏组织病变情况。
1.2.4TUNEL染色 按照试剂盒说明书首先将石蜡切片依次进行二甲苯脱蜡和梯度乙醇水化,再用蛋白酶K于20~37℃孵育15~30 min。PBS漂洗3次,再用3%的H2O2于室温孵育20 min。PBS清洗3次。然后进行生物素标记,显色,苏木素复染,梯度乙醇脱水,二甲苯透明。最后中性树胶封片,显微镜下观察拍照,细胞核呈棕色颗粒的为凋亡细胞。
1.2.5蛋白印迹 首先各组小鼠的肝脏组织按每20 mg加200 μl的比例加入裂解液,用匀浆器冰上匀浆5 min,4℃、4 200 r/min离心10 min,收集上清。等量蛋白进行SDS-PAGE凝胶电泳分离并转至PVDF膜,经5%的BSA封闭1 h,加入相应的一抗,4℃过夜孵育。第二天加入辣根过氧化物酶标记的二抗,室温孵育1.5 h。最后加入发光液于凝胶成像仪进行曝光和拍照,统计灰度值计算相对表达量。
1.3统计学处理 用SPSS16.0软件对实验数据进行统计学分析,各组间进行单因素方差分析后再进行duncan′s multiple ramge test检验。P<0.01认为差异存在统计学意义。
2 结果
2.1青藤碱对四氯化碳诱导的急性肝损伤小鼠肝功酶的影响 通过ELISA检测血清中ALT和AST水平,分析青藤碱对四氯化碳诱导的急性肝损伤小鼠肝功酶的影响。如图1所示,CCl4模型组ALT和AST水平高于对照组(P<0.01)。与CCl4模型组相比,青藤碱处理组ALT和AST水平下降(P<0.01)。由此可见,青藤碱可降低CCl4诱导的急性肝损伤小鼠血清中肝功酶ALT和AST水平。
2.2青藤碱对四氯化碳诱导的急性肝损伤小鼠肝脏组织病变的影响 通过HE染色观察青藤碱对四氯化碳诱导的急性肝损伤小鼠肝脏组织病变的影响。如图2所示,对照组和青藤碱组肝脏组织细胞排列规则,无明显病变。CCl4模型组出现肝脏组织细胞排列紊乱,肝细胞坏死,胞质空泡化,大量炎性细胞浸润等病变。青藤碱处理组的肝脏组织病变得到明显改善。上述结果表明,青藤碱可缓解四氯化碳诱导的急性肝损伤小鼠肝脏组织病变。

图1 ELISA检测血清中肝功酶水平Fig.1 Levels of serum hepatic enzymes were detected by ELISANote:**.P<0.01 vs control group;##.P<0.01 vs CCl4 group.

图2 HE染色观察肝脏组织病变Fig.2 Pathological changes of liver tissues were observed by HE staining
2.3青藤碱对四氯化碳诱导的急性肝损伤小鼠肝脏组织细胞凋亡的影响 利用TUNEL染色检测细胞凋亡,分析青藤碱对四氯化碳诱导的急性肝损伤小鼠肝脏组织细胞凋亡的影响。由图3可知,CCl4模型组细胞凋亡高于对照组(P<0.01)。与CCl4模型组相比,青藤碱处理组细胞凋亡下降(P<0.01)。上述结果说明,青藤碱可减轻四氯化碳诱导的急性肝损伤小鼠肝脏组织细胞凋亡。
2.4青藤碱对四氯化碳诱导的急性肝损伤小鼠细胞凋亡相关蛋白表达的影响 为进一步分析青藤碱对四氯化碳诱导的急性肝损伤小鼠细胞凋亡相关蛋白表达的影响,蛋白印迹检测Bcl-2和Bax表达。图4显示,CCl4模型组Bcl-2表达低于对照组,Bax表达高于对照组(P<0.01)。与CCl4模型组相比,青藤碱处理组Bcl-2表达上升,Bax表达下降(P<0.01)。以上结果表明,青藤碱可逆转四氯化碳诱导急性肝损伤小鼠细胞凋亡相关蛋白Bcl-2和Bax表达的异常。

图3 TUNEL染色检测细胞凋亡Fig.3 Apoptosis was measured by TUNEL stainingNote:**.P<0.01 vs control group;##.P<0.01 vs CCl4 group.
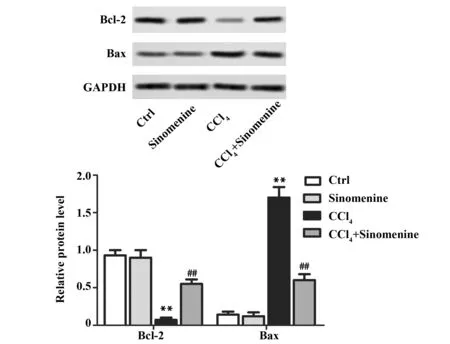
图4 蛋白印迹检测细胞凋亡相关蛋白表达Fig.4 Expression of apoptosis related proteins was tested by western blotNote:**.P<0.01 vs control group;##.P<0.01 vs CCl4 group.

图5 ELISA检测氧化应激指标Fig.5 Indexs of oxidative stress were detected by ELISANote:**.P<0.01 vs control group;##.P<0.01 vs CCl4 group.

图6 ELISA检测炎症因子水平Fig.6 Levels of inflammatory factors were measured by ELISANote:**.P<0.01 vs control group;##.P<0.01 vs CCl4 group.
2.5青藤碱对四氯化碳诱导的急性肝损伤小鼠氧化应激的影响 为分析青藤碱对四氯化碳诱导的急性肝损伤小鼠氧化应激的影响,ELISA检测SOD、MDA和GSH水平。由图5可知,CCl4模型组SOD和GSH水平低于对照组,MDA 水平高于对照组(P<0.01)。与CCl4模型组相比,青藤碱处理组SOD和GSH水平上升,MDA 水平下降(P<0.01)。上述结果说明,青藤碱可减弱四氯化碳诱导的急性肝损伤小鼠氧化应激。
2.6青藤碱对四氯化碳诱导的急性肝损伤小鼠炎症反应的影响 通过ELISA检测IL-6、IL-1β和TNF-α水平,分析青藤碱对四氯化碳诱导的急性肝损伤小鼠炎症反应影响。图6显示,CCl4模型组IL-6、IL-1β和TNF-α水平高于对照组(P<0.01)。与CCl4模型组相比,青藤碱处理组IL-6、IL-1β和TNF-α水平下降(P<0.01)。以上结果表明,青藤碱可降低四氯化碳诱导的急性肝损伤小鼠IL-6、IL-1β和TNF-α水平,减轻炎症反应。
3 讨论
目前针对肝损伤的药物治疗十分有限,N-乙酰半胱氨酸可用于治疗对乙酰氨基酚引起的肝损伤,以促进恢复和减少肝移植的需要。寻找开发新的有效的且副作用小的药物治疗迫在眉睫。近年来,随着科学技术的进步,许多植物化学物质得以分离,而这些化学物质具有成为治疗药物的潜能[10]。
大量文献报道青藤碱在改善各类疾病的组织病变方面发挥着积极作用。有研究发现青藤碱可改善脑内出血导致的脑积水及神经功能缺损等脑损伤[11]。有数据显示在大脑中动脉闭塞诱导的缺血再灌注损伤大鼠中,青藤碱可减轻大脑皮层的神经元退化变性等病变[12]。Zhao等[13]发现青藤碱可缓解缺血再灌注诱导的肾损伤大鼠肾脏组织肾小管坏死,炎性细胞浸润,小管扩张及水肿等病变。本研究结果显示,青藤碱可缓解四氯化碳诱导的急性肝损伤小鼠肝脏组织细胞坏死、胞质空泡化、大量炎性细胞浸润等病变。
细胞凋亡是十分重要的生理过程,大量数据表明青藤碱具有调节细胞凋亡的作用。据报道青藤碱可降低创伤性脑损伤大鼠脑组织细胞凋亡,减弱Caspase-3表达,增强Bcl-2表达[14]。有研究显示青藤碱可减弱大脑中动脉闭塞诱导的缺血再灌注损伤小鼠脑组织细胞凋亡[15]。Fu等[16]发现在外伤性脑损伤小鼠中,青藤碱可减轻细胞凋亡,降低Caspase-3和Bax表达,提高Bcl-2表达。本文结果显示,青藤碱可减弱四氯化碳诱导的急性肝损伤小鼠肝脏组织细胞凋亡,提高Bcl-2表达,降低Bax表达。
越来越多的研究表明青藤碱具有抗氧化应激的功效。Zhang等[17]发现在慢性间歇性缺氧所致肺损伤大鼠中,青藤碱可降低MDA水平,提高SOD及CAT水平。有数据显示在单侧输尿管梗阻诱导肾纤维化小鼠中,青藤碱可升高肾脏组织CAT,SOD和GPx水平[18]。据报道青藤碱可降低支气管哮喘小鼠MDA水平及髓过氧化物酶活性,增强总抗氧化能力[19]。本研究结果显示,青藤碱可提高四氯化碳诱导的急性肝损伤小鼠SOD和GSH水平,降低MDA 水平,减弱氧化应激。
炎症在肝损伤过程发挥着重要作用[20]。大量文献报道青藤碱具有抗炎的功能。有研究表明青藤碱可减弱单侧输尿管结扎诱导肾损伤小鼠IL-1β和TNF-α表达[21]。Qiu等[22]发现缺血性中风小鼠中,青藤碱可降低IL-1β、IL-6、IL-18和TNF-α水平。据报道青藤碱可降低慢性哮喘小鼠IL-4、 IL-5和IL-13水平[23]。本文结果显示,青藤碱可降低四氯化碳诱导的急性肝损伤小鼠IL-6、IL-1β和TNF-α水平,减轻炎症反应。
本研究表明,在四氯化碳诱导的急性肝损伤小鼠中,青藤碱可降低肝功酶ALT和AST水平,缓解肝脏组织细胞坏死、胞质空泡化、大量炎性细胞浸润等病变,减轻细胞凋亡、增强Bcl-2表达、减弱Bax表达,降低MDA水平、提高SOD和GSH水平,降低IL-6,IL-1β和TNF-α水平。综上所述,青藤碱可减轻四氯化碳诱导的急性肝损伤小鼠肝损伤,细胞凋亡,氧化应激及炎症反应。下一步计划研究青藤碱在其他因素导致的肝损伤中作用,为肝损伤的治疗提供理论依据。

