PLGA纳米微粒对树突状细胞表型和功能的影响①
陈明水 李洁羽 陈淑萍 叶韵斌
(福建省肿瘤医院,福州350014)
树突细胞(Dendritic cells,DC)肿瘤疫苗在肿瘤免疫治疗中起重要作用,DC是体内功能最强的专职性抗原提呈细胞,在抗感染及抗肿瘤免疫中具有独特的地位。佐剂在疫苗中被认为是起到存储抗原的作用,同时也能影响抗原递呈细胞。DC在体内的生物学功能受多种因素影响,调节DC的成熟状态能影响树突状细胞的免疫效应[1,2]。用纳米微粒(Nanoparticle,NP)为载体包载肿瘤抗原和佐剂刺激DC细胞能产生更有效的免疫应答[3,4],在这些研究中DC细胞除了摄取抗原和佐剂之外,DC细胞也能摄取纳米微粒,因此纳米微粒能影响DC的递呈抗原作用。聚乳酸-羟基乙酸共聚物是由乳酸和羟基乙酸聚合而成一种可降解的高分子有机化合物,由于其具有优良的生物相容性和生物可降解性在医药生物领域得到广泛应用,本研究探讨PLGA纳米微粒对DC细胞表型和功能的影响,并探讨其装载抗原肽负载DC细胞诱导免疫应答的作用,为基于PLGA纳米微粒的抗肿瘤作用提供依据。
1 材料与方法
1.1主要试剂与仪器 聚乳酸-羧基乙酸[poly(D.L-lactide-co-glycolide),PLGA](MW 23 000 50∶50)、聚乙烯醇PVA(Polyvingl acetate)购自山东岱罡公司;二氯甲烷(Dichloromethane,DCM)、香豆素-6(Coumarin-6)购自Sigma公司;粒细胞-巨噬细胞集落刺激因子(Granulocyte-macrophage colony stimulating factor,GM-CSF)购自BD公司;IL-4购自Perprotech公司;ELISPOT检测试剂盒购自R&D公司。T2细胞、TIL1520细胞购自ATCC;黑色素瘤抗原肽gp100-154-162(KTWGQYWQV)由GenScript Corp公司合成,用HPLC分析其纯度>95%,用DMSO溶解,-20℃保存;抗人IFN-γ购自Mabtech公司;鼠抗人抗体:HLA-DR-PE、CD83-PE、CD80-PE、CD86-PE,相应的同型对照:IgG2a-PE、IgG1-PE 购自BD Pharmingen公司;扫描电镜为FEI公司产品;NanoPlus为麦克仪器公司产品;超声粉碎仪为宁波新艺公司产品;磁力加热搅拌器为上海司乐仪器有限公司产品;酶标仪为Thermos公司产品;低温高速冷冻离心机购自HITACHI公司。
1.2方法
1.2.1DC的诱导及鉴定 抽取外周抗凝血,用淋巴细胞分离液分离PBMC,用DC培养液调细胞浓度1×106ml-1,接种在6孔细胞培养板,3 ml/孔,贴壁2 h,用PBS洗去未贴壁的细胞然后加入DC培养液及GM-CSF、IL-4,37℃、5%CO2温箱孵育,此后隔天换液并加GM-CSF、IL-4,在第7天加入TNF-α,48 h后收集成熟的DC,流式细胞仪检测DC表型。
1.2.2纳米微粒制备与表征 称取30 mg PLGA溶于1.5 ml CHCl2中,加入事先与BSA混合的抗原肽(gp100-154-162),在4℃ 55 W电压下超声9 s、间歇3 s、共3 min,加入2%PVA溶液6 ml,超声同上,即制得纳米-抗原肽悬液,将此悬液放通风橱中磁珠搅拌过夜,然后在4℃ 12 000 r/min离心30 min,洗涤3次,以去除游离的抗原肽,最后一次离心沉淀物用双蒸水溶解,低温冷冻干燥器中干燥24 h 即制得纳米-抗原肽微粒。用同样方法制备含有香豆素-6的纳米微粒(NP-C6)和空白纳米微粒。用扫描电镜、NanoPlus纳米粒度分析仪检测纳米微粒的表征。
1.2.3纳米微粒包载抗原肽检测 取上述离心、洗涤的上清液,用HPLC测定抗原肽的含量。以含10%乙腈和0.1%三氟乙酸水溶液为流动相,设定柱温为30℃,进样量10 μl,以0.8 ml/min的固定流速在12 min内洗脱样品。HPLC检测上清液中抗原肽含量,包载入纳米微粒的抗原肽=加入的抗原肽量-上清液抗原肽量。
1.2.4DC摄取纳米微粒 取0.5 ml浓度为1×106个/ml上述诱导的DC细胞接种于6孔细胞培养板,加入一定量的NP-C6,孵育24 h后收集细胞,用预冷的FACS缓冲液洗涤2遍,去除未被摄取的纳米微粒,用FACS缓冲液重悬DC,流式细胞仪检测DC/NP-C6细胞平均荧光强度(MFI),用以检测DC摄取纳米微粒。另吸取一定量的DC/NP-C6细胞用4%PFA固定,洗涤,再用DAPI染色,用共聚焦显微镜观察DC细胞摄取纳米微粒的情况。
1.2.5负载纳米微粒后DC表型检测(DC/NPs表型分析) 将外周血PBMC诱导的imDC在第7天加入空载纳米微粒CNP,5%CO2、37℃孵育12 h后加入TNF-α,继续培养至第9天收获细胞;用HLA-DR-PE、CD83-PE、CD80-PE、CD86-PE荧光标记抗体染色。使用TNF-α刺激后的DC作为对照,流式细胞仪检测DC表型:HLA-DR、CD80、CD83、CD86。
1.2.6负载纳米微粒的DC刺激同种异体淋巴细胞增殖反应 将上述诱导的DC/CNP及单纯DC,加入丝裂霉素C(25 μg/ml),37℃水浴30 min,灭活作为刺激细胞,淋巴细胞作为效应细胞。刺激细胞加入量为1×104/孔,刺激细胞与效应细胞之比为1∶5,加入96孔培养板中。实验分组为:①空白组:加培养液;②对照组:淋巴细胞;③实验组:NP+淋巴细胞、DC+淋巴细胞、DC/NP+淋巴细胞。每组各3个复孔,于5%CO2、37℃培养箱中培养3 d,每孔弃去110 μl上清,加入 MTT 10 μl,孵育4 h,每孔加入DMSO 110 μl,490 nm波长测OD值,计算各组刺激指数(SI)。SI=(实验组OD值-空白组OD值)/(对照组OD值-空白组OD值)。
1.2.7纳米微粒对DC递呈抗原作用的影响 诱导培养的imDC分成两组,第一组在第5天时加入100 μg/ml 的NP/gp100-154-162,5%CO2、37℃孵育1 h,加入TNF-α 1 000 U/ml,继续培养至2 d收获细胞,记为DC1/NP-gp100-154-162;第二组在第5天时加入NP-gp100-154-162、5%CO2、37℃孵育1 h,加入TNF-α 1 000 U/ml,继续培养4 d收获细胞,记为DC2/NP-gp100-154-162;同样在imDC中于第5天加入gp100-154-162,分别继续培养至第7天和第9天收获细胞,记为DC1/gp100-154-162与DC2/gp100-154-162。收集上述各组DC细胞备用。以DC1/NP-gp100-154-162、DC2/NP-gp100-154-162、DC1/gp100-154-162、DC2/gp100-154-162及DC/NPs作为刺激细胞,以TIL1520作为效应细胞,实验分为对照组:DC+TIL1520、DC/CNP+TIL1520;阳性对照组:T2/gp100-154-162+TIL1520;实验组:DC1/gp100-154-162、DC2/gp100-154-162、 DC1/NP-gp100-154-162、DC2/NP-gp100-154-162,每孔加入的刺激细胞及效应细胞数各5×104个/孔,刺激细胞与效应细胞按1∶1比例加入,用ELISPOT法检测分泌IFN-γ的细胞数。ELISPOT检测采用瑞典Mabtech公司试剂盒,采用Millipore公司的96孔培养板,按试剂盒说明操作,即每孔先用30%酒精润湿,加入抗人IFN-γ抗体,4℃过夜,然后用PBS洗涤,加入含10%血清的培养液,37℃ 2 h以封闭非特异性位点,PBS洗涤,加入100 μl/孔生物素鼠抗人IFN-γ抗体,室温孵育2 h,PBS洗涤,加入卵白素-生物素辣根过氧化物,室温孵育1 h,洗涤,最后加底物显色剂,2~3 min 后用蒸馏水冲洗终止,用ELISpot分析仪计数分泌IFN-γ的细胞数。
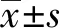
2 结果
2.1DC的诱导及鉴定 PBMC经过8 d培养可诱导为典型的DC细胞,表面表达DC标志CD80、HLA-DR、CD83、CD86分别为:25.21%、86.43%、41.62%和47.31%,如图1。
2.2纳米-抗原肽微粒表征 用复乳溶剂蒸发法制得纳米-抗原肽乳剂为乳白色均匀悬液,扫描电镜观察纳米微粒为圆形(图2A),NanoPlus测得纳米微粒180~230 nm(图2B); HPLC检测显示每毫克NP包载67 μg抗原肽。
2.3DC摄取纳米微粒 当DC细胞与NP-C6孵育24 h,流式细胞仪检测显示DC细胞MFI显著增强(图3A),激光共聚焦显微镜结果显示DC胞浆有较强的绿色荧光(图3B),这说明DC细胞能有效摄取NP-C6。
2.4负载纳米微粒后DC表型检测 流式细胞仪检测DC细胞摄取PLGA纳米微粒后表型变化。结果显示:负载纳米微粒后DC表面标志CD80、CD83、CD86、HLA-DR的表达均有所增加,提示PLGA纳米微粒可促进DC成熟及表面标志的表达,如图4,绿色部分峰为阴性对照。
2.5负载纳米微粒的DC刺激同种异体淋巴细胞增殖反应 混合淋巴细胞反应结果显示,DC/NP组混合淋巴细胞增殖反应明显高于单纯DC组和单纯NP组,刺激指数分别为(183.3±9.76)%、(121.58±3.02)%和(105.11±6.94)%(P<0.05),这表明纳米微粒能促进DC对T细胞的增殖反应。见图5。
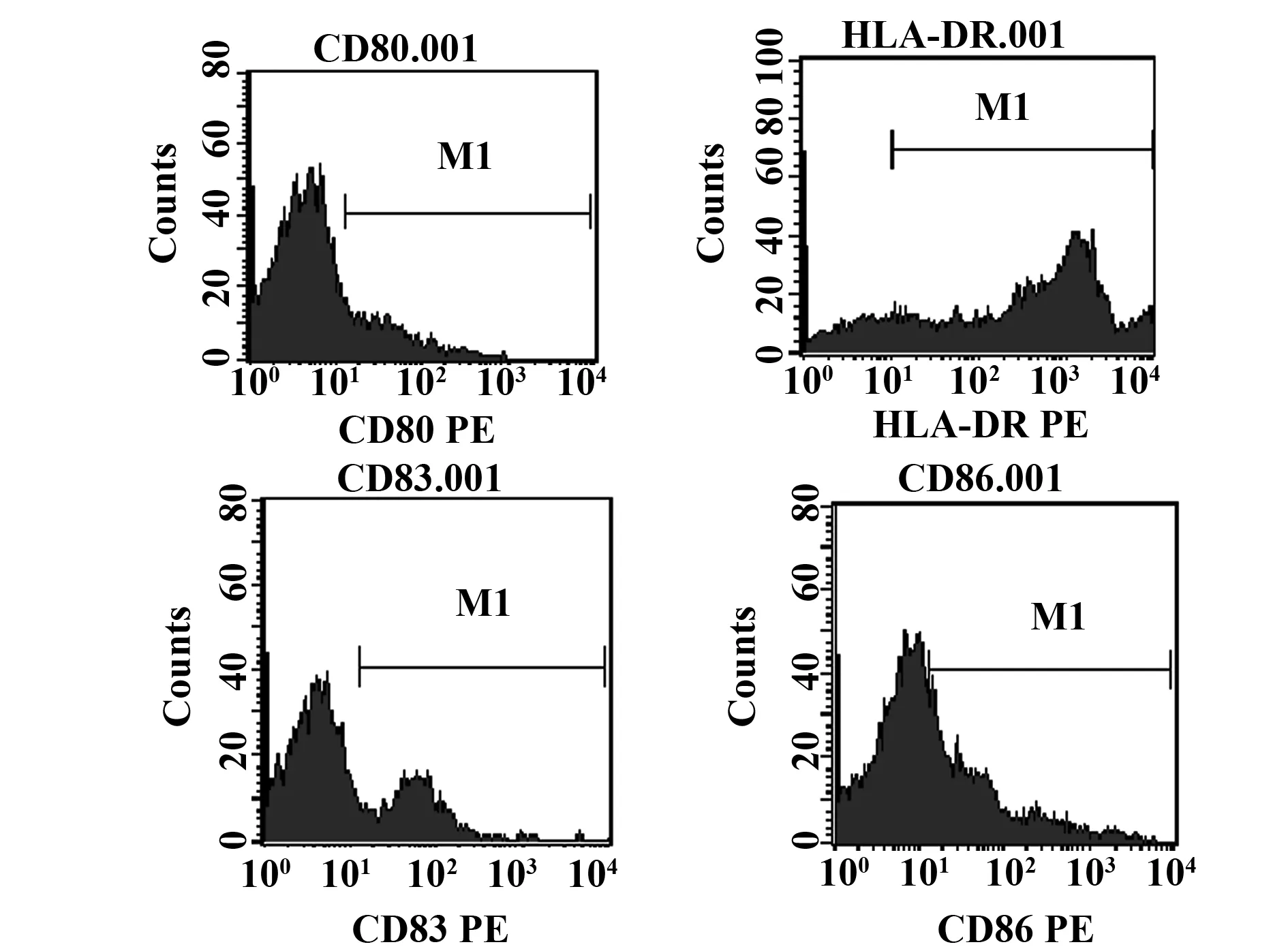
图1 流式检测DC表面标志Fig.1 Phenotype of DCs were analyzed by flow cytometry
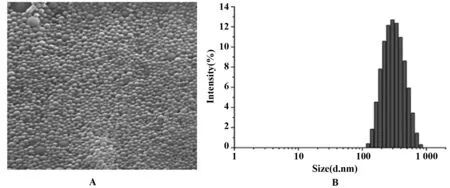
图2 纳米微粒形态和大小分布Fig.2 Morphology and size distribution of nanoparticleNote: A.SEM,×50 000;B.NanoPlus.
图3 树突细胞摄取纳米微粒检测Fig.3 Dendritic cell uptake nanoparticleNote:A.Flow cytometry;B.Confocal microscape.
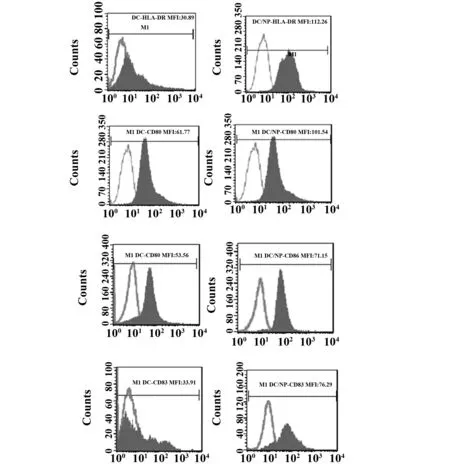
图4 流式细胞术检测负载纳米微粒后DC表型Fig.4 Phenotype of mDC treated with NP compare with untreated DC by flow cytometry
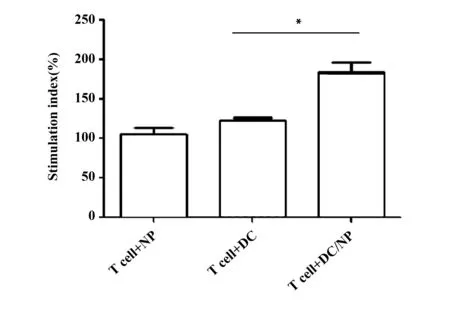
图5 DC负载纳米微粒刺激T细胞增殖Fig.5 DC loaded with nanoparticle stimulators of T-cells proliferation when compared to untreated mDCNote:*.P<0.05.
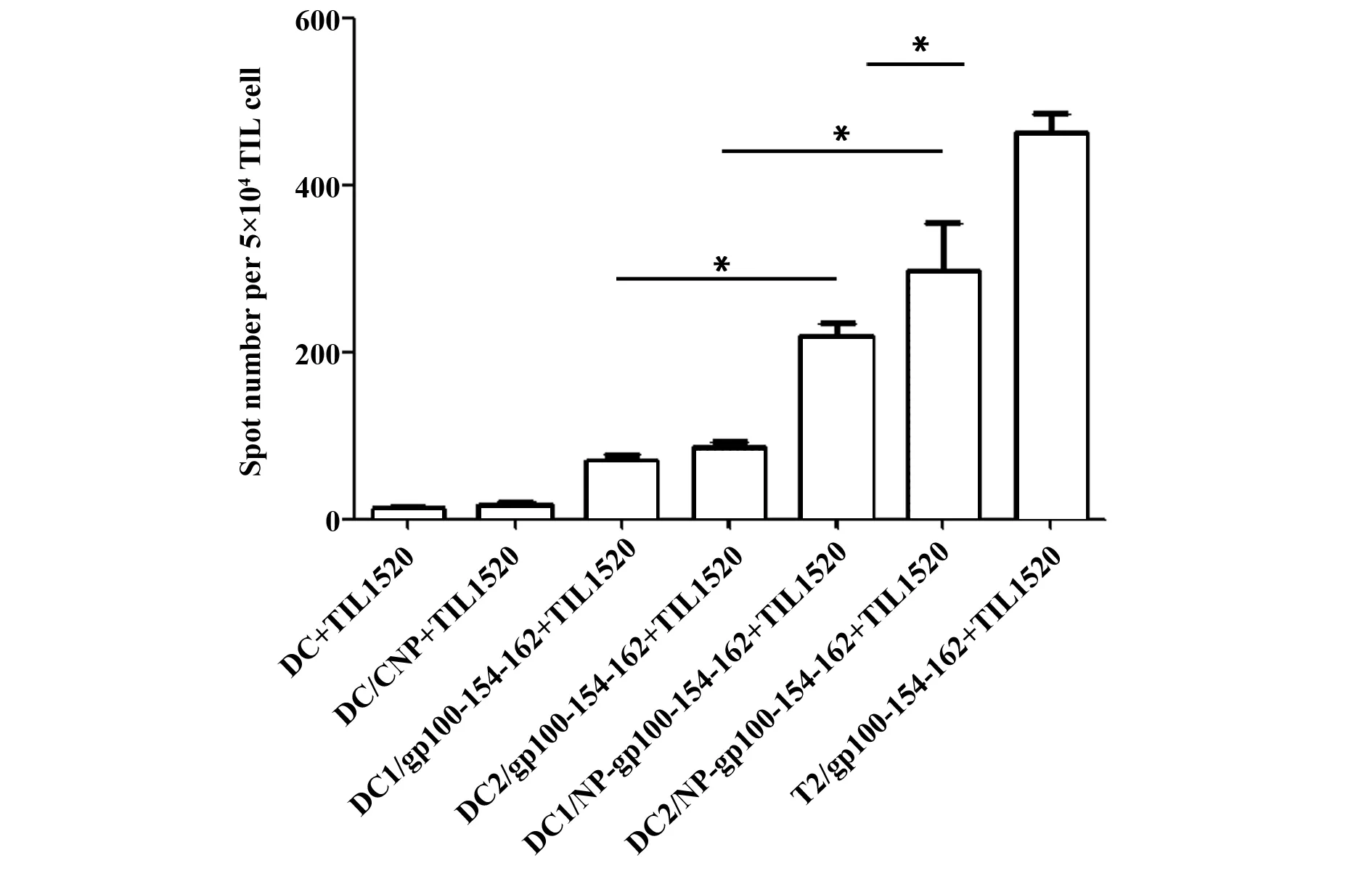
图6 纳米微粒包载抗原肽促进DC递呈抗原作用Fig.6 Effect of Nanoparticle on ability of antigent presention of DCsNote:*.P<0.05.
2.6纳米微粒促进DC递呈抗原作用 DC递呈抗原能力以引起效应细胞活化为标志,检测效应细胞分泌IFN-γ可反映效应细胞活化程度。本研究用免疫斑点法(ELISPOT)检测效应细胞分泌IFN-γ,结果显示:用与纳米-抗原肽孵育2 d和4 d的DC细胞刺激TIL1520细胞产生IFN-γ+细胞数明显多于DC与单纯抗原肽孵育2 d和4 d刺激效应细胞产生的IFN-γ+细胞数(P<0.05);同样,用与纳米-抗原肽孵育4 d的DC细胞刺激TIL1520细胞产生IFN-γ+细胞数明显多于纳米-抗原肽孵育2 d的DC细胞(P<0.05),见图6,这说明纳米微粒包载抗原肽能延缓抗原作用时间,促进DC递呈抗原作用,促进效应细胞活化。
3 讨论
利用树突状细胞负载肿瘤抗原制备肿瘤疫苗是肿瘤主动免疫治疗的主要方式,输送抗原至抗原递呈细胞特别是树突状细胞,是启动和调节免疫应答的关键步骤[5,6],树突状细胞在免疫反应中起重要作用,成熟的DC诱导免疫应答而不成熟的DC诱导免疫耐受[7]。促进DC细胞的活化和成熟是抗肿瘤免疫的主要手段,越来越多研究表明纳米微粒在介导DC免疫应答过程中起重要作用,纳米微粒与DC结合能进一步提高DC介导的免疫效应功能,用纳米微粒包载免疫抑制剂或免疫刺激剂负载DC细胞比单纯免疫调节剂能更有效调节DC诱导的免疫应答效果[8,9]。Clawson等[10]研究显示将Hp91短肽包载入或与PLGA纳米微粒偶联刺激DC活化比单纯Hp91高5和20倍,包载肿瘤抗原Tag和佐剂CpG的纳米微粒能促进DC成熟和活化[11]。用于包载生物活性物质的纳米材料有多种,如纳米脂质体、金属纳米微粒、聚合物纳米微粒等。聚乳酸-羟基乙酸共聚物(PLGA)由于具有良好的生物相容性和生物可降解特性是近年来备受青睐的载体材料之一。用纳米微粒包载抗原能促进抗原被DC摄取,提高抗原的利用率,我们前期研究显示用NP包载肿瘤抗原能增强抗原的免疫原性,诱发较强的免疫反应[12]。
DC疫苗的佐剂可以帮助抗原激发快速、有效、持久的免疫反应,从而提高疫苗的效率和细胞免疫效果。目前发现较多的DC疫苗佐剂,如CpG寡聚脱氧核苷酸(CpG-ODN)、LPS、单磷脂A等,其增强DC抗原递呈能力的机制表现为促进DC成熟和分泌细胞因子。如壳聚糖/γ-PGA纳米微粒促进DC细胞表达CD86、CD40、HLA-DR,并分泌TNF-α、IL-12p40等炎性因子[13]。我们研究显示负载PLGA纳米微粒的DC表面HLA-DR、CD83、CD80、CD86等平均荧光强度(MFI)表达增强,表明纳米微粒能促进DC的成熟。混合淋巴细胞反应显示,负载纳米微粒的DC能促进T细胞的增殖作用,说明PLGA纳米微粒能促进DC的活化。粒径是影响纳米粒子在体内运输和被抗原递呈细胞吞噬的重要因素,粒径小于500 nm的纳米微粒能被DC有效摄取[14],最佳摄取作用为粒径200~300 nm的纳米微粒[15,16],DC摄取纳米微粒随着DC-NP孵育时间延长而增加,在体外孵育24 h有50%~60%的纳米微粒被摄取[17]。我们制备了粒径为180~230 nm的纳米微粒,能被DC有效摄取。用流式细胞仪和共聚焦显微镜观察均显示,NP-C6与DC孵育12 h能被DC有效摄取。
纳米微粒包载抗原能使抗原缓慢释放维持较长时间,产生更加有效的免疫应答。Zhu等[18]制备了包载黑色素瘤抗原肽TRP2和佐剂的二氧化硅纳米微粒,这种纳米微粒能有效保护抗原肽、延长抗原肽的释放,增强DC诱导针对B16黑素瘤的有效TRP2特异性CD8+T细胞应答的效率和能力。为了进一步研究PLGA纳米微粒在DC抗肿瘤免疫中的作用,我们用PLGA纳米微粒包载黑色素瘤抗原肽gp100-154-162负载DC诱导TIL细胞免疫反应,结果显示用纳米微粒负载抗原肽处理的DC能诱导较强的免疫反应,这可能是因为NP-gp100-154-162在DC内存在较长时间,抗原在DC内得到充分加工处理,且持续、缓慢释放到DC表面,刺激较多的T细胞分泌IFN-γ,说明纳米微粒能延长并增强DC递呈抗原的能力。因此,PLGA纳米微粒包载抗原肽促进免疫应答的原因除了免疫刺激剂诱导免疫应答的发生外,PLGA纳米微粒也可能促进DC的活化和成熟,从而进一步增强DC的免疫应答。本研究用复乳溶剂蒸发法制得的纳米微粒能被DC有效摄取,促进DC成熟和抗原递呈作用。本研究表明,PLGA纳米微粒既可作为一种免疫佐剂促进DC的成熟增强其递呈抗原能力,又能使包被其中的抗原产生有效、持续较长时间的免疫反应从而提高细胞免疫效果。

