let-7i通过调控HMGA1抑制乳腺癌细胞的生长和迁移①
秦明明 冯 钢 刘小岑 章 健 郑 瑞 浦 春
(皖南医学院第一附属医院检验科,芜湖241001)
乳腺癌(Breast cancer,BC)是世界范围内严重威胁女性健康和生命的恶性肿瘤,具有较高的发病率和死亡率[1]。幸运的是,乳腺癌如果能早期诊断并及时治疗,多数患者能够取得满意的效果,但仍有30%左右早期乳腺癌治疗后会发生复发和转移[2,3]。因此,发现和研究新的乳腺癌治疗分子靶点成为当前研究的重点和热点。微小RNA(miRNA)是一种内源性的、非编码小分子RNA。主要通过结合下游靶基因的3′UTR影响RNA的沉默及基因表达转录后的调控[4]。miRNAs的异常表达与多种人类肿瘤细胞的生长、转移、肿瘤患者的预后等密切相关[5-7]。let-7家族是最早被发现的肿瘤抑制RNA,在调控肿瘤细胞的生长、转移等过程中发挥重要的作用。然而,关于let-7i在乳腺癌中的作用及其机制的研究相对较少。本研究中,我们通过体外细胞的CCK-8、平板克隆、划痕及侵袭试验评估let-7i对乳腺癌细胞的生长、迁移等功能的作用;并通过RT-PCR和Western blot检测let-7i对乳腺癌细胞中HMGA1水平的影响以及乳腺癌组织中let-7i和HMGA1的表达,以研究let-7i对乳腺癌细胞的作用及其可能的分子机制。
1 材料与方法
1.1材料
1.1.1乳腺癌组织和癌旁组织 收集2016年5月~2017年5月在皖南医学院第一附属弋矶山医院确诊为乳腺癌组织标本34例(癌组织和癌旁组织)。所有乳腺癌患者均经过术后组织的病理诊断。收集的组织标本立即冷冻保存于液氮中,所有患者在采集样本前均未接受任何放疗、化疗或免疫治疗。所有患者均提供书面同意。研究方案已获皖南医学院机构伦理审查委员会批准。
1.1.2乳腺癌细胞株 人乳腺癌细胞株MCF-7由皖南医学院附属弋矶山医院中心实验室提供。Hyclone DMEM/HIGH GLUCOSE培养基购自赛默飞世尔科技(中国)有限公司;胎牛血清购自Gibco公司;RNA转染试剂Entranster-R4000购自北京英格恩生物科技有限公司。
1.1.3其他相关试剂和仪器 mRNA的逆转录和定量PCR分别采用RevertAidTMFirst Strand cDNA Synthesis Kit[Thermo,上海赛默飞世尔科技(中国)有限公司]和SYBR®Premix Ex TaqTMkit[TaKaRa, 宝日医生物科技(北京)有限公司];microRNA的逆转录和定量PCR分别采用 miRcute miRNA cDNA第一链合成试剂盒和miRcute增强型miRNA荧光定量检测试剂盒(天根,北京天根生化科技有限公司)。let-7i mimic、let-7i阴性对照和let-7i、HMGA1引物均购自广州锐博生物科技有限公司;兔抗人单克隆抗体(一抗)和羊抗兔IgG(二抗)均购自Abcam;CCK-8试剂盒是江苏碧云天生物技术公司产品。逆转录仪器为美国Labnet PCR仪;定量测定的仪器为ABI 7500序列检测系统 (Life Technology,美国);Western blot测定仪器购自伯乐生命医学产品(上海)有限公司。
1.2方法
1.2.1组织中总RNA的提取、逆转录和荧光定量PCR 用Trizol Universal (天根,北京天根生化科技有限公司)提取50 mg冷冻组织总RNA,用凝胶电泳可视化rRNA条带分析提取RNA的完整性。用分光光度法确定提取总RNA的纯度,并根据生产厂家的指示,进行let-7i和HMGA1的逆转录和定量测定。miRNA let-7i 和U6 的RT-PCR引物(每组一对RT引物和PCR引物)由锐博生物科技有限公司合成;HMGA1上游引物序列:5′-TCCATTCTTCGACATCCGTCA-3′,下游引物序列:5′-GATCGTGGGCAGAACAGGAG-3′,扩增产物大小为80 bp;GAPDH的上游引物序列:5′-CATCAAGAAGGTGGTGAAGCAG-3′,下游引物序列:5′-GTGTCGCTGTTGAAGTCAGAG-3′,扩增产物大小为99 bp。将U6和GAPDH作为内参,采用2-ΔΔCt法计算micro let-7i和HMGA1 mRNA的相对表达。
1.2.2蛋白质提取及Western blot MCF-7细胞被转染let-7i mimic和阴性对照24 h后,采用改良的放射免疫沉淀法(RIPA,Vazyme Biotech,碧云天)裂解缓冲液和苯甲磺酰氟(PMSF,碧云天)提取细胞总蛋白,使用BCA试剂盒测定各蛋白样本的浓度。取50 μg蛋白经10%十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE,碧云天)电泳,常规湿法转膜后,5%脱脂牛奶在4℃下阻断2 h,分别用1∶10 000的兔抗人单克隆抗体HMGA1(Abcam)和1∶1 000的兔抗人单克隆抗体β-actin(Cell Signaling Technology)在4℃摇床过夜;隔天用1∶1 000的HRP连接羊抗兔IgG室温轻摇1 h,常规显影和定影,观察结果。
1.2.3细胞增殖实验 取生长良好的MCF-7细胞接种于96孔板,6 000个/孔,各组细胞转染let-7i mimic和阴性对照24、48、72 h后,每孔加入10 μl 的CCK8,37℃孵育4 h,酶标仪检测450 nm处的吸光度(OD值)。抑制率=(1-实验组OD值/空白组OD值),计算各组的抑制率。
1.2.4克隆形成实验 取生长良好的MCF-7细胞接种于6孔板,400/孔,24 h后,分别转染let-7i mimic和阴性对照,继续培养14 d,期间每3 d更换一次新鲜培养基。14 d后,4%的多聚甲醛固定,并用1%的结晶紫染色,PBS冲洗干净后拍照。
1.2.5细胞划痕实验 取生长良好的MCF-7细胞接种于6孔板,24 h后,分别转染let-7i mimic和阴性对照,待细胞长到100%汇合度时,用无菌塑料针尖划破细胞的中轴,用PBS冲洗疏松细胞,观察伤口愈合情况。并在0、24和48 h 3个时间点,使用倒置显微镜拍摄伤口愈合情况。
1.2.6细胞侵袭实验 肿瘤细胞的侵袭能力的评估采用Transwell 小室(8 μm,Corning)。细胞经let-7i mimic和阴性对照转染24 h后,将1×104细胞与0.2 ml无血清的H-DMEM混匀后加入Transwell小室上方,并同时在Transwell小室下方加入500 μl含20%FBS H-DMEM。24孔板下室加入500 μl含20%FBS的H-DMEM中,培养24 h后,结晶紫染色,随机选取3个低倍区域(×100),计数细胞数。
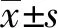
2 结果
2.1let-7i在乳腺癌组织中低表达 我们采用RT-PCR检测了乳腺癌和癌旁组织中let-7i的表达水平,结果表明,相比于癌旁组织let-7i水平(1.53±0.71),乳腺癌组织let-7i水平(0.16±0.17)明显下调(t=10.90,P<0.001)。为了进一步明确let-7i在乳腺癌细胞中的作用,我们在乳腺癌MCF-7细胞中转染了let-7i mimic和阴性对照,24 h后,采用RT-PCR的方法验证转染效率。相比于阴性对照let-7i的表达水平(1.094±0.097),转染了let-7i mimic的乳腺癌细胞中let-7i水平(19.60±8.25)明显升高(t=3.886,P=0.018)。如图1所示。

图1 let-7i在乳腺癌组织及细胞中的表达Fig.1 Expression of let-7i in breast cancer tissues and cellsNote:A.The relative expression of let-7i in breast and para-cancerous tissues;B.The relative expression of let-7i in breast cancer cells transfected with let-7i mimic and negative control.*.P<0.05,***.P<0.001.

图2 MCF-7细胞转染let-7i mimic和阴性对照后各组细胞的增殖率Fig.2 Proliferation rate of each group after MCF-7 cells transfected with let-7i mimic and negative controlNote: **.P<0.01;***.P<0.001.
2.2let-7i抑制乳腺癌细胞的增殖 转染let-7i mimic及阴性对照后24、48、72 h后,450 nm测得各组细胞的吸收度。结果显示,与阴性对照相比,过表达let-7i后细胞的增殖率降低 (图2)。
2.3let-7i抑制乳腺癌细胞的克隆形成 如图3所示,let-7i mimic组形成的集落数量低于阴性对照组(t=10.53,P<0.001)。
2.4let-7i抑制乳腺癌细胞的迁移 如图4所示,相比于阴性对照组,let-7i mimic组的细胞在24 h和48 h的划痕愈合率明显降低。
2.5let-7i抑制乳腺癌细胞的侵袭 Transwell侵袭试验表明,let-7i mimic处理后,从腔内侵入的肿瘤细胞数量少于阴性对照组的肿瘤细胞数(P<0.05) (图5)。
2.6HMGA1可能是let-7i的下游靶基因 生物信息学软件(www.targetscan.org)预测HMGA1与let-7靶结合位点。预测结果提示let-7家族与HMGA1 960-966有结合点, 而评分最高的为let-7i。提示
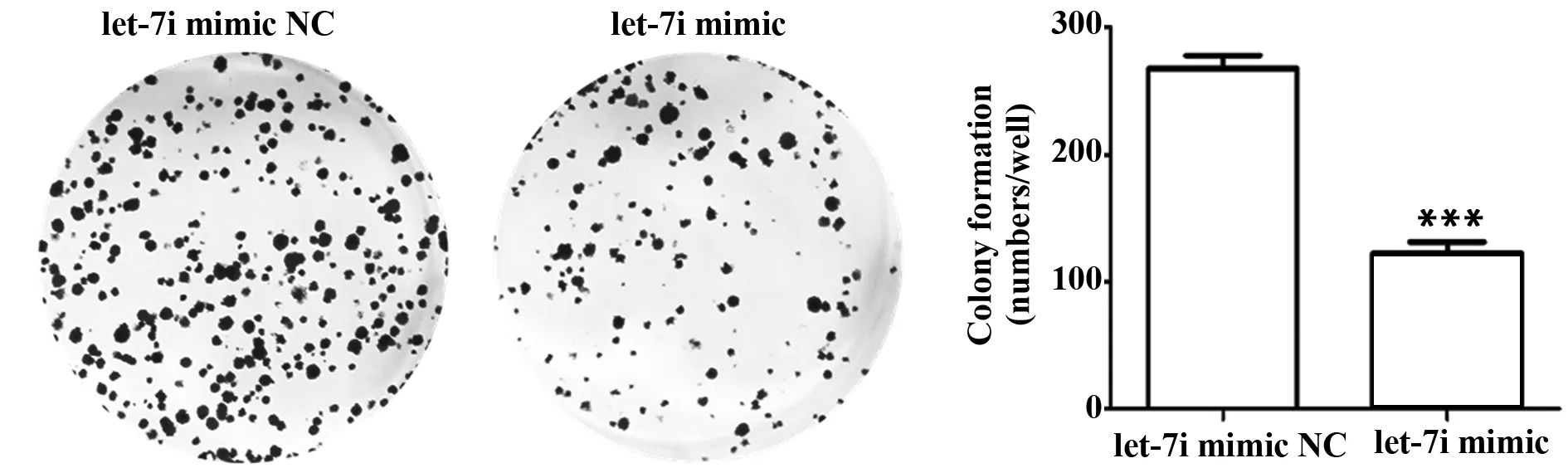
图3 MCF-7细胞转染let-7i mimic和阴性对照后各组细胞的集落形成Fig.3 Colony formation of cells in MCF-7 cells transfected with let-7i mimic and negative controlsNote: ***.P<0.001.

图4 转染let-7i mimic和阴性对照后各组细胞的划痕愈合率Fig.4 Scratch healing rate of cells after transfection of let-7i mimic and negative controlNote: *.P<0.05,**.P<0.01.
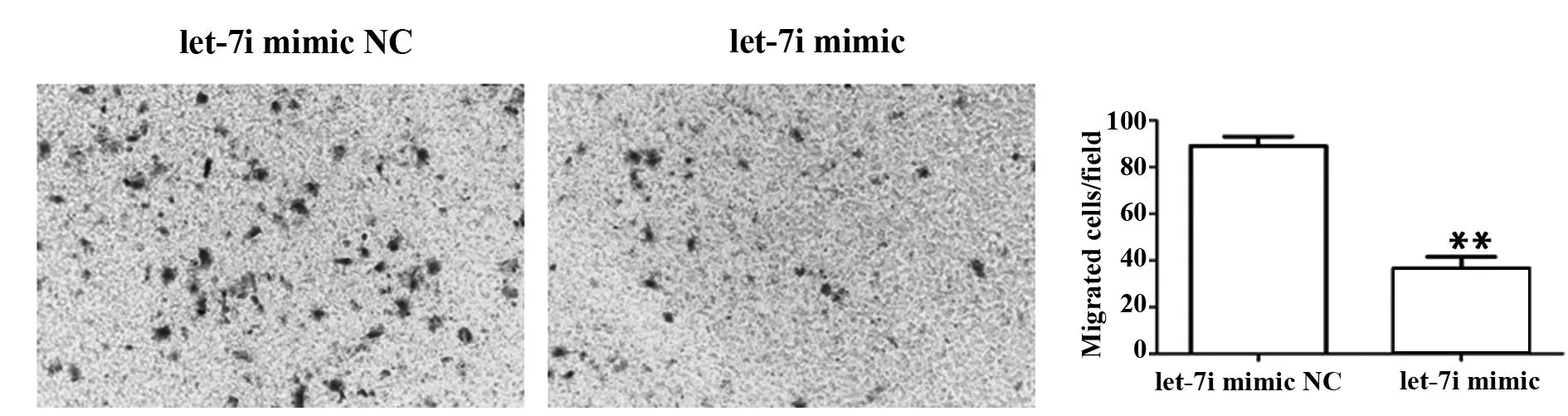
图5 MCF-7细胞转染let-7i mimic和阴性对照后各组侵袭的细胞数量Fig.5 Number of cells invaded by MCF-7 cells transfected with let-7i mimic and negative controlNote: **.P<0.01.
图6 let-7i与HMGA1结合靶点评分及其对HMGA1表达的影响Fig.6 Comments of let-7i and HMGA1 binding targets and its effect on HMGA1 expressionNote: *.P<0.05.
HMGA1可能是let-7i的下游靶基因(如图6)。基于这些结果,我们采用RT-PCR和Western blot评估let-7i对HMGA1表达的影响。结果显示,转染let-7i mimic的乳腺癌细胞HMGA1 mRNA和蛋白表达均降低(P<0.05)。
2.7HMGA1在乳腺癌组织中高表达且与let-7i的表达呈负相关 为了进一步确认乳腺癌组织中HMGA1表达与let-7i的相关性,我们采用RT-PCR检测了乳腺癌组织中HMGA1的表达。结果显示,HMGA1在乳腺癌组织中表达水平(1.63±1.41)高于癌旁组织(0.12±0.12),差异有统计学意义(t=6.237,P<0.001);Spearman相关性分析发现,乳腺癌组织中HMGA1的表达与let-7i的表达呈负相关(r=-0.461,P=0.006)。见图7。
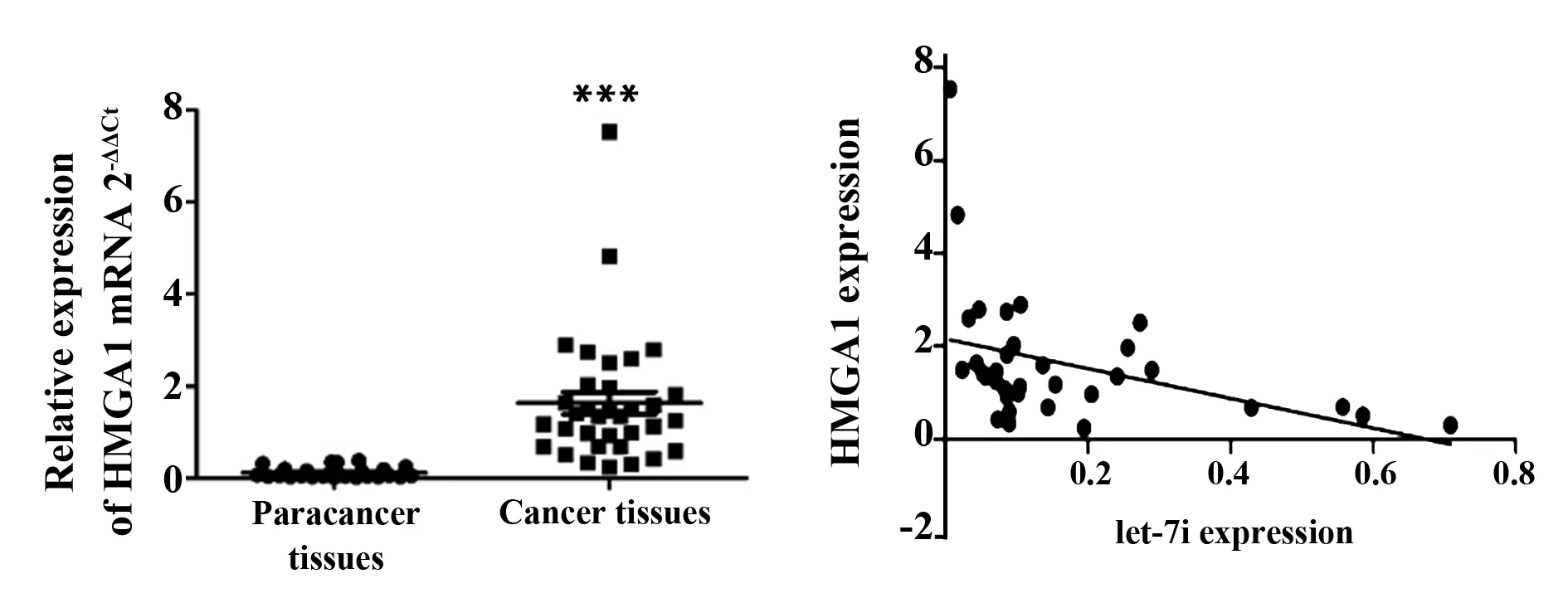
图7 HMGA1在乳腺组织中的表达及其与let-7i的相关性Fig.7 Expression of HMGA1 in breast tissue and its correlation with let-7iNote: ***.P<0.001.
3 讨论
最新的研究表明,由乳腺肿瘤导致的死亡率仅次于肺和支气管的呼吸系统肿瘤[1]。目前,手术和化疗是临床治疗乳腺癌的主要方式,然而,多数手术切除肿瘤且接受术后化疗的患者仍会发生肿瘤的复发和转移。乳腺癌的转移是一个涉及多种因素的复杂过程[8]。近年来,人们发现多种miRNAs异常表达于乳腺癌且是乳腺肿瘤发生、发展过程中的重要调控因子[9]。let-7家族是最早被发现、也是含量最丰富的miRNAs。let-7家族的多个成员异常表达于多种人类肿瘤,如肺癌、结肠癌、乳腺癌等[10-12],关于其在肿瘤中的作用和机制尚不十分明确,因此仍是目前关注的重点。研究表明,let-7i是let-7家族的成员之一,在多种人类肿瘤中表达异常[13]。然而,let-7i对乳腺癌细胞的作用和分子机制尚不明确。
本研究中,我们检测了let-7i在乳腺癌及癌旁组织中的表达水平,结果显示,相比于癌旁组织,乳腺癌组织中的let-7i水平明显降低,提示let-7i水平的降低与乳腺癌的发展具有相关性。因此,我们推断let-7i可能是乳腺癌的肿瘤抑制因子。为了进一步研究let-7i在乳腺癌细胞中的作用,我们通过转染let-7i mimic方式在乳腺癌细胞中过表达let-7i。CCK-8和平板克隆实验表明,高水平let-7i能抑制乳腺癌细胞的生长。其次,划痕和Transwell实验表明,在乳腺癌细胞内过表达let-7i后,细胞的迁移和侵袭也受到明显的抑制。最近的研究表明,let-7在肿瘤中表达下调且可以在转录水平上抑制RAS和C-MYC的基因表达而发挥抑癌miRNA的作用[14,15]。另外,研究也表明,let-7i在结肠癌[13]、胃癌[16]等人类肿瘤的进展中具有重要的调控作用。这些研究和我们的结果相一致,提示let-7i可能在乳腺癌的进展中起抑制作用。
为了进一步探讨let-7i作用于乳腺癌的分子机制,我们通过生物学信息软件预测发现高迁移率族蛋白A1(HMGA1)可能是let-7i的下游靶基因。HMGA1是一种非组蛋白的DNA结合蛋白,胚胎时期高表达而在成人组织细胞中不表达或极低表达,在多种恶性肿瘤中高表达[17],可通过影响一些基因的表达而影响乳腺癌细胞的浸润转移[18],且可以通过多种途径影响乳腺癌细胞的转移[19]。进一步,我们通过RT-PCR和Western blot检测HMGA1是否受到let-7i的调控,结果发现,在乳腺癌细胞内过表达let-7i的表达后,HMGA1的mRNA和蛋白表达显著降低;而乳腺癌组织中HMGA1表达上调,且与let-7i的表达呈负相关。这些结果也确定了生物信息学的预测。
综上所述,let-7i在乳腺癌中表达下调,可能通过靶向HMGA1在乳腺癌中发挥抑癌作用,有望为乳腺癌分子治疗提供了新的靶点。

