基于碳纳米管组装无电子媒介体电流型乙脑疫苗免疫传感器研究
董军
(川北医学院化学教研室,四川 南充 637000)
乙脑疫苗的含量测定直接影响着其对流行性乙型脑炎的预防效果。目前,乙脑疫苗含量检测方法主要有动物法、蚀斑试验法和酶联免疫吸附法,这些经典方法使用广泛但也存在一些不足,例如操作繁琐、检测周期较长、灵敏度较低,对实验人员要求较高等[1-3]。因此,发展简捷、灵敏度高的检测方法不论对医学理论研究还是临床检测都具有重要意义。免疫传感器是利用抗原-抗体间特殊的结合反应来测定痕量物质的一种高灵敏度方法,近些年来关于乙肝病毒、肿瘤标记物、甲胎蛋白等免疫传感器的研究取得了快速发展[4-6]。但关于乙脑免疫传感器的研究相对缺乏,仍有大量基础工作需要完善。其中如何提高抗体活性负载量及信号灵敏度是亟待解决的关键问题之一[7-8]。
碳纳米管独特的结构和电学性质使其在传感器领域具有巨大的应用潜力。研究表明碳纳米管可发挥分子导线作用,利于生物分子与电极间的电子传递,在生物传感方面表现出优异的性质[9-10]。Wang等[11]认为碳纳米管可以和生物兼容性更好的材料结合,这样不但可以提高生物活性物质负载量,而且可以更好保持生物分子活性,提高传感器的响应信号。据此,本研究以多壁碳纳米管为载体提高生物兼容性较好的金微粒负载量,从而提高乙脑疫苗抗体固定量,并保持抗体良好的生物活性;利用辣根过氧化氢酶对H2O2的反应增强电流信号,提高响应灵敏度。
1 材料与方法
1.1 材料
循环伏安法、恒电位法和计时电流法在LK98BⅡ综合电化学分析系统(天津市兰力科化学电子高技术有限公司)测量;PHS-2F型酸度计 (上海仪电科学仪器股份有限公司),BS110S电子天平 (北京赛多利斯天平有限公司);KQ—400DB型超声波清洗器(昆山市超声仪器有限公司),工作频率为 60 kHz。实验采用三电极体系,修饰过的玻碳电极 (GC) 为工作电极,饱和甘汞电极 (SCE) 为参比电极,铂片电极为对电极。
多壁纳米碳管(MWCNT,深圳市纳米港有限公司),乙脑疫苗、乙脑疫苗疫苗抗体、腮腺炎疫苗、水痘疫苗和风疹疫苗(上海科华生物工程公司提供);氯金酸(四川化学试剂厂),辣根过氧化物酶(HRP)及牛血清白蛋白(BSA)(Sigma,美国),所用化学试剂均为分析纯,实验用水为二次蒸馏水。
1.2 方法
1.2.1 传感器制备方法 Au/MWCNT/GC电极制备方法:MWCNT(10~30 nm)的氧化处理参考文献[12]。取碳纳米管1.0 g,在浓HCl中回流3 h纯化,洗涤至中性,再将碳纳米管置于浓HNO3中回流4 h,洗涤至中性后在120 ℃下烘干,制得羧基化碳纳米管。称取羧基化的MWCNT 10 mg用10 mL 十六烷基胺超声震荡分散2 h,配成带有氨基,浓度为1 mg/mL的羧基化碳纳米管分散系。玻碳电极(Ø:2 mm)用1800#、2000#均相砂纸抛光,重蒸水冲洗3次,再依次在丙酮、10%的氢氧化钠、HNO3(v)∶H2O(v)=1∶1的溶液中超声振荡三分钟,取出重蒸水冲洗,置于室温下干燥;滴加1 mg/mL的黑色溶液3 μL,红外灯烤干,以该电极为工作电极,在三电极体系中,-2.5 V恒电压下电沉积 120 s。电沉积完成后,取出电极,重蒸水冲洗2次,室温下过夜干燥得到Au/MWCNT/GC电极。
免疫传感器的制备方法:将Au/MWCNT/GC电极置于乙脑疫苗抗体溶液中在4 ℃浸泡4 h,再将电极置于0.25% BSA溶液中于常温孵育2 h以封闭活性基团,最后用1 mg/mL HRP取代BSA封闭非特异性活性位点,在37 ℃恒温封闭30 min,制得HRP/乙脑疫苗抗体/Au/MWCNT/GC免疫传感器。图1所示为免疫传感器制备流程图。
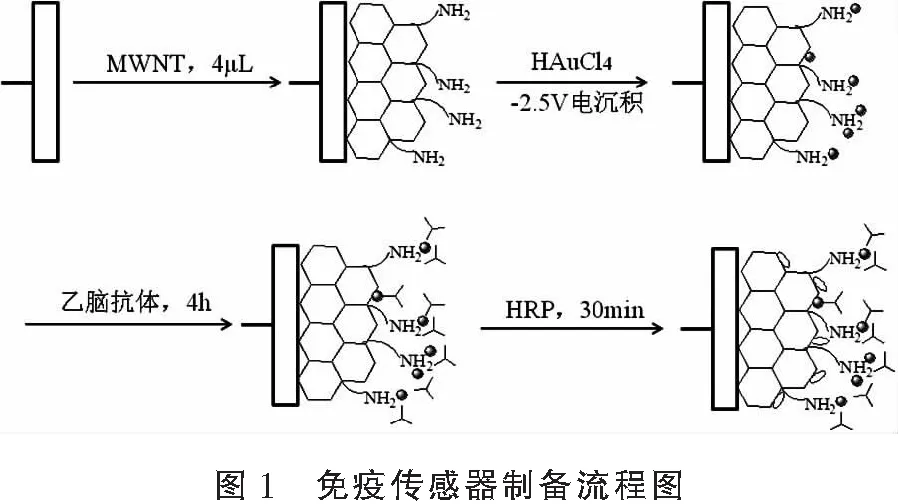
1.2.2 测试方法 组装不同阶段电极的电化学表征:电极在组装过程中的不同阶段用循环伏安法进行表征。三电极体系,于含0.1 mol/L KCl 与0.2 mol/L PBS (pH7.4)溶液中在0~1 V电位范围内进行循环伏安扫描,扫描前PBS溶液通氮气5 min。
免疫传感器在抗原溶液中培育时间的选择:采用三电极体系,以HRP/乙脑疫苗抗体/Au/ MWCNT/GC免疫传感器为工作电极。在含6.4×10-7lg pfu/mL的乙脑疫苗磷酸盐生理缓冲溶液(pH 7.4)中,采用计时电流法记录不同时间电流稳定后的电流值(I),并用I相对于电沉积时间(t)做图,通过该图讨论免疫传感器在抗原溶液中培育时间的选择。
免疫传感器对乙脑疫苗响应:三电极体系,免疫电极为工作电极,先测量在0.5×10-3mol/L H2O2+0.1 mol/L KCl+2 mmol/L PBS (pH7.4)电解质溶液中的电位I0(空白电位),然后向电解质溶液中加入不同浓度的乙脑疫苗溶液,搅拌4 min,记录相应电位值I,传感器对系列浓度乙脑疫苗溶液的电流响应按公式:△I=I0-I进行计算。由于抗原与固定在电极上的抗体结合后,生成的抗原-抗体复合物堵塞导电通道,使得电子有效扩散面积减小,电流减小,因此响应电流值I与乙脑疫苗浓度成反比,最后用△I对lgC(乙脑疫苗)制作标准曲线。
2 结果与讨论
2.1 实验条件选择
2.1.1 电沉积时间对电流影响 图2是Au/MWCNT/GC电极的响应电流与时间关系图,其中峰电流(Ip)根据该电极在2.5 mmol/L Fe(CN)64-/3-+0.1 mol/L KCl+PBS(pH7.4)溶液中循环伏安曲线中位于-0.26 V和0.10 V处观察到的氧化还原峰,利用公式Randles-Sevcik 方程:Ip=2.69×105AD1/2n3/2γ1/2C(D,n,γ和C均为常数,电极的电活性表面积(A)与氧化还原峰的峰电流之间成正比)计算得到[13]。从图中可看出,电沉积时间与峰电流并不会随着Au含量的增加而增加,而是沉积时间为120 s时,Au/MWCNT/GC电极的响应峰电流值出现最大值,Ip(120)是沉积时间分别为 90 s 和 150 s 的峰电流的 1.2 倍和1.1倍。这主要是因为金微粒的堆积及分布方式不同造成,沉积时间较短时,金粒子多数为纳米或微米级,并能够充分与纳米碳管接触,但时间过短时金微粒沉积较少,随着时间的延长,碳纳米管表面能够充分负载金粒子,且金粒子相对均匀,粒径可保持在微米级以下,有效利用碳纳米管的空间结构和高比表面积,导电有效面积更大;而更长时间的电沉积虽然金含量增加,但完全覆盖碳纳米管,会形成较为光滑金面,金颗粒粒径不断增大,反而会使有效导电面积减小,因此峰电流也会降低。
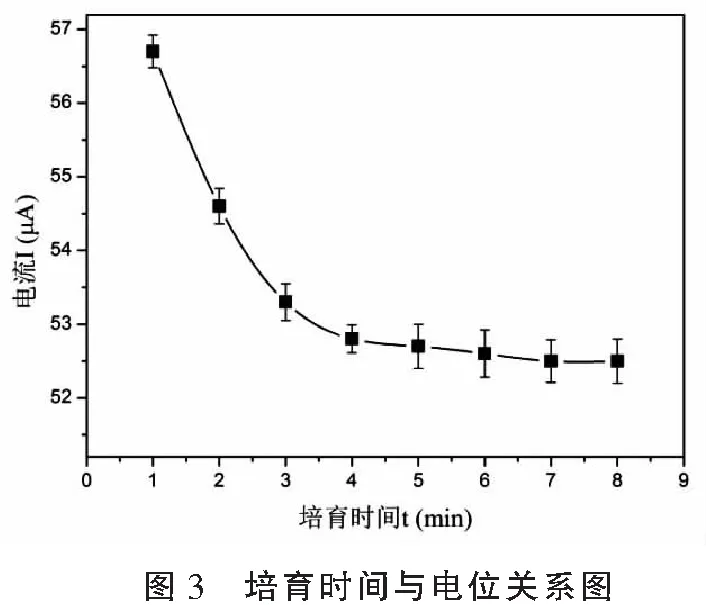
2.1.2 免疫传感器在抗原溶液中培育时间的选择 图3为HRP/乙脑疫苗抗体/Au/ MWCNT/GC免疫传感器与乙脑疫苗的动力学响应曲线。从图中可看出,在测试时间范围,传感器表面负载抗体与缓冲溶液中抗原的反应可分为两个阶段,即抗原-抗体快速结合阶段和抗原-抗体反应达到平衡阶段。在快速响应阶段,免疫电极表面上的抗体与溶液中的抗原迅速结合,形成非良性导电体的抗原-抗体复合物,由于免疫复合物导电性很弱,增大了电子扩散阻力,减弱电子向电极表面的扩散,从而会减少复合电极的有效导电面积,从而响应电流值明显减小;随着时间的延长,至4 min左右,响应电流基本达到稳定,表明抗原-抗体结合达到平衡,因此本实验选用的最佳培育时间是4 min。
2.1.3 免疫传感器在抗原溶液中培育温度及pH的选择 图4分析了温度(a)和pH(b)对免疫反应影响。从图4a可以看出温度在15 ℃至37 ℃范围,响应电流会随着温度的升高逐渐减小,37 ℃时达到最小,约57 μA,这说明抗原—抗体结合密度达到最大,但温度超过37 ℃时,电流强度反而会随着温度的升高而升高,这归因于抗原、抗体的活性在较高温度下易被破坏,不利于两者的结合。实验中由于温度升高,部分免疫复合体被破坏,电极表面部分被免疫复合体堵塞的导电通道会恢复,所以响应电流增大。故本实验选用37 ℃为操作温度。
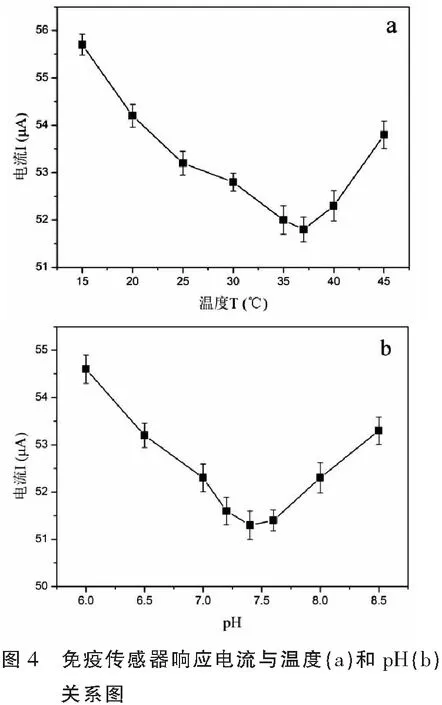
pH对免疫传感器电流响应的影响(如图4b所示)与温度对免疫反应影响相类似。pH值过高或过低都不利于抗原-抗体复合体的形成,实验结果表明该感器的最适反应pH为7.4。
2.2 电极在组装过程的电化学表征
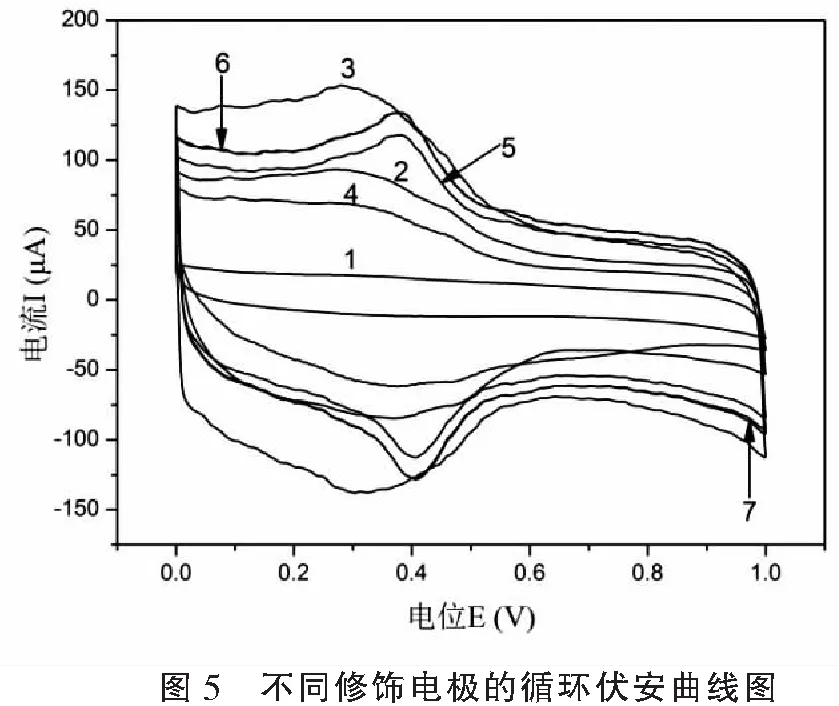
图5中曲线1-4是不同的修饰电极在0.1 mol·L-1KCl+2 mmol·L-1PBS (pH7.4)溶液中的循环伏安曲线图。与玻碳电极相比(线1),表面修饰一层MWCNT的玻碳电极(线2)充扩散电流明显增大,在0.3 V处明显有一对氧化还原峰,这是因为经氧化处理的MWNCT表面含有以羧基、羰基和羟基为主的活性基团。而0.3 V处氧化还原峰是由于羧基在电极上被还原为羟基,又再次氧化成羧基的结果[14]。当金微粒沉积在MWCNT上(线3),电极的充扩散电流及氧化还原峰都显著增强,这是因为具有优良导电性Au微粒组装在MWCNT/GC电极上后,促进了电子转移。但是当HRP及乙脑疫苗抗体固定在Au/MWCNT修饰的电极表面后(线4),电极的冲扩散电流明显减小,这是由于非良导体的抗原及HRP占据并阻断了部分导电通道,使得电子向电极表面扩散的阻力增大,有效导电面积减小,电流减小。图5中线5~线7分别为HRP/乙脑疫苗抗体/Au/MWCNT/GC免疫传感器在含0.1 mmol/L、0.3 mmol/L及0.5 mmol/L H2O2的磷酸缓冲溶液中的循环伏安曲线。从图中可以明显观察到,随着PBS中H2O2浓度的增加,峰电位移动到约0.4 V,循坏伏安曲线的充扩散电流及氧化还原峰电流值都有一定增强。这是由于MWCNT能促进HRP的直接电子转移[15],故充扩散电流、峰电流及峰电位会有不同程度的增大,这证明HRP/乙脑疫苗抗体/Au/MWCNT/GC免疫传感器对H2O2有良好的电催化还原作用,当H2O2浓度达到0.3 mmol/L时,电流不再明显增加,因此PBS溶液中含H2O2浓度0.3 mmol/L为最佳浓度。
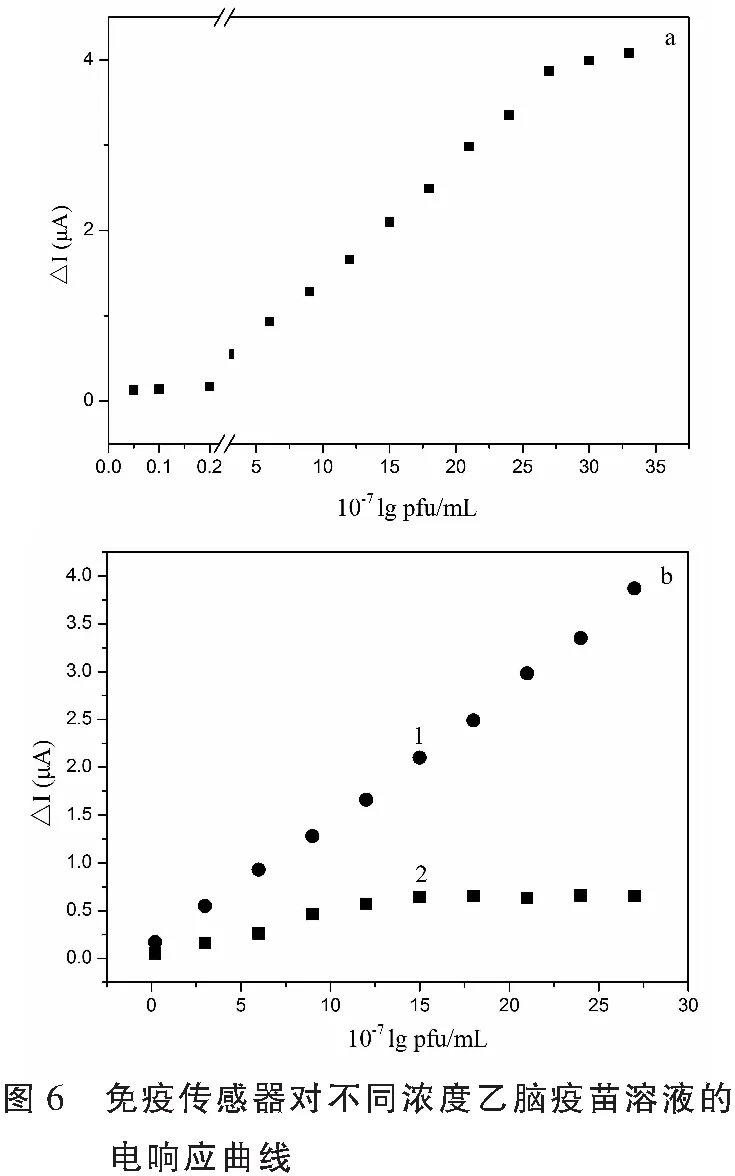
2.3 免疫传感器的响应性能和检出限
由于HRP/乙脑疫苗抗体/Au/MWCNT/GC免疫传感器中的MWCNT能促进HRP的直接电子转移,因此,该无电子媒介体的电流型免疫传感器可用于乙脑疫苗的检测。为测量传感器的响应性能和检出限,在25 ℃下,用免疫传感器对0.1 mol·L-1KCl+2 mmol·L-1PBS (pH7.4)溶液重复测定7次,设峰电流值的标准偏差为3 μA,将其作为免疫传感器的噪音值(I0)。记录免疫传感器在不同浓度乙脑疫苗标准溶液中的电流强度,计算这些电流与空白磷酸盐缓冲液的电流之差。结果如图6a所示,在所测范围内响应电流与乙脑疫苗浓度对数呈现“S”线性关系,但该传感器在5.6×10-8~2.2×10-6lg pfu/mL的范围内保持良好的线性关系(图6b线1所示),回归方程为:△I=0.1407+0.1358 lgC[乙脑疫苗],r=0.9929,灵敏度72.4 μA/lg pfu/mL/cm2。与HRP/乙脑疫苗抗体/Au/MWCNT /GC电极相比,HRP/乙脑疫苗抗体/MWCNT/GC电极的线性范围窄 (图6b线2),灵敏度低(6.3×10-8-7.2×10-7lg pfu/mL,灵敏度48.5 μA/lg pfu/mL/cm2)。这是因为多壁碳纳米管的高比表面积提高了金微粒的负载量,且金微粒很可能是纳米或微米级别的,这些微粒具有大的比表面积,从而有效提高了抗体的固定量,金微粒还能有效保持抗体的活性,从而有效促进了电子传输,提高了电极的灵敏度。
2.4 免疫传感器的特异性
实验考察了腮腺炎疫苗、水痘疫苗和风疹疫苗对乙脑免疫传感器的响应程度。测量同一批次制备的3支免疫传感器分别置于含5.0×10-7lg pfu/mL乙脑疫苗的磷酸缓冲溶液中的响应电流,然后向每支免疫传感器的缓冲溶液中加入一种干扰疫苗,再分别测定其响应电流。实验结果表明(表1),含干扰物溶液中的电流响应值与只含乙脑疫苗的磷酸缓冲溶液中的响应电流无显著性差异,表明该免疫传感器具有良好的选择性。

表1 免疫传感器的特异性
2.5 免疫传感器的重现性和稳定性
重现性是免疫传感器的重要性质之一。将一支乙脑免疫传感器与5.0×10-7lg pfu/mL的乙脑疫苗样品标准溶液进行7次反应,检测其电流响应,其标准偏差为16% (n=7)。另外,取七支免疫传感器,对浓度为5.0×10-7lg pfu/mL的标准溶液样品进行检测,结果RSD=7.1% (n=7),结果表明该免疫传感器具有良好的重现性。
稳定性是决定免疫传感器性能好坏的关键因素之一,在本实验中,将制备的HRP/乙脑疫苗抗体/MWCNT/GC电极在4 ℃下干态放置60 d,放置期间每隔10 d对同一浓度的乙脑抗原进行检测,前30天其响应电流仍能保持初始电流的93.2%,60 d后电流值只有初始电流值的87.4%。通过免疫传感器在磷酸缓冲溶液中进行的100片段的循环伏安扫描,与初始电流相比,其响应电流丢失3.14%。免疫传感器具有较好的稳定性,主要是因为碳纳米管对金粒子起到能够较好的分散作用,而乙脑抗体能够有效的固定在金微粒表面,并保持良好的生物活性。
2.6 回收实验
将制备的乙脑免疫传感器用于4批生物制品乙脑疫苗的效价的检测,回收率为98.17%~106.44%(表2),表明该传感器实验结果与传统蚀斑法结果基本一致。
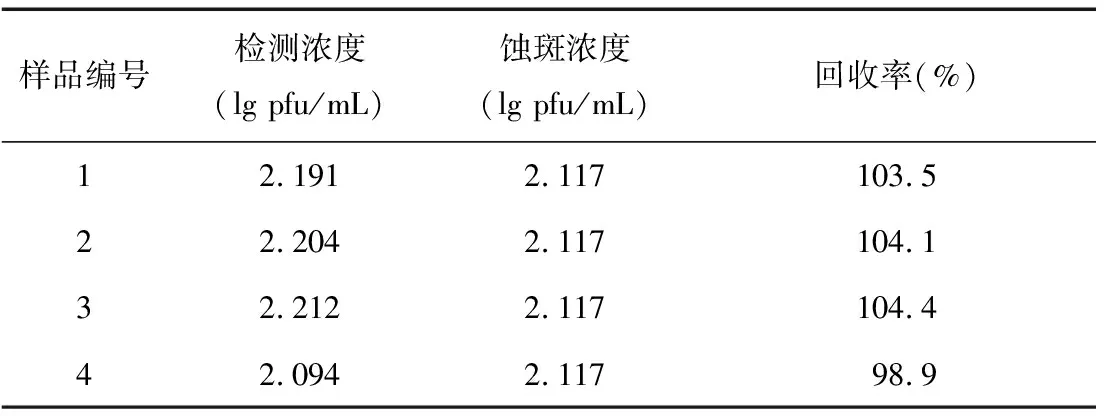
表2 乙脑免疫传感器回收率
综合上述实验,可以得出结论多壁碳纳米管与金粒子的结合使用可增加乙脑抗体的固定量;且两者的协同作用有利于电子向传感器表面的扩散,整个电催化过程无需电子媒介体,因此传感器制备过程相对简便,利用碳纳米管对辣根过氧化氢酶电子转移的促进作用,提高传感器的响应灵敏度。但有效测量范围还是相对较小,在这方面仍然需要继续探索。简而言之,HRP/乙脑疫苗抗体/MWCNT/GC传感器对乙脑疫苗检测具有可行性,但在有效测量范围和灵敏度等方面还需做大量基础工作。

