使用管家基因进行生物气溶胶组分分析的初步研究
李金珂,王玉娜,李丽丽,马雪征,张丽萍,赵 欣,程 铭,周春雅,王 涛,胡孔新*
(1.天津大学生命科学学院,中国天津300072;2.中国检验检疫科学研究院卫生检疫研究所,中国北京100176;3.哈尔滨医科大学公共卫生学院,中国黑龙江哈尔滨150001;4.湖北国际旅行卫生保健中心,中国湖北武汉430000;5.杭州萧山机场海关,中国浙江杭州310000)
生物气溶胶(bioaerosol)指的是含有生物活性成分的气溶胶粒子,往往包含细菌、真菌、病毒等微生物粒子和孢子、植物花粉、动物碎片等生物体所释放的微粒成分[1~2],生物粒子大小在 0.01~100 μm之间。虽然生物粒子在空气颗粒物中所占比例不大,但其长时间悬浮在空气中,对人体健康的潜在危害不容小视[3]。近些年生物气溶胶的潜在危害性被越来越多的人重视,2017年6月,以“生物气溶胶与人类健康、国家生物安全及大气污染”为主题的学术讨论会在北京成功召开[4]。
分子生物学方法是空气生物学研究的重要手段。管家基因是指为细胞的生存提供基本功能,因而在所有细胞中都表达的基因,常常作为内参基因应用于分子生物学研究中[5]。本研究根据细菌、动物和植物3种生物气溶胶组成成分的管家基因,分别设计特异引物探针,利用荧光定量PCR方法实现对不同生物气溶胶组分的相对定量分析。
1 材料与方法
1.1 材料
1.1.1 仪器
病毒气溶胶采集富集仪BIO Capturer-6由中国检验检疫科学研究院卫生检疫研究所自主研发,杭州富集生物科技公司生产。文中所用PCR仪为美国ABI公司生产的7500 Fast实时荧光定量PCR仪。
1.1.2 试剂
磷酸盐缓冲液(PBS,0.01 mol/L,pH 7.2~7.4)购自Biosharp公司;磁珠富集液为课题组自制;动物组织、细菌样本的核酸提取试剂盒为德国QIAGEN公司的Blood&Tissue Kit;植物组织样本的提取试剂盒为北京天根生化科技有限公司的植物基因组DNA提取试剂盒;环境样本的核酸提取试剂盒为德国QIAGEN公司的DNeasy PowerWater Kit;实时荧光定量PCR扩增试剂盒One-Step RT-PCR Kit购自赛默飞世尔科技有限公司。本研究所用引物探针均由上海英潍捷基贸易有限公司合成。
1.2 管家基因引物探针序列的特异性验证
1.2.1 样本来源
该部分分别利用动植物组织和细菌样本对各自管家基因的引物探针进行验证。动物组织选用的猪肉、牛肉、鱼肉和鸡肉样本,以及植物样本油菜、莴苣均购自北京大兴区旧宫镇万科广场永辉生活超市。冬青样本采集于北京市大兴区旧宫镇旧忠路街道,杜仲、紫叶桃、银杏、滴水观音、绿萝样本采集于中国检验检疫科学研究院院内。所用细菌样本为金黄色葡萄球菌、大肠杆菌、沙门氏菌、粪链球菌,均属于实验室保存菌种。
1.2.2 扩增方法
细菌扩增管家基因选择16S rRNA[6],具体引物探针见表1。动物扩增管家基因选择动物线粒体16S rRNA[7]。植物扩增管家基因选择植物内源性基因tRNA-leu[8],并根据20余种常见植物tRNA-leu序列(序列信息见表2),使用MEGA 7进行多序列比对后自行设计得出最优探针序列(表1)。
扩增反应体系为25 μL,扩增程序如下:95℃,9 min;95℃,15 s,60℃,60 s(40个循环)。扩增实验对照组使用其余两类生物核酸(比如:若验证细菌引物则对照组为动物、植物核酸样本),阴性对照使用荧光定量PCR扩增试剂盒内提供的无菌无核酸酶水。
1.3 室外环境生物气溶胶样本分析
1.3.1 环境气溶胶样本的采集
本研究使用BIO Capturer-6病毒气溶胶采集富集仪共采集环境气溶胶样本28份。采集地为中国检验检疫科学研究院院内(北纬 39°47′0′′,东经 116°30′37′′),采样点选取中国检验检疫科学研究院主楼12层顶开放性天台(距地平面高度60 m)和后院内地平面,时间为2018年6月27日至7月3日共7 d,每天分上午和下午两个时段进行采样。采样时记录温湿度等天气状况,7 d内采样温度跨度为24~39℃,相对湿度跨度为15%~82%。
采集气溶胶样本时,采样瓶中加入采样液PBS 50 mL,并加入150 μL磁珠。每个空气样本设定采样量为1 000 L。采样完成后将采样瓶放到磁力架上,静置吸附10 min,使磁珠充分被吸附于磁铁处,倒掉上清,移走磁力架,加入500 μL PBS,使磁珠重悬,吸出至1.5 mL EP管中,放于-80℃冰箱冻存备用。采样瓶不重复使用,采样喷头旋下后用75%乙醇浸泡至少1 h,使用双蒸水冲洗干净,放入80℃烘箱中过夜干燥备用。
阴性对照样本的采集:在实验室选择一台Ⅱ级生物安全柜,打开运转20 min后,将BIO Capturer-6采样器放到安全柜操作台面上,采集1 000 L无菌空气样本作为阴性对照。

表1 荧光定量PCR引物探针序列Table 1 Primers used for real-time quantitative PCR analysis

表2 25种植物的tRNA-leu序列信息Table 2 tRNA-leu sequence information of 25 plants
1.3.2 环境气溶胶样本管家基因的检测
使用DNeasy PowerWater Kit水样DNA提取试剂盒提取样本核酸,荧光定量PCR扩增方法同步骤1.2.2。
1.4 数据统计分析
采用SPSS 23.0软件对数据进行统计检验,两组间正态分布计量资料的均数比较采用t检验,多组间比较采用方差分析,计量资料组间两两比较采用q检验,相关性分析采用Spearman等级相关分析,以P<0.05作为具有统计学差异的检验标准。
2 结果
2.1 管家基因引物探针序列的特异性验证
2.1.1 细菌16S rRNA基因引物探针的通用性及特异性检测
将金黄色葡萄球菌、大肠杆菌、沙门氏菌、粪链球菌的DNA样本作为实验组,并取部分动物(猪肉、鸡肉)和植物(杜仲、银杏)的 DNA样本作为对照组,进行荧光定量PCR检测,结果如下:金黄色葡萄球菌、大肠杆菌、沙门氏菌、粪链球菌样本的 Ct值分别为 15.81、12.62、12.07、9.05;选用的杜仲、银杏、猪肉、鸡肉以及体系水对照样本均无扩增曲线。虽然多次重复结果的阳性Ct值有细微改变,但各物种扩增结果相同。以上结果证明16S rRNA引物探针有良好的细菌源性检测通用性及物种特异性。
2.1.2 动物线粒体16S rRNA基因引物探针的通用性及特异性验证
将提取的牛肉、猪肉、鱼肉、鸡肉DNA作为实验组,同时以部分植物(杜仲、银杏)和细菌(大肠杆菌、金黄色葡萄球菌)的DNA样本作为对照组,进行荧光定量PCR检测,结果显示:牛肉、猪肉、鱼肉、鸡肉样本的 Ct值分别为 11.30、14.80、26.66、26.02;选用的杜仲、银杏、大肠杆菌、金黄色葡萄球菌以及体系水对照样本均无扩增曲线。虽然多次重复结果的阳性Ct值有细微改变,但各物种扩增结果相同。以上结果证明动物线粒体16S rRNA引物探针有良好的动物源性检测通用性及物种特异性。
2.1.3 植物tRNA-leu基因引物探针的通用性及特异性检测
将杜仲、紫叶桃、冬青、银杏、滴水观音、油菜、莴苣、绿萝的DNA样本作为实验组,并取部分动物(鸡肉、猪肉)和细菌(大肠杆菌、金黄色葡萄球菌)的DNA样本作为对照组,进行荧光定量PCR检测,结果如下:杜仲、紫叶桃、冬青、银杏、滴水观音、油菜、莴苣、绿萝样本的Ct值分别为19.00、13.85、24.55、22.13、15.45、12.88、11.64、12.93;选用的大肠杆菌、金黄色葡萄球菌、鸡肉、猪肉以及体系水对照样本均无扩增曲线。虽然多次重复结果的阳性Ct值有细微改变,但各物种扩增结果相同。以上信息证明tRNA-leu引物探针有良好的植物源性检测通用性及物种特异性。
2.2 环境气溶胶样本的组分分析
使用3种管家基因引物探针对28份环境样本进行荧光定量PCR检测,取PCR酶体系水为空白对照,安全柜内采集的气溶胶样本为阴性对照,1.2章节选取的细菌、动物和植物中提取的核酸分别为相对应的阳性对照。荧光扩增曲线如图1所示,具体Ct值见表3。结果表明,28份环境样本均有细菌、动物和植物成分检出,且有完整扩增曲线;阴性对照、空白对照的检测结果均为undetected。

图1 环境气溶胶样本的管家基因检测结果(A)细菌成分检测结果;(B)动物成分检测结果;(C)植物成分检测结果。各图中阴性对照及空白对照均无扩增曲线,阳性对照扩增曲线完好。Fig.1 Housekeeping gene detection of environmental aerosol sample(A)Bacterial component testing;(B)Animal component testing;(C)Plant component testing.Negative control and blank control in each figure have no amplification curve,and the positive control amplification curve is intact.
2.2.1 空气样本中细菌、动物和植物三者成分间的比较
对收集到的样本中细菌、动物和植物成分的相对含量进行分析(图2)。结果表明,空气中细菌、动物和植物来源的成分含量差异显著(P=0.000<0.05)。进一步两两比较可知,采集到的气溶胶中细菌、动物、植物三者成分的相对含量存在差异,细菌最多,植物次之,动物成分最少。
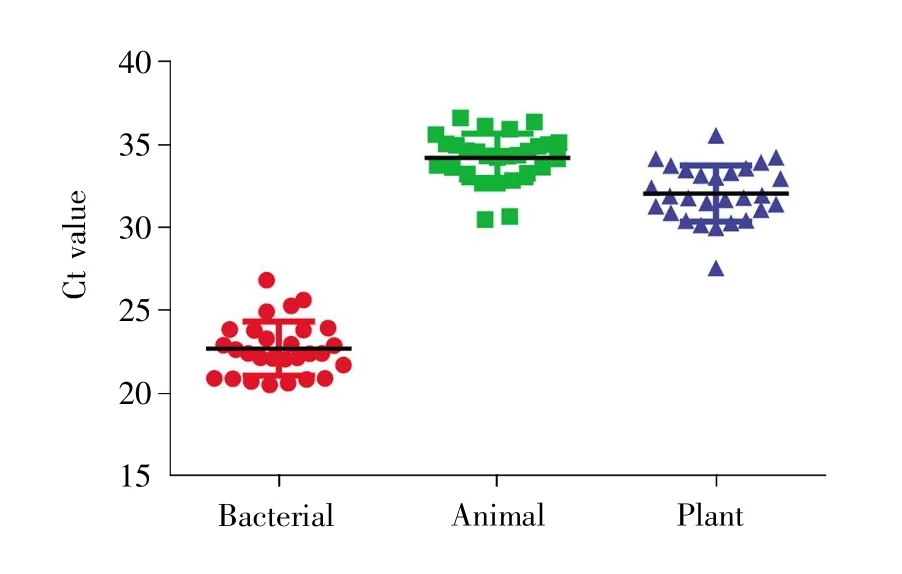
图2 空气气溶胶中细菌、动物和植物成分的Ct值散点图Fig.2 Scatter plot of Ct values of bacterial,animal and plant constituents in aerosols
2.2.2 高度对空气样本中细菌、动物和植物成分的影响
按照采样时的高度将采集样本分为12层天台(高度60 m)和后院地面(高度0 m)两组。结果表明不同高度的空气中细菌、动物、植物的成分含量均无显著性差异(细菌P=0.365>0.05,动物P=0.904>0.05,植物 P=0.847>0.05,图 3)。
2.2.3 温度对空气样本中细菌、动物和植物成分的影响
在样品采集的一周内,温度变化范围为24~39℃,不同温度条件下的空气样本中细菌、动物、植物成分的Ct值如图4所示。结果表明:不同温度下,空气中动物、植物的成分含量无显著性差异(动物 P=0.45>0.05,植物 P=0.963>0.05);温度与细菌Ct值呈负相关(r=-0.434,P=0.021<0.05),即温度越高,细菌Ct值越低,采集到的细菌粒子越多。
2.2.4 湿度对空气样本中细菌、动物和植物成分的影响
在样品采集的一周内,相对湿度变化范围为15%~82%,不同湿度条件下的空气样本中细菌、动物、植物成分的Ct值如图5所示。结果表明:不同湿度下,空气中动物和植物成分的含量无显著性差异(动物 P=0.463>0.05,植物 P=0.956>0.05);湿度与细菌Ct值呈正相关(r=0.660,P=0.000<0.05),即湿度越低,细菌Ct值越低,采集到的细菌粒子越多。
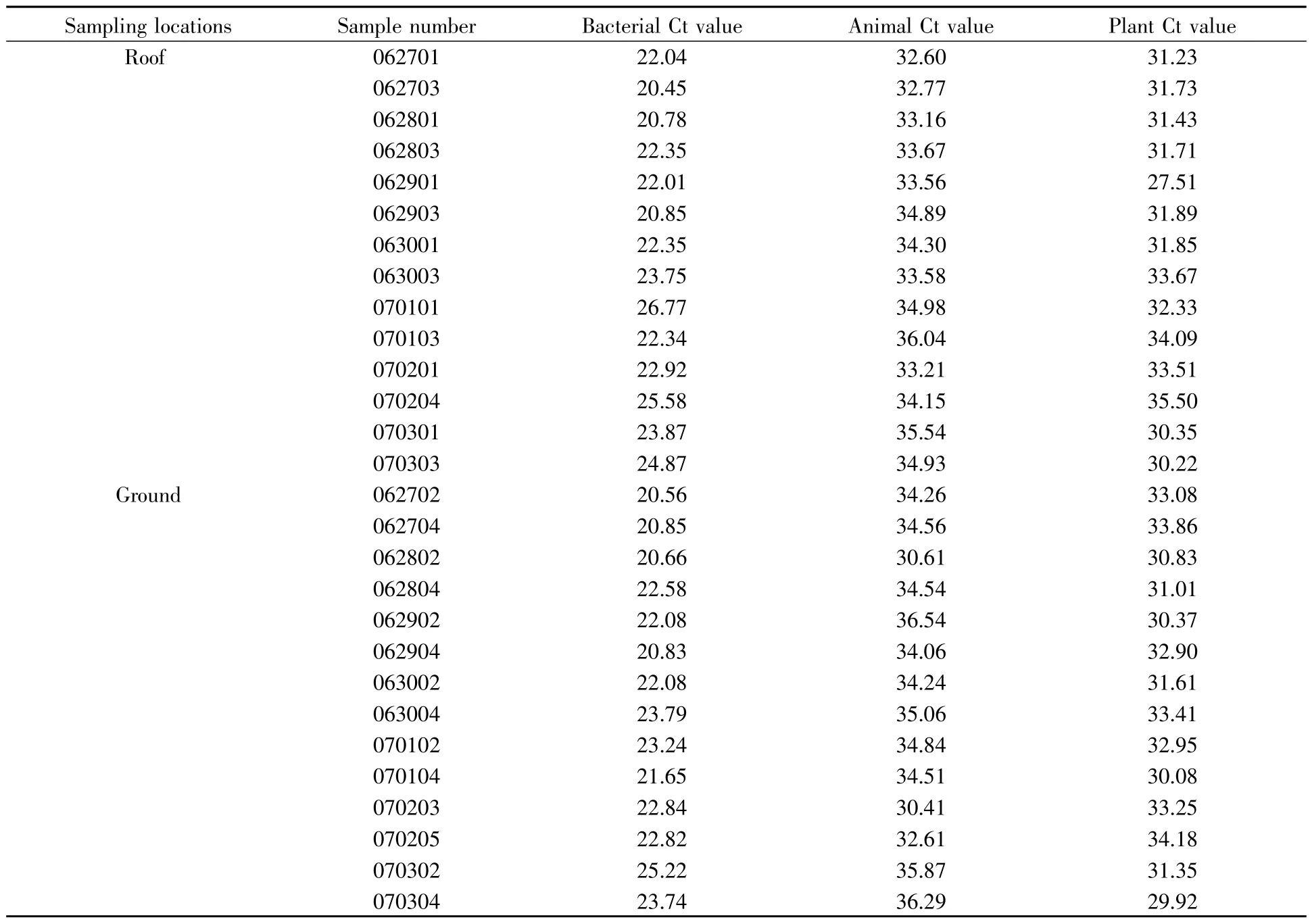
表3 环境气溶胶样本管家基因检测结果Table 3 Housekeeping gene detection results of environmental aerosol samples

图3 不同采样高度下各成分的Ct值Fig.3 Ct value of each component at different sampling heights
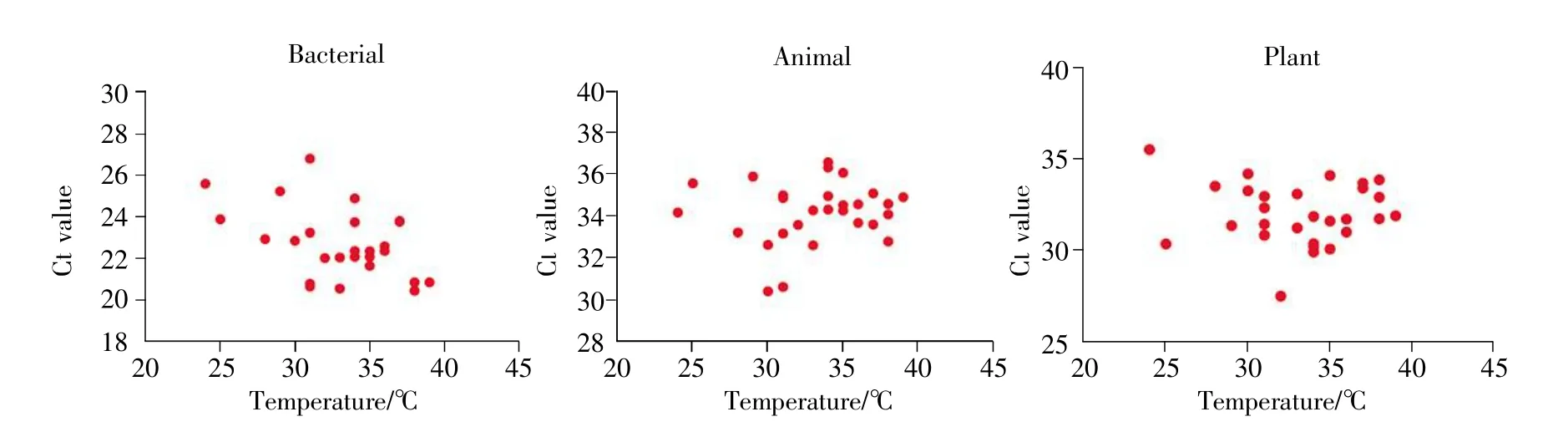
图4 不同采样温度下各成分的Ct值Fig.4 Ct value of each component at different sampling temperatures
3 讨论
生物气溶胶的潜在危害性被越来越多的人重视,对生物气溶胶的研究需要气象学、分子生物学、细胞生物学、生物信息学等多个领域的技术[9~10]。众所周知空气微生物中的细菌如沙门氏菌、大肠杆菌、肺炎链球菌等感染会危害人类健康甚至生命[11],但空气中存在的动植物源性成分对人类健康构成的潜在危害往往被人忽略:植物花粉会引发敏感人群的过敏反应[12];寄生虫及虫卵可引发人群传染病[13];蚊虫等生物是许多传染病的传播媒介[14]。目前对空气中生物气溶胶的研究主要针对细菌、真菌或病毒[15~18],缺少有效的手段对空气中的各生物组分进行成分监测。管家基因是一类在所有细胞中稳定表达的基因,凭借其这一特性,管家基因成为研究基因表达的重要内参。管家基因常常作为分子标记被用于物种鉴别和生物掺杂鉴定:杨永存等[19]使用同源异形盒基因鉴别食用油中是否混有动物源性地沟油成分;18S rRNA基因被用于检测明胶中的牛羊等动物源性成分[20];岳巧云等[21]使用leu基因作为检测奶粉中是否掺入大豆成分的分子标记。
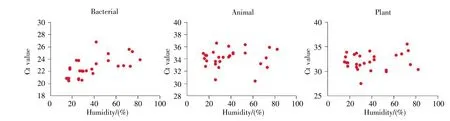
图5 不同采样湿度下各成分的Ct值Fig.5 Ct value of each component under different sampling humidities
本研究从生物管家基因角度出发,借助自主研发的BIO Capturer-6病毒气溶胶采集富集仪,建立了一种检测生物气溶胶样本中动物、植物、细菌总成分相对含量的方法。通过对影响空气中细菌、动物、植物成分采集的相关因素进行分析,一方面得出温度和湿度对细菌的采集均有影响,随着温度的升高或湿度的降低,气溶胶样本中细菌Ct值逐渐降低,这可能是由于当温度较高、湿度较小时,更有利于细菌在空中的悬浮,从而易于采集;另一方面,我们发现空气气溶胶中细菌、动物、植物三者成分的相对含量存在差异,即细菌最多,植物次之,动物最少,此结果可能与气溶胶样本中不同成分的粒径大小有关,BIO Capturer-6对细菌类的小粒径颗粒的采集效率优于对动植物类较大粒径颗粒的采集效率。

