人源CBX7功能结构域的重组表达与纯化
胡温温,ALTAF Simair,吕缜一,陈 婷,张云龙,陆昌瑞
(东华大学化学化工与生物工程学院,中国上海201620)
CBX7(chromobox 7)是多梳家族(polycomb group,PcG)蛋白的成员,在细胞增殖和癌症发生中起着重要的调控作用。PcG蛋白是果蝇同源异型基因(homeotic gene,HOX)表达的表观遗传转录因子,研究发现其在一系列癌症类型中被解除调控[1~5]。PcG蛋白形成的多蛋白复合物(polycomb repressive complexes,PRCs)通过表观遗传机制引起染色体结构的改变和基因表达的转录抑制,从而调节染色质组织并将其维持在转录失活状态[1,6~7]。有关研究证明这些典型和非典型的PRCs(不依赖于转录抑制的方式对细胞和致癌功能进行调节的PcG蛋白)在胚胎发育、细胞增殖和分化、胚胎干细胞维持以及多功能干细胞的自我更新与维护过程中发挥重要作用[3~5,8]。PRCs基本上包括PRC1和PRC2,经典PRC1的组成如图1A所示。位于染色体22q13.1上的CBX7编码一种CBX(chromobox)蛋白,该蛋白质目前已被鉴定为PRC1的核心成分[9~11]。Pc蛋白是PRC1蛋白复合体的核心组分之一,哺乳动物中与Pc同源的CBX蛋白的已知结构域如图1B所示:CBX蛋白主要由N端chromodomain、C端Pc box(C-terminal polycomb repressor box)以及邻近N端的AT HOOK或AT HOOK Like(ATHL)结构域构成,果蝇Pc蛋白不含有AT HOOK或ATHL结构域[12]。CBX7在人类和小鼠中的结构域分布如图1C所示,其中在人类和小鼠中的CD(chromodomain)结构域均为11~60 aa,CBX家族C端结构域在人类CBX7中为209~240 aa(https://www.ebi.ac.uk/pdbe/entry/pdb/4mn3/protein/1),在小鼠中则是116~147 aa(https://www.ebi.ac.uk/pdbe/entry/pdb/4x3t/protein/1),以上分布情况来自PDB数据库。
作为PcG家族的成员,PRC1和PRC2共同诱导组蛋白共价翻译后修饰(H3K27me3)[13]。当PRC1亚基对组蛋白H2A(H2AK119Ub1)进行单泛素化时,PRC2亚基催化组蛋白H3lysine27(H3K27me3)的三甲基化[14],由于这两种组蛋白的翻译后修饰与转录沉默有关,而CBX7在此过程中结合H3K27me3并促使H2AK119Ub1泛素化,其重要性不言而喻。此外,CBX7还可以在各种癌症的起始和发展中独立发挥作用[11,13~18]。但是,CBX7在癌症发展中的作用尚存在争议:对于不同的细胞环境和癌症类型,CBX7既可以充当致癌因子也可以成为肿瘤抑制因子[11,13~18]。值得注意的是,CBX7也被证明可以正向调节前列腺细胞和造血干细胞的干细胞特性[19~20]。最近研究表明,CBX7 mRNA的高表达与癌症患者预后密切相关[21~22],CBX7的CD结构域通过与ncRNA(ANRIL)互作[23]实现对细胞衰老的调控,成为包括癌症在内的重大疾病诊断的潜在分子标志物及药物治疗的分子靶标[24~25]。
目前,关于CBX7结构研究的报道仅有两篇[26~27],分别解析出的是N端7~62 aa与C端219~248 aa区域的结构,但并未指明具体作用位点及机理。对于CBX7的分子生物学机理及其以何种信号通路发挥作用,我们尚不明确。本实验旨在利用分子生物学方法构建重组克隆并纯化出高纯度CBX7部分功能结构域单体,为后续结构生物学的研究奠定基础,同时为CBX7与PcG家族蛋白在癌症发展及肿瘤因子靶向抑制等相关领域中的机制探索提供新的思路和途径。

图1 CBX7家族蛋白概况(A)含有CBX蛋白的经典PRC1模式图;(B)果蝇Pc蛋白及人源5种CBX蛋白的结构示意图[12];(C)CBX7在人类和小鼠中的结构域分布图。Fig.1 General information about CBX7(A)The CBX in canonical polycomb repressive complex 1(PRC1);(B)Pc from Drosophila melanogaster and CBXs from Homo sapiens[12];(C)CBX7 structural domains in Homo sapiens and Mus musculus.
1 材料与方法
1.1 材料
1.1.1 菌株、表达载体和基因信息
感受态细胞DH5α、BL21(DE3)均由本实验室自制。所使用的pp-SUMO表达载体是经过改良之后含有6个SUMO标签的pET28a载体,选取的酶切位点是BamH I/Xho I。全长CBX7序列由生工生物工程(上海)股份有限公司(以下简称“生工”)合成并插入pUC57质粒作为PCR扩增反应的模板;CBX7蛋白的基因序列根据大肠杆菌密码子的偏爱性进行优化和改进,保留原有野生型蛋白质序列,可以进行后续实验。
1.1.2 试剂与仪器
Pfu DNA聚合酶、质粒小量提取试剂盒及琼脂糖凝胶DNA回收试剂盒购自生工;DNA D2000 marker购自中科瑞泰(北京)生物科技有限公司;限制性内切酶BamH I、Xho I购自美国NEB公司;上样缓冲液5×SDS loading dye由本实验室自制;DNA marker B600022、蛋白质 marker BM525、蛋白质预染marker及亲和层析介质Ni-NTA sefinoseTMresin购自生工;蛋白质marker 26610、预染marker 26616购自美国Thermo Fisher Scientific公司;HiTrap Q FF 5 mL预装柱、Superdex200 10/300 GL预装柱购自美国GE公司;其他试剂为国产分析纯。各阶段所用溶液及缓冲体系见表1。
核酸凝胶成像仪、PCR仪、蛋白质凝胶成像仪均购自美国Bio-Rad公司;离心机、紫外分光光度计购自美国Thermo Fisher Scientific公司;AKTA蛋白质纯化系统购自美国GE公司;FPLC蛋白质纯化系统购自苏州赛谱仪器有限公司。
1.2 方法与步骤
1.2.1 SUMO-CBX7融合基因的构建
通过在线软件(http://bioinf.cs.ucl.ac.uk/psipred/)预测出人源CBX7蛋白的二级结构以及蛋白质中氨基酸序列的无序分布图,从而判断出其结构域边界并据此设计需要表达片段的引物。CBX7基因经密码子优化后,在大肠杆菌中能够高效表达,以该序列作为PCR模板,用引物5′-aaaaGGATCCGCTCACAAATAT-3′和 3′-aaaaCTCGAGTAATAACGCGGTAATATCG-5′进行常规PCR,扩增出目的序列。经过改良后的pp-SUMO载体可增加蛋白质的可溶性高效表达,将BamH I和Xho I双酶切后的pp-SUMO载体和目的序列进行连接和转化,构建成功的重组质粒需要进行测序并鉴定。
1.2.2 SUMO-CBX7重组基因的表达鉴定
将测序成功的SUMO-CBX7质粒转入BL21(DE3)感受态细胞,经卡那霉素抗性筛选后,挑取阳性单克隆于37℃摇床培养过夜。取过夜培养的工程菌以1/100比例加入5 mL培养基中,卡那霉素占比0.1%,37℃、225 r/min培养至OD6000.5~0.6。加入1 mmol/L的异丙基硫代-β-D-半乳糖苷(isopropylthio-β-D-galactoside,IPTG),于 37℃进行快速诱导表达,约4 h后留样,进行SDS-PAGE和Western-blot鉴定。
1.2.3 SUMO-CBX7融合蛋白的亲和纯化
取1~2 L诱导表达后的菌液,4℃条件下3 500 r/min离心30 min。将离心后的菌液去上清,沉淀用冰冷的binding buffer重悬,破碎细胞之前加入100 μL的苯甲基磺酰氟(phenylmethane-sulfonyl fluoride,PMSF)(100 mmol/L)混匀,破碎第一遍后再次加入100 μL的PMSF混匀并继续破碎,破碎之后的细胞悬液需经过高速离心分离上清和沉淀,其中离心速度为12 000 r/min,时间为1 h。将保存在20%乙醇的Ni-NTA预装柱用ddH2O冲洗干净,用多于5 CV(column volume)的binding buffer平衡,上清液过两遍使目的蛋白与Ni-NTA柱内介质充分结合。然后分别用多于5 CV的wash buffer和elution buffer洗脱杂蛋白并收集目的蛋白。各步骤分别留样并用12%SDS-PAGE和Western-blot检测鉴定。

表1 溶液及缓冲体系Table 1 Buffers used in this study
1.2.4 离子交换层析
Relianx色谱仪的离子交换层析操作系统如下:选用HiTrap Q FF 5 mL预装柱,起初设置低速流出20%乙醇,用多于5 CV的ddH2O冲洗柱子,然后用2~3 CV 1 mol/L NaOH冲洗,接下来继续用多于5 CV的ddH2O冲洗柱子,使用5 CV无盐buffer平衡,上样200~500 μL蛋白质浓缩样品,设置盐浓度梯度(将含NaCl浓度为1 mol/L的ion-exchange buffer按照1%~100%的体积比与无盐buffer混合以改变洗脱液盐浓度,此处可直接在程序中设置)冲洗,收集UV280以及UV254吸收峰处的蛋白质洗脱样品,留样并用12%SDSPAGE进行检测与分析,最后将样品浓缩。
1.2.5 分子筛层析
AKTA蛋白质纯化系统的分子筛层析操作如下:选用Superdex200 10/300 GL预装柱,起初设置低速流出20%乙醇,用1.5 CV的ddH2O冲洗柱子,然后用1~1.5 CV size-exclusion buffer平衡,接下来上样250 μL蛋白质浓缩样品,洗脱1 CV,收集UV280以及UV254吸收峰处的蛋白质洗脱样品,留样并用12%SDS-PAGE进行检测与分析。最后将样品浓缩,加入5%甘油,用液氮速冻,置于-80℃冷存。
2 结果
2.1 SUMO-CBX7重组质粒的构建和表达
为使目的基因在大肠杆菌内可溶性高效表达,我们选择将目的基因导入pp-SUMO载体中。双酶切后的pp-SUMO质粒长度大约5 600 bp(图2A)。插入pUC57质粒的全长CBX7基因序列作为PCR扩增反应的模板,大小约2 000 bp(图2B)。通过PCR扩增反应得到的目的片段CBX7(aa 145~227)如图 2C 所示,其经过 BamH I/Xho I双酶切后的片段大约249 bp(图2D)。
将构建好的重组质粒(图3A)转入BL21(DE3)感受态细胞,并加入1 mmol/L的IPTG,于37℃进行快速诱导表达(图3B,3C)。
2.2 SUMO-CBX7融合蛋白的亲和纯化
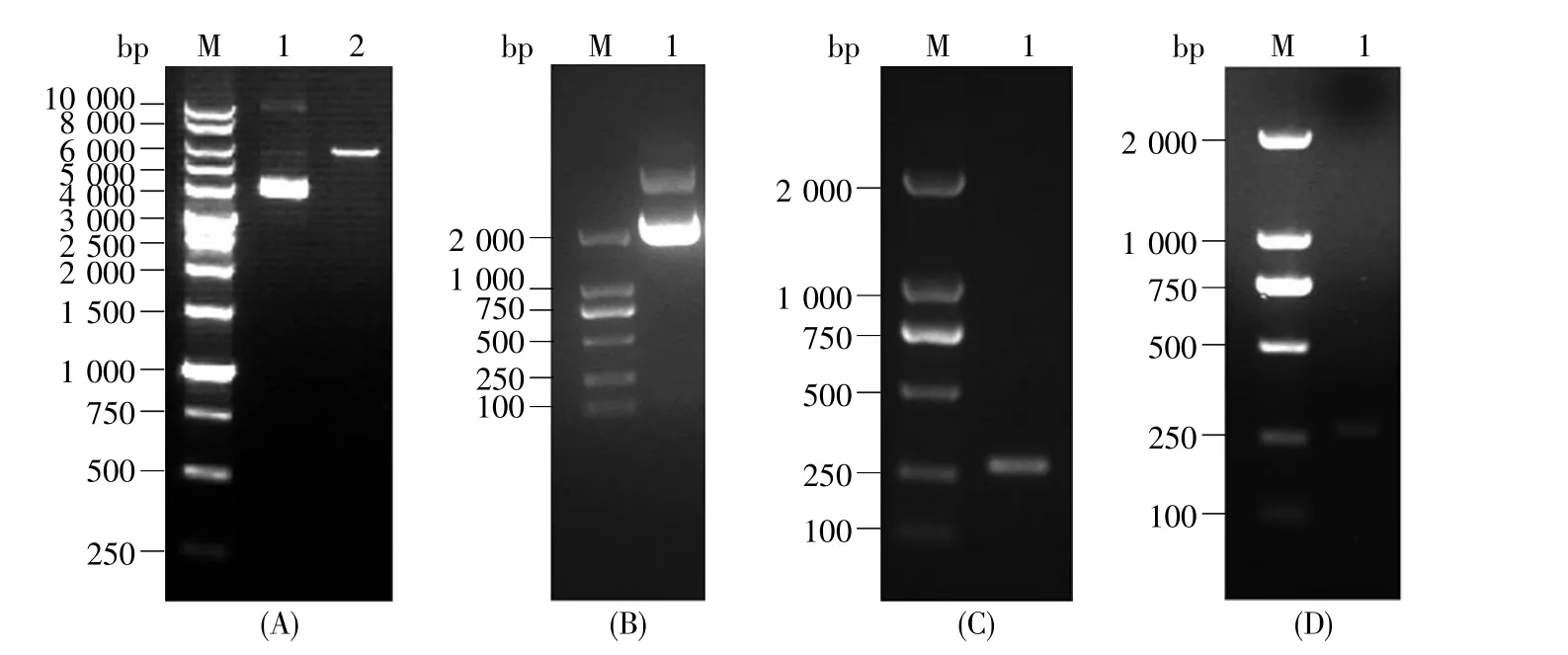
图2 琼脂糖凝胶电泳分析CBX7目的片段和pp-SUMO质粒载体(A)pp-SUMO质粒检测。M:DNA marker B600022,1:pp-SUMO质粒,2:经BamH I/Xho I双酶切后的pp-SUMO质粒;(B)CBX7模板质粒检测。M:DNA marker D2000,1:CBX7质粒;(C)CBX7(145~227 aa)PCR产物检测。M:DNA marker D2000,1:CBX7(145~227 aa)片段;(D)CBX7(145~227 aa)PCR 产物酶切检测。 M:DNA marker D2000,1:经 BamH I/Xho I双酶切后的 CBX7(145~227 aa)片段。Fig.2 Agarose gel electrophoresis of plasmid pp-SUMO and CBX7 fragment(A)Analysis of plasmid pp-SUMO.M:DNA marker B600022.1:Plasmid pp-SUMO.2:Plasmid pp-SUMO after BamH I/Xho I digestion;(B)Analysis of CBX7 plasmid.M:D2000 DNA marker.1:CBX7 plasmid;(C)Analysis of CBX7(145~227 aa)fragment.M:D2000 DNA marker.1:CBX7(145~227 aa)fragment;(D)Analysis of CBX7(145~227 aa)fragment after BamH I/Xho I digestion.
融合蛋白N端带有6*His标签,可以使用Ni-NTA亲和层析对其进行纯化。亲和层析的纯化结果如图4所示,过完两遍的上清(binding flow through)中不含目标蛋白,说明融合蛋白能够充分与亲和介质结合。根据融合蛋白的性质和等电点,各阶段选用缓冲液pH 8.0,由于咪唑(imidazole)对分离杂质极为重要,选用不同咪唑浓度梯度的wash buffer对杂蛋白进行洗脱,找到合适的洗脱条件(10 mmol/L咪唑wash buffer 10 CV,20 mmol/L咪唑wash buffer 5 CV,50 mmol/L咪唑elution buffer 10 CV收集,多于5 CV 70 mmol/L strip buffer冲洗Ni-NTA柱),最终获得较为纯净的目的蛋白。

图3 重组质粒的鉴定与表达(A)重组质粒检测。M:DNA marker B600022,1:SUMO-CBX7(aa 145~227)质粒;(B)12%SDS-PAGE电泳图;(C)用于检测His标签的Western-blot图,6*His-tag单克隆抗体来自ProteinTech。M1:蛋白质marker 26610;M2:蛋白质预染marker 26616;UN:诱导前的样品;IN:1 mmol/L IPTG诱导后的样品。Fig.3 Analyses and expression of recombinant plasmid(A)Analysis of recombinant plasmid.M:DNA marker B600022.1:Plasmid SUMO-CBX7(aa 145~227);(B)SDS-PAGE analysis in a 12%polyacrylamide gel;(C)Western-blot using 6*His-tag monoclonal antibody(ProteinTech).M1:Protein marker 26610;M2:Protein marker 26616;UN:Uninduced sample;IN:1 mmol/L IPTG induced sample.
2.3 SUMO-CBX7的性质及结构鉴定
由图4可知Ni-NTA亲和层析可以去除90%杂蛋白,但仍有部分杂蛋白和降解条带无法分离干净,因此我们依据物质的带电性质选用HiTrap Q FF(强阴离子交换层析)来继续去除杂质,并利用分子筛层析进一步纯化。相关结果如图5、图6所示,目的蛋白以对称、尖锐的单峰形态被洗脱下来,SUMO-CBX7融合蛋白的纯度达到97%及以上,已达到结晶条件。
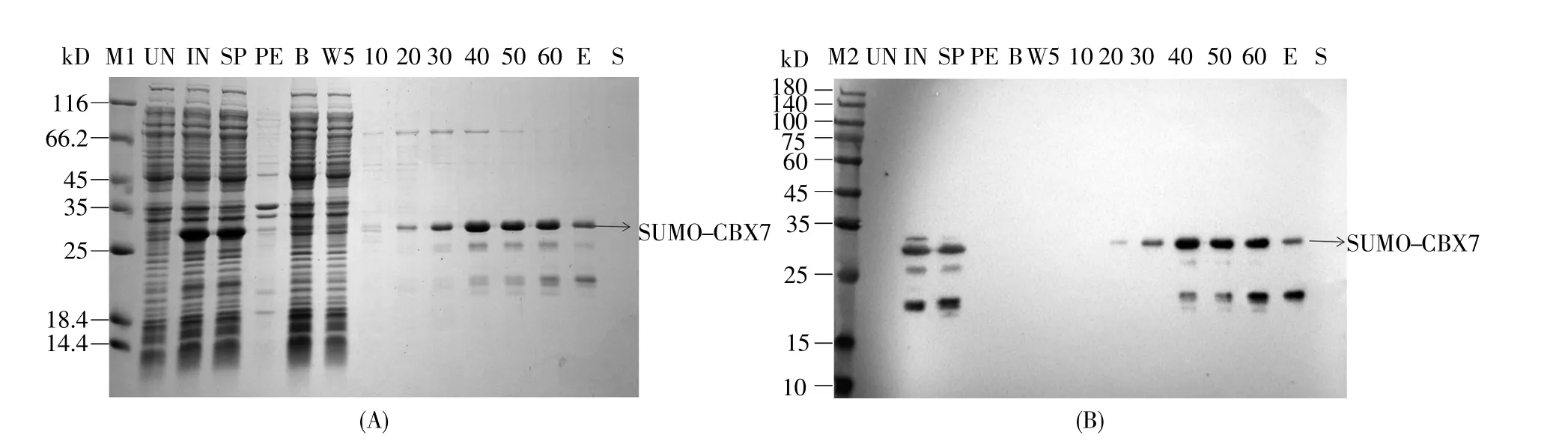
图4 经Ni-NTA亲和层析纯化后的SUMO-CBX7融合蛋白的SDS-PAGE与Western-blot分析(A)12%SDS-PAGE电泳图;(B)Western-blot图。M1:蛋白质marker BM525;M2:蛋白质预染marker;UN:诱导前的样品;IN:1 mmol/L IPTG诱导后的样品;SP:上清;PE:沉淀:B:过完两遍的上清;W5:含5 mmol/L咪唑的洗脱穿出液;10~60:分别为10~60 mmol/L咪唑浓度梯度的洗脱穿出液;E:250 mmol/L咪唑的蛋白质收集液;S:含1 mol/L咪唑的洗脱穿出液。Fig.4 SDS-PAGE and Western-blot analyses of SUMO-CBX7 protein purified by Ni-NTA affinity chromatography(A)SDS-PAGE analysis in a 12%polyacrylamide gel;(B)Western-blot using 6*His-tag monoclonal antibody(ProteinTech).M1:Protein marker BM525;M2:Regular range protein marker;UN:Uninduced sample;IN:1 mmol/L IPTG induced sample;SP:Supernatant of cell lysate;PE:Pellet of cell lysate;B:Binding flow through;W5:Washing flow through(5 mmol/L imidazole);10~60:Washing flow through(10~60 mmol/L imidazole);E:Elution fraction(250 mmol/L imidazole);S:Strip flow through(1 mol/L imidazole).

图5 SUMO-CBX7的离子交换层析纯化及鉴定分析(A)SUMO-CBX7离子交换层析纯化后的图谱。红线:UV254,蓝线:UV280;(B)上样留样的12%SDS-PAGE电泳图。M:蛋白质marker BM525,1:上样留样;(C)出峰收集液12%SDS-PAGE电泳图。Lanes 1~12:第38~49 mL收集液留样,M:蛋白质marker BM525。Fig.5 Identification and purification of SUMO-CBX7 by ion exchange chromatography(A)The anion exchange chromatogram of SUMO-CBX7.Red curve:UV254.Blue curve:UV280;(B)12%SDS-PAGE analyses of the injection sample.M:Protein marker BM525.1:Injection sample;(C)12%SDS-PAGE analyses of the collected fraction corresponding to the peak.Lanes 1~12:The corresponding samples of the fractions 38~49.M:Protein marker BM525.

图6 SUMO-CBX7的分子筛层析纯化及鉴定分析(A)SUMO-CBX7的分子筛层析图谱。红线:UV254,蓝线:UV280;(B)上样留样的12%SDS-PAGE电泳图。M:蛋白质marker BM525;Inject:上样留样;1~3:第88~90 mL收集液留样。Fig.6 Identification and purification analyses of SUMO-CBX7 by size-exclusion chromatography(A)The size-exclusion chromatography of SUMO-CBX7.Red curve:UV254.Blue curve:UV280;(B)12%SDS-PAGE analyses of the injection sample.M:Protein marker BM525;Inject:Injection sample;Lanes 1~3:The corresponding samples of the fractions 88~90.
3 讨论
癌症被世界卫生组织(World Health Organization,WHO)列为世界五大疑难杂症之一。近日,世界卫生组织国际癌症研究机构 (International A gency for Research on Cancer,IARC)发布最新报告称近几年癌症发病率呈上升趋势,人口老龄化已成为细胞癌变的重要因素之一(https://www.iarc.fr/wp-content/uploads/2018/09/pr263_E.pdf,2018年10月获取该信息)。PcG蛋白是转录抑制因子,其调节着细胞增殖、细胞衰老、细胞凋亡、细胞癌变等关键发育和生理过程[28],在人类癌症发生和发展中发挥重要作用。CBX7作为PcG家族成员PRC1复合物的重要组分之一,参与多种肿瘤抑制因子转录沉默机制,与不同类型恶性肿瘤的发生密切相关。最近研究表明,miR-19通过抑制CBX7的表达而影响肺癌细胞的增殖、迁移和细胞周期[29]。CBX7在维持胚胎干细胞自我更新和全能性中发挥重要作用,其表达随着小鼠胚胎干细胞(embryonic stem cells,ESCs)的分化而减少:CBX7在ESCs中的过表达会增强ESCs的多能性,反之,CBX7的活性丧失,ESCs发生分化[30]。CBX7是多梳谱系蛋白质中研究最为广泛的代表[31],在细胞衰老和多种癌症类型中发挥着关键的调控作用,可作为癌症诊断和预后中的分子标志物。
然而,CBX7参与细胞增殖、衰老、干细胞分化和多种癌症类型的分子机制尚未明确。而且,除了已报道的CBX7蛋白C端Pc-box结构域和N端CD结合结构域的精细三维结构[26~27]之外,CBX7其余部分的功能和结构仍是未解之谜。这对于CBX7相关的靶向药物研究极其不利。
本实验通过在线软件PSIPRED对人源CBX7蛋白的二级结构以及氨基酸序列无序分布进行预测(结果未给出),根据预测结果判断CBX7功能结构域边界。同时,结合在线软件PredictProtein预测显示的蛋白质结合区段170~198 aa,设计出包含该功能结构域的145~227 aa区段的引物。在此基础上,利用大肠杆菌SUMO体外表达系统高效可溶的特点,构建出CBX7功能结构域CBX7(aa 145~227)的重组表达载体。随后,通过Ni-NTA亲和层析对融合蛋白进行纯化,在Ni-NTA亲和层析分离杂质时,根据蛋白质性质选择合适的缓冲液pH以及盐浓度,可提高纯化效率。由于蛋白质样品的复杂性,需要结合离子交换和分子筛层析对其进行进一步的纯化。通过选择强阴离子预装柱HiTrap Q FF和分子筛层析柱Superdex200对目的融合蛋白和剩余杂质进行分离,最终获得高纯度可结晶的融合蛋白,可为后续结构生物学相关研究奠定基础。
虽然CBX7与癌症发生发展和干细胞全能性相关,并已成为CBX蛋白家族的研究热点,但是我们对CBX7(aa 145~227)片段知之甚少。目前,有关CBX7结构和功能的研究仍处于探索阶段。由于CBX7蛋白本身性质极不稳定,容易降解,且中段结构域可溶性差,所以利用pp-SUMO表达系统提高蛋白质可溶性表达并拿到结构域单体非常不易。我们通过纯化多达20个不同结构域片段,仅得到文中所述145~227 aa结构域单体。在所纯化的20个结构域片段中,有14个片段形成包涵体存在于沉淀中,即使对其进行变性、复性处理也不能够得到有活性的蛋白质;剩下可溶性较好部分全部出现不同程度降解或部分片段从目的片段上断裂的现象,致使CBX7蛋白的纯化工作仍存在巨大挑战性。本实验通过对人类CBX7(aa 145~227)功能结构域的原核表达,不断改善纯化体系,首次成功获得稳定且高纯度的融合蛋白,可用于结晶。我们希望通过晶体学实验解析出该功能域的精细三维结构,并以此为突破点对该区段的分子学功能进行探索,分析其分子作用机理和结合位点,为后续人类CBX7全长结构研究和PRC1复合物精细三维结构及功能研究提供科学依据,同时为PcG家族蛋白在癌症治疗和肿瘤抑制靶向药物等领域中的研究提供新思路。

