攸县麻鸭DMA细管精液冷冻技术研究
袁景阳,喻宗岗,张明军,李 闯,姚亚铃,燕海峰*
(1.湖南农业大学,中国湖南长沙410128;2.湖南省畜牧兽医研究所,中国湖南长沙410131;3.怀化市畜牧水产事务中心,中国湖南怀化418000;4.湖南家禽安全生产工程技术研究中心,中国湖南长沙410128)
很多地方家禽品种在环境适应、抗逆、抗病以及肉质风味等方面具有独特优势,构成了我国宝贵的禽类育种基因库。我国原有的100多个禽品种已有部分灭绝,同时很多目前不受欢迎但可能有着巨大潜在育种价值的品种也即将灭绝,而活体保种场又面临着如禽流感等大型疫病等风险,因此遗传资源日益匮乏将成为禽类育种工作者面临的主要问题。
利用冷冻保存技术,可以将精子、卵、胚胎等置于-196℃的环境中,使其新陈代谢停止,从而进行保存,在需要时再解冻利用。与活体保种相比,这种冷冻保种技术的优点为:1)克服了活体保种中疾病、自然灾害、近亲交配等困境,有效减少保种经费;2)保存年限长,可达200年以上;3)解冻后种群恢复快[1~2]。
目前禽类冷冻精液受精率极不稳定,只有少数国家建立了禽类精子冷冻库。在鸭精液冷冻研究方面,钟文[3]利用7%甘油作为冷冻保护剂,对北京鸭与正番鸭精液进行冷冻,分别获得了62.5%与18.7%的受精率,但未说明是用颗粒还是细管进行冷冻的。韩雪峰等[4]报道,以10%二甲基亚砜和细胞冻存管对金定鸭精液实施冷冻,受精率为65%。刘建忠等[5]利用11%甘油、细管与颗粒,对荆江麻公鸭、洪山公鸡的精液实施冷冻,测定其存活率与顶体完整率,发现公鸭冻精效果均优于公鸡,同时指出未能完成鸭冷冻精液受精率检测,因为鸭的人工输精难度太大。李闯[6]采用不同冷冻保护剂,对精武鸭精液实施冷冻管保存,并检测了其活力,但也没有进行受精率检测。宋兴国等[7]对禽类精液保存及鸭的人工授精进行了综述,指出鸡冷冻精液已在美国的原种鸡场应用,而对鸭只描述了人工输精。禽类精液冷冻技术中甘油作为冷冻保护剂因其对禽类的避孕作用,冻精解冻后需要通过5℃离心去掉甘油,方法复杂且精子活力大幅度降低,而用二甲基乙酰胺(dimethylacetamide,DMA)保护剂则不用离心去掉。在冻精包装方面,细胞冻存管、颗粒等均无法批量制作,也不便于标记、大量与长期保存,只有细管便于商业化生产。因此,以上鸭精液冷冻技术,要么方法落后,要么没有进行受精率检测,无法进行推广应用。
阳小胡[8]利用甘油细管冷冻黑凤鸡精液,平均受精率达到77.63%;黄琳等[9]利用DMA颗粒冷冻黑凤鸡精液,平均受精率为67.09%;曹江丽[10]利用DMA细管冷冻黑凤鸡精液,最高获得77.61%的受精率。本文在以上基础上,对笼养湖南优秀地方品种攸县麻鸭公鸭的精液冷冻技术进行研究,为我国鸭乃至禽类延长公禽在后裔测定中的种用期限,利用精液冷冻保存种质资源弥补活体保种的不足等领域的研究与应用提供技术支撑。
1 材料与方法
1.1 材料
1.1.1 实验动物
湖南省畜牧兽医研究所单笼饲养、全价日粮饲喂、自动饮水的攸县麻鸭公鸭43只(170 d),临武鸭母鸭121只,试验时间为2017年11月至2018年5月。
1.1.2 实验仪器与试剂
视频温控显微镜(HW-39A,江西新怡光学仪器有限公司);恒温水浴锅(HH-SI,金坛市医疗仪器厂);电子冷暖箱(FYL-12MC-B3,北京福意联医疗设备有限公司);细管(0.25 mL,法国IMV卡苏科技股份有限公司);全自动冰点渗透压计(FM-8P,上海医大仪器有限公司);孵化机(德州市德城区佳裕孵化设备厂);液氮熏蒸装置(发明专利ZL201210105884.8)。LR液、B液等稀释液的配方与配制方法参见已有文献[9,11]报道。
1.2 方法
1.2.1 精液收集及稀释
在43只公鸭中挑选按摩敏感的12只进行采精训练。连续5 d统计120只母鸭产蛋量,从中挑选出产蛋量稳定的30只,分为2组。
采精训练方式为单人背部按摩法:右手固定公鸭双脚,利用大腿与腰部联合固定公鸭的上半部,左手掌心紧贴公鸭髋关节,大拇指与四指分别紧贴公鸭腰两侧,沿尾部方向缓慢按摩与快速抚摸交替进行,按摩到尾部泄殖腔时可采用左右大拇指与食指中指联合缓慢轻微挤压刺激公鸭泄殖腔,每天两次。
采精有两种方式,一是诱情采精。先选择1只母鸭,抱住腹部将头依次伸向笼中的公鸭,记下反应敏感的个体,选择适合诱情对象。诱情采精时,母鸭绑住双腿后左手托住放入公鸭笼内,右手调整公鸭位置,等公鸭啄住母鸭颈部的羽毛并站立在母鸭背上,左手迅速拿着采精杯紧贴在母鸭泄殖腔,待公鸭生殖器伸入采精杯中,射出精液。二是按摩采精,采精员坐在凳上,右手大拇指与无名指、小拇指固定公鸭双腿,食指、中指夹住采精杯,双腿固定公鸭上半部,使公鸭头朝采精员左方,左手沿尾部抚摸30次左右,待泄殖腔膨胀变硬,左手食指与中指所夹的采精杯对准泄殖腔后,左手三指在泄殖腔周围轻缓将生殖器挤压弹出后可收集精液。
用1 mL注射器吸取体温预热的稀释液于采精杯精液处,精液与稀释液比例:按摩采精为1∶2、诱情采精为1∶4,将精液稀释与冲洗后移入5 mL离心管中。用生理盐水冲洗采精杯,再采下一只。用冷藏箱(5℃左右)将稀释后的精液迅速带回实验室,用移液器吸取10 μL稀释精液在视频温控显微镜(物镜 20×、32 ℃)下检测精子活力[8]。
(2)制造业企业技术创新能力同中间品进口的国际技术溢出效应间呈现明显的正相关性,且该种正相关性在东部区域体现的更加明。东、中、西部区域受到研发强度同中间品进口的国际技术溢出的协同干扰较严重,人力资本和经济开放度对西部区域的影响不显著。
1.2.2 稀释液渗透压筛选
在无菌条件下,吸取LR液6 mL分成3等份,标记为 LR1、LR2、LR3,分别添加 0%、10%、20%无菌蒸馏水并进行渗透压测定;吸取B液7.2 mL,分成 3等份,标记为 B1、B2、B3,分别添加 10%、20%、30%无菌蒸馏水[11]。
依次采集多只公鸭精液,收集后总量在1.6 mL左右,轻轻混匀,吸取150 μL于离心管中,再移取450 μL LR稀释液,等温1∶3稀释。采集混合精液2 mL,轻轻混匀,吸取200 μL于离心管中,再移取800 μL B液,等温1∶4稀释。每个渗透压组设3个平行样。
稀释后精液轻轻混匀,检测并记录精子活力,于5℃左右保存。取冷藏精液10 μL,按前述方法每隔一定时间检测精子活力,根据活力情况确定结束检测时间。
1.2.3 精液冷冻与活力检测
将活力为0.5以上的稀释后精液置于5℃平衡30 min,之后1∶1添加含12%DMA的冷冻保护剂平衡10 min(DMA终浓度为6%),平衡后用细管吸取精液,至细管容积的9/10,利用冷冻装置第2层将细管在液氮表面熏蒸7 min,再投入液氮冷冻保存10 min以上。将细管从液氮中迅速取出立即在40℃水浴解冻10 s进行抽检。将活力0.3以上的批次用纱布袋收集,在液氮罐中冷冻保存。
1.2.4 冷冻精液受精率检测
输精在上午9:00~10:00进行,每只母鸭冻精与原精输精量分别为0.2 mL、0.05 mL,首次输精时间隔48 h后再次输精,之后输精间隔为96 h。第一次输精后第2天开始收集种蛋,收集14 d。淘汰破壳蛋、畸形蛋,每批种蛋(总计3批)采取高锰酸钾-甲醛熏蒸消毒,在37.5℃、相对湿度为60%条件下进行孵化。
1.3 数据统计与分析
数据经EXCEL软件处理后,用SPSS 19.0软件中的Duncan’s进行均值显著性检验与单因素方差分析,结果用平均值±标准差(±s)表示。
2 结果与分析
2.1 鸭精液的采集
在制作采精杯时偶然发现,用塑料洗瓶材质比玻璃更容易将精液洗脱与收集。根据攸县麻公鸭的体型,将采精杯高度设计为7.5 cm,并将杯口切开4 cm斜口以便于其生殖器自然伸入。诱情采精时仅需要把没有切口的半边中心点紧贴在母鸭泄殖腔即可,整个切口都用封口膜包裹,可以适当保护公鸭生殖器。由于每次能采出的精液量不多,这些改进能显著提高精液收集效率。
43只公鸭中,训练时建立性反射的共12只(占27.9%),其中适合诱情的有7只,剩下的5只则采用按摩采精方式,诱情与按摩的采精量范围分别为0.22~0.43 mL与0.12~0.20 mL,平均采精量分别为0.30 mL、0.16 mL,诱情采精精液量明显多于按摩采精的量(图1)。

图1 不同方式下不同公鸭个体的采精量Fig.1 The semen volume of drakes collected by different methods
2.2 精液稀释液渗透压对鸭精子活力的影响
采用3种不同渗透压的LR稀释液对鸭精液进行保存并定点检测精子活力,结果显示:在相同时间点各组活力没有显著差异(P>0.05),在150 h检测时,3组精子的活力均为0;在相同时间段,如0~24 h与 24~125 h,只有 215 mOsm/kg组活力显著下降(P<0.05),其他两组活力下降不显著(P>0.05,表1)。
就LR液3组渗透压中精子活力随时间变化的趋势而言,在215 mOsm/kg至303 mOsm/kg的渗透压范围内,呈现渗透压越高稀释后保存精子的活力越好的趋势;同时精液稀释后3组精子活力均随时间延长呈逐渐下降的趋势(图2)。
以3种不同渗透压的B液对鸭精液进行保存时,与LR液相同,在相同时间点3种不同渗透压稀释液保存的精子活力没有显著差异(P>0.05);同时,0 h与48 h时间点的精子活力也没有显著差异(P>0.05),但均显著高于96 h时间点的精子活力(P<0.05)。另外,B液的96 h与LR液的125 h时间点精子活力相似,说明在精子存活时间上LR液优于B液。但在0~48 h时间段内,B液的精子活力高于LR液的精子活力,说明B液可能适合短期保存(表 2)。
此外,在0~96 h时间段,B液所保存精子的活力呈现中间高、两端低的趋势,而LR液在0~125 h时间段所保存精子的活力则呈现一直下降的趋势,这可能是因为B液比LR液对攸县麻鸭精液的稀释打击更大,而这种打击又能恢复。
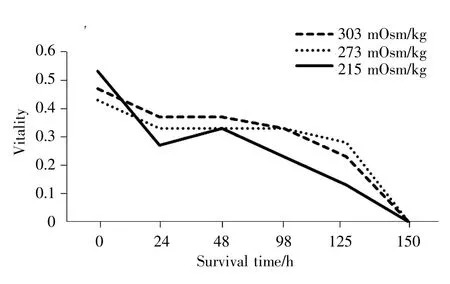
图2 不同渗透压LR液中精子活力的变化趋势Fig.2 The vitality trend of sperm stored in LR with different osmotic pressures
2.3 鸭冷冻精液解冻后的活力分析
由表3可知,诱情组原精活力的均值为0.71,冷冻后活力均值为0.33,冷冻后损失活力率为54%;按摩组的原精活力平均为0.61,冷冻后活力均值为0.19,且冻前冻后活力损失达68%,均未达到输精要求。
2.4 冷冻精液解冻后输精的受精率分析

表1 不同渗透压LR稀释液对精子保存活力的影响Table 1 The vitality of sperm stored in different osmotic pressures of LR diluents
就受精率而言,冻精组第1批(2~6 d)的平均受精率最高(为93.8%),而原精组第3批(11~14 d)的平均受精率最高(为92.3%)。就受精率达100%的时间点而言,冻精组有3次,均出现在输精后间隔 2 d 或 3 d,分别在 5 d(11/11)、8 d(13/13)、12 d(12/12);原精组有4次,在输精后间隔2~4 d均有出现,分别在 5 d(14/14)、10 d(9/9)、12 d(12/12)、14 d(7/7)。汤树生[12]报道诱情采精时公番鸭的平均射精量为1.07 mL、密度为1.85×109/mL,原精输精量0.2 mL的平均受精率为82.46%,输精后间隔2 d与3 d的受精率达到100%,与本文冻精组情况类似。

表2 不同渗透压B液对精子保存活力的影响Table 2 The vitality of sperm stored in different osmotic pressures of B diluents
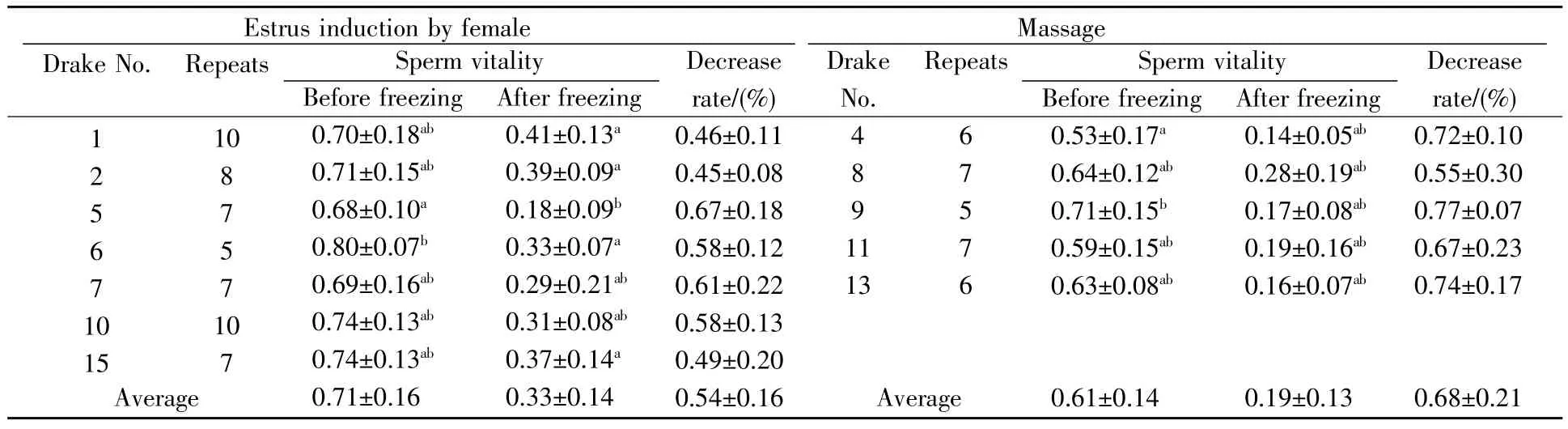
表3 不同采精方法下鸭精液冷冻前后活力的比较Table 3 Semen vitality before and after freezing using different collection methods
就受精率变化趋势而言,除最后一次外,冻精组与原精组的趋势基本一致。但是,原精组受精率比冻精组受精率稍稳定,在2 d、6 d、10 d输精后,受精率在输精后的第1天出现降低,最低降到64.3%,但在第2天又会上升;冻精组在7 d、11 d、14 d出现最低受精趋势,最低达到了52.7%。需要指出的是,两组受精最低的情况都是在第7天出现。
冻精组与原精组的受精率、孵化率的平均值相似。在第3次输精后,原精组产蛋量下降,导致种蛋总数少于冻精组(表4)。本文输精间隔为4 d,如果输精间隔为2 d或者3 d,那么受精率会更高(图3)。冻精组活力在0.3以上、输精量为0.2 mL,而原精没有进行稀释,单次输精量为0.05 mL,同时原精与冻精公鸭年龄也不同,这可能是导致冻精组孵化率略高于原精组的原因。
3 讨论
3.1 影响人工采集鸭精液质量的因素
种鸭精液质量受很多因素的影响。辛清武等[13]报道诱情采精时金定鸭的平均射精量为0.78 mL、密度为1.67×109/mL。韩卫杰等[14]报道按摩采精时斑嘴鸭的平均采精量为0.8 mL、密度为8.0×108/mL。刘建忠等[5]报道,荆江麻鸭公鸭接受按摩采精时的精液量为0.2~0.4 mL。这些说明不同品种与精液采集方式对公鸭精液质量有很大影响。季从亮等[15]报道,种鸭周龄对受精率和孵化性能影响显著,在产蛋后期(15~24周),孵化性能显著下降。本文同批公鸭45周龄以后的冻精质量也远不如前期的,其中年龄可能是主要原因。
本文诱情采精量平均0.3 mL,与上述刘建忠等[5]报道的荆江麻鸭按摩采精量相近,但低于其他鸭种的采精量。关于文中的精液冷冻效果,诱情采精方式均优于按摩采精方式,因此鸭的采精应以“诱情为主、按摩为辅”的方式。利用诱情方式采集精液,公鸭衔脖、踩背、调位射精等一系列步骤最快可在5 s内完成,且精液的采集由于多次采精杯干扰也容易致使公鸭应激,导致射精方式的改变,从而导致采精的失败,如果在杯内覆一层封口膜,则能减轻生殖器碰壁损伤。此外,我们在实验中发现,1只诱情母鸭在诱情3只公鸭后就已经很累,如果能做出标本母鸭,甚至仿生母鸭生殖道器具,可能会增强公鸭采精体验,同时减轻母鸭伤害,提高采精成功率。对于水禽,如何推广笼养,有效地采集精液,降低采精与输精劳动力成本,是水禽人工输精技术推广的前提。本文通过优化采精模式,制作采精杯,筛选精液稀释液等,能在减轻公鸭采精应激、简化采精操作与提高精液利用率等方面为鸭人工授精技术的推广提供技术参考。

图3 输精间隔时间与受精率Fig.3 The fertilization rate at different insemination intervals

表4 冻精组与原精组的受精率与孵化率检测Table 4 Fertility and hatchability of the frozen and fresh semen samples
3.2 鸭精液冷冻技术的影响因素
精液稀释液渗透压的筛选是精液冷冻技术的基础。采克俊等[16]报道鸡精液稀释液的渗透压范围为295~420 mOsm/kg,在高渗环境中鸡精子会出现“暂时性休克”,即刚稀释后观察活力为零,随时间的延长活力逐渐回升(与本文B液稀释鸭精液情况相似),但精子生存指数较低,说明鸡精子对高渗环境的适应需要一定时间,而且适应能力很有限。本文发现LR稀释液渗透压最小的215 mOsm/kg组中精子活力随时间变化明显,说明LR稀释液的渗透压越小对精子活力影响越大,可能与上述高渗透压对精子影响的原理一样。王晓娟等[11]报道,鸡精子活力在B液中的渗透压最低组(261 mOsm/kg)较好(但差异不显著),这与本文鸭精液在B液中也是渗透压最低组较好(但差异不显著)的趋势一致,但鸡精子存活时间可达386 h,远远高于在相同B稀释液中鸭精子存活时长。同时,本文鸭精液在LR液不同渗透压中的活力变化趋势与B液不同渗透压中的活力变化趋势不一样。这些说明鸭精液与鸡精液对不同稀释液以及渗透压的适应性有区别。
禽类精子在外观和大小上大体是相似的,均为棒状与长尾型,只是鸡精子尾部更长,鸡、鸭精子总长度分别为 90~100 μm、56.3~71.9 μm,在精液冷冻技术研究时往往同时进行。Tselutin等[17]采用DMA与颗粒冻精,60~70℃专用装置或水浴解冻,每3 d(火鸡为7 d)左右每次每只母禽输精0.05~0.2 mL,结果显示鸭、鹅、火鸡、鸡的冻精受精率分别为 69%~90%、81%~90%、80%~90%与75%~85%,鸡的相对较低,但相差也不大,这是国际报道的最好结果。刘建忠等[5]采用相同的冷冻技术对公鸭与公鸡的精液进行处理,发现解冻鸭精子存活率和顶体完整率都不同程度地高于相同类型的公鸡冻精,这也许与精子尾部长度不同有关,因为哺乳动物精子普遍比禽类耐冻,而哺乳动物的精子为蝌蚪状,比禽类的更短。因此,鸡与水禽精液用相同冷冻技术,虽然有小的差异,但还是可行的。本文采用了曹江丽[10]报道的鸡精液冷冻方法冷冻鸭精液,获得的受精率比鸡的更高,也高于近几年国内外同类报道。由此也可以预测,本文所报道方法,很有可能适合其他的禽类。
4 结论
本文将前期鸡精液冷冻技术研究中筛选出的简单、便携且能在资源场实施的冷冻方案应用于麻鸭精液冷冻,获得了高于目前报道的受精率,提示该方法在禽类有一定的通用性。由于公禽种用期限很短,而后裔测定所需时间较长,常发生根据后裔测定结果筛选出好的公禽时该公禽已经丧失了繁殖能力的情况,而本文精液冷冻技术则可进行弥补。因此,本文为我国鸭乃至禽类延长公禽在后裔测定领域种用期限,利用精液冷冻保存种质资源弥补活体保种的不足等领域的研究与应用提供了技术支撑。

