基于转录组测序技术观察电针对2型糖尿病小鼠血浆外泌体circRNA表达的影响
寿崟,虎力,徐平,张伟波,高原,马宇航,张必萌
基于转录组测序技术观察电针对2型糖尿病小鼠血浆外泌体circRNA表达的影响
寿崟1,2,虎力1,徐平1,张伟波1,高原1,马宇航2,张必萌2
(1.上海中医药大学,上海 201203;2.上海交通大学附属第一人民医院,上海 200080)
基于转录组测序技术,研究电针对2型糖尿病小鼠血浆外泌体circRNA表达和信号通路的影响。将30只C57BL/6小鼠随机分为正常组、模型组和电针组,每组10只。模型组和电针组均予以高脂饮食6周,之后注射链脲佐菌素。电针组自高脂饮食4周后开始接受电针治疗。监测各组小鼠空腹血糖的变化,采用超速离心法提取小鼠血浆外泌体,应用RNA-seq技术对各组小鼠血浆外泌体circRNA进行转录组测序,并对测序结果进行基因差异表达、基因功能与信号通路富集分析。与正常组比较,模型组造模后小鼠空腹血糖显著升高(<0.01);与模型组比较,电针组治疗后小鼠空腹血糖显著降低(<0.01)。RNA-seq结果显示,造模后经电针治疗,共有165个circRNA的表达发生明显变化,其中144个基因下调,21个基因上调。电针对2型糖尿病小鼠的作用主要集中在调节多环节的代谢、细胞生长、器官发育有关的功能和通路上。电针后甲状腺激素信号通路上的某些circRNA(MED13、MED13L、NCOA2、PIK3CB、SLC16A10)表达上调,而某些circRNA(MED12L、PLCG2、PRKCA、TSC2)表达下调。2型糖尿病小鼠血浆外泌体circRNA表达谱发生变化,电针能通过引起代谢、细胞生长与发育等功能与通路发生变化而产生干预作用,尤其对甲状腺激素信号通路的调节非常活跃。
针刺疗法;糖尿病;电针;外泌体;circRNA;转录组测序;小鼠
糖尿病是一种由代谢系统紊乱引起的内分泌疾病,其中,2型糖尿病患者占到95%以上,其主要表现为胰岛素相对不足并伴随有胰岛素抵抗。糖尿病同时作为一种慢性糖代谢障碍的疾病,常可发生一些严重并发症,对机体心脑血管、神经系统、泌尿系统等均有严重的破坏,如糖尿病肾病、糖尿病眼病、心血管系统病变等,严重危害人类的生命与健康[1]。国际糖尿病联盟估计2015年全球大约有4.15亿糖尿病患者[2],若不采取措施,预计到2040年这一数字将增加到6.42亿。由于糖尿病目前病因还未明确,发病机理复杂,尚无根治药物。针灸疗法在临床上治疗糖尿病及各种糖尿病并发症中具有良好疗效[3-4],但其作用机制尚不清楚。
外泌体是囊泡传输系统中的研究热点,其是细胞通过胞吐作用分泌的膜性囊泡样小体,直径为30~100 nm,主要是由细胞内多泡体与细胞膜融合并释放到细胞外基质中的膜囊泡,后者在电镜下表现为脂质双层包裹的扁平球体,呈特征性的杯状外形。外泌体可稳定存在于细胞外液中。目前认为,几乎所有的真核细胞,包括一些微生物都可以产生外泌体[5]。随着对外泌体认识的加深,人们发现源自细胞多泡体的外泌体可以携带很多特定信息进行体内长距离运输,它们能转移很多生物分子(如DNA片段、circRNA、mRNA、miRNA、功能蛋白、转录因子等),从而达到细胞间信息传递的目的,而其本身的膜结构还能表达多种抗原、抗体分子,从而参与多种生理、病理过程[6-7]。目前已有最新研究将外泌体引入糖尿病的研究领域以期为该领域带来新的突破[8]。circRNA是一种新的明星分子,它以不同的大小和来源形成共价闭合环,代表了动物中一类丰富、稳定且广泛存在的RNA分子。它在生物过程中具有重要的作用,如作为miRNA海绵(sponge)、RNA结合蛋白、mRNA“磁铁”以指导蛋白质翻译[9]。
转录组测序(RNA sequencing, RNA-seq),是指利用二代高通量测序技术将RNA反转录为cDNA进行测序,可全面、快速地对某一组织或器官在某一状态下的几乎所有RNA进行检测分析[10]。利用RNA-seq对血浆外泌体内的基因表达进行定量和定性研究,可揭示2型糖尿病的分子机制,为该病的预防和治疗提供科学依据,因此被誉为转录组学发展的革命性技术[11-12]。
本研究应用RNA-seq技术,研究电针对2型糖尿病小鼠血浆外泌体circRNA表达和信号通路的影响,为电针治疗2型糖尿病小鼠的可能作用机制提供实验依据。
1 材料与方法
1.1 实验动物及分组
30只雄性SPF级C57BL/6小鼠,体质量为(18±2)g,由上海交通大学附属第一人民医院动物实验中心提供[实验动物许可证号SCXK(沪)2003-0003]。所有实验动物在相同标准环境(GB14925-2001)下饲养与实验,予以自然照明、饮水和饮食,室温保持在(25±2)℃,湿度保持在(55±5)%,每日保持12 h的昼夜循环。所有动物先适应性喂养l周,然后采用查随机数字表法将小鼠分为正常组、模型组和电针组,每组10只。此外,所有实验方法均经上海交通大学附属第一人民医院动物伦理委员会通过。
1.2 主要试剂及仪器
链脲佐菌素(strepto zotocin, STZ,美国Sigma公司);柠檬酸及柠檬酸钠(国药集团上海试剂公司);基础饲料(购于上海市第一人民医院动物养殖中心);高脂饲料(购于中国上海福贝世亨生物医药有限公司,配方为酪蛋白22.8%,糊精17%,DL-甲硫氨酸0.2%,矿物质4%,碳酸氢钠10.5%,维生素1%,重酒酸胆碱0.2%,蔗糖17.5%,豆油2.5%,氢化椰子油33.35%,柠檬酸钾0.4%)。
强生稳豪血糖仪和血糖试纸(美国强生公司,批号4174080);电子天平(JA2003N,上海精密科学仪器有限公司);低频脉冲治疗仪(G6805-2,上海医疗器械高技术公司);一次性针灸针(0.22 mm×13 mm,北京中研太和医疗器械有限公司,批号222170617)。
1.3 造模方法
模型组和电针组小鼠用上述高脂饲料喂养6周后,于第6周最后一天称取小鼠体质量,按100 mg/kg的剂量注射浓度为1%的STZ-柠檬酸钠(0.1 mol/L,pH值7.2)缓冲液,给药结束后1周内,监测随机及空腹血糖,若随机血糖≤16.8 mmol/L或空腹血糖≤11.1 mmol/L,则认定为造模不成功,进行二次给药,按150 mg/kg的剂量注射STZ。
1.4 治疗方法
电针组自高脂饮食4周后开始进行电针治疗。取双侧足三里、脾俞穴。75%乙醇棉球常规消毒后,采用0.22 mm×13 mm毫针进行针刺,得气后连接低频脉冲治疗仪,采用断续波形,频率为2 Hz,强度为1~3 mA,串长为30 s,每5 min递增1次,持续15 min,以局部肌肉轻微抖动为度。隔日1次,每周3次,连续治疗4周,共计12次。
1.5 观察指标
1.5.1 空腹血糖
各组分别于造模前、造模后及治疗结束后检测空腹血糖。小鼠禁食不断水16 h后,用眼科剪剪去鼠尾尖端,挤压出血,将血液注满血糖仪试纸的测试孔,5 s后读取血糖值并记录。为防止感染,测试后第2天于鼠尾伤口处擦拭金霉素眼药膏(中国新乡华青药业公司)。
1.5.2 血浆外泌体提取及鉴定
1.5.2.1 血浆外泌体的提取
用采血针和抗凝管(含EDTA)抽取小鼠全血后轻柔混匀,并于4℃条件下,1900 x离心10 min,小心取上清,3000 x离心15 min,吸取上清,冻存于﹣80℃后,500 x离心10 min,吸取上清,再次以20000 x离心20 min,吸取上清,100000 x离心70 min,用PBS缓冲液冲洗底部外泌体后,再次以100000 x离心70 min,此时沉淀在底部的团块即为血浆外泌体。
1.5.2.2 血浆外泌体的鉴定
①Western blot检测血浆外泌体标记蛋白,取血浆外泌体蛋白用于BCA蛋白浓度测定试剂盒测定蛋白浓度,经灌胶、电泳、转印蛋白后,在孵育袋中加入TBST稀释的一抗CD63(1:1000)、CD9(1:2000)和TSG101(1:3000),4℃孵育过夜,漂洗后二抗(1:2000)孵育2 h后,洗膜,感光、显影、定影。②透射电镜观察外泌体形态特征,先行血浆外泌体样品处理,选择标本的最佳浓度(1 mg/mL)放置到一个300目Formvar膜铜网中,红外灯下固定30 min,用滤纸小心吸掉未粘附在铜网的样品,然后放置在2.5%的戊二醛磷酸缓冲15 min,再用PBS和蒸馏水分别冲洗2遍后,使用磷钨酸悬滴进行负染,上样观察。
1.5.2.3 血浆外泌体RNA提取
血浆外泌体收集完成后,加入1 mL的Trizol,吹打混匀后冰上静置5 min;然后加入氯仿200mL,充分震荡30 s后冰上静置15 min分层;4℃,13500 x离心10 min;将上层的无色水样层转移至新的无酶离心管;加入与水样层等体积的预冷的异丙醇,颠倒混匀后室温静置10 min;4℃,13500 x离心10 min;弃上清后加入体积分数75%的乙醇清洗2遍,弃上清,静置15 min待乙醇挥发;加入无酶水20mL,﹣80℃保存待用。使用NanoDrop ND-1000仪[赛默飞世尔科技(中国)有限公司]测量每个样品的RNA浓度。以OD260/OD280值作为RNA纯度指标。使用变性琼脂糖凝胶电泳测量RNA完整性和gDNA污染。使用Agilent 2100 Bioanalyzer仪器检测文库质量。
1.5.2.4 RNA文库的制备及测序
使用Ribo-Zero rRNA Removal Kits(美国Illumina公司)移除总RNA中的rRNAs。使用TruSeq Stranded Total RNA Library Prep Kit(美国Illumnia公司)预处理RNA,构建测序文库。使用BioAnalyzer 2100仪器(美国Agilent Technologies公司)进行文库质控和定量。根据Illumnia测序说明,将10 pM文库变性为单链DNA分子,在Illumnia flowcell上捕获,原位扩增为簇(cluster),并在Illumnia HiSeq测序仪上采用双端模式(PE mode)进行150 cycle测序。文库的构建与测序由中国上海云序生物科技有限公司完成。
1.5.2.5 测序数据分析
经过Illumnia HiSeq 4000测序仪测序,收获双端reads。使用cutadapt(v1.9.3)软件[13]去接头,去低质量reads,获得高质量reads。使用STAR软件[14]将高质量reads比对到参考基因组/转录组上,使用DCC软件进行circRNA检测和鉴定[15]。使用circBase数据库对所鉴定的环状RNA进行注释[16]。使用总比对reads数进行标准化,并进行差异环状RNAs来源基因的GO和KEGG分析。
1.5.2.6 差异表达基因的qRT-PCR验证
为了验证RNA-seq的准确性,随机选择10个差异表达基因进行qRT-PCR验证,引物序列见表1。RNA提取完成后用Gene Amp PCR System 9700(Applied Biosystems)将RNA逆转录为cDNA通过qPCR SYBR Green master Mix进行扩增,反应体系为10mL,反应程序具体为95℃,10 min;95℃,10 s;60℃,1 min;95℃, 15 s;60℃缓慢加热至99℃(仪器自动进行-Ramp Rate为0.05℃/s);共40个循环。以GAPDH为内参,通过 2-ΔΔCT法计算基因的相对表达水平。

表1 电针后小鼠血浆外泌体circRNA差异表达基因qRT-PCR引物序列
1.6 统计学方法
应用SPSS19.0软件对数据进行统计分析。符合正态分布的计量资料以均数±标准差表示,用重复测量资料方差分析;偏态分布资料用中位数()和四分位数间距(,)表示,组间比较用秩和检验。以<0.05为差异有统计学意义。
2 结果
2.1 一般情况
模型组和电针组造模后随机血糖>16.8 mmol/L有8只,空腹血糖>11.1 mmol/L有1只,造模成功率为45.0%;对11只小鼠进行二次造模,结果所有小鼠随机血糖>16.8 mmol/L,造模成功率为100.0%;死亡率为0%。高脂喂养后,模型组和电针组小鼠体型发生变化,以中央型肥胖为主,且毛发变稀疏;在注射STZ后出现精神萎靡不振,活动明显减少,皮毛干燥粗糙并稀疏,尿量增多,饮水量亦明显增多。
2.2 各组不同时间点空腹血糖比较
经非参数检验,模型组和电针组造模后空腹血糖与正常组比较,差异均具有统计学意义(<0.01),提示STZ给药对小鼠胰岛破坏影响比较大。经方差分析,模型组和电针组治疗后空腹血糖与正常组比较,差异均具有统计学意义(<0.01);且电针组治疗后空腹血糖与模型组比较,差异具有统计学意义(<0.01),提示电针组改善空腹血糖优于模型组。详见表2。
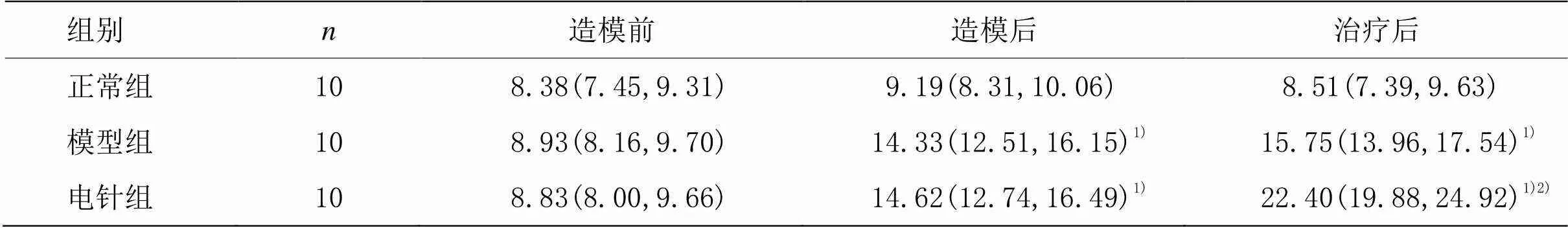
表2 各组不同时间点空腹血糖比较 [mmol/L,M(Q1,Q2)]
注:与正常组比较1)<0.01;与模型组比较2)<0.01
2.3 血浆外泌体的鉴定
采用Western blot检测血浆外泌体标记蛋白(见图1),图中CD9、TSG101和CD63均有明显条带,提示外泌体提取成功。
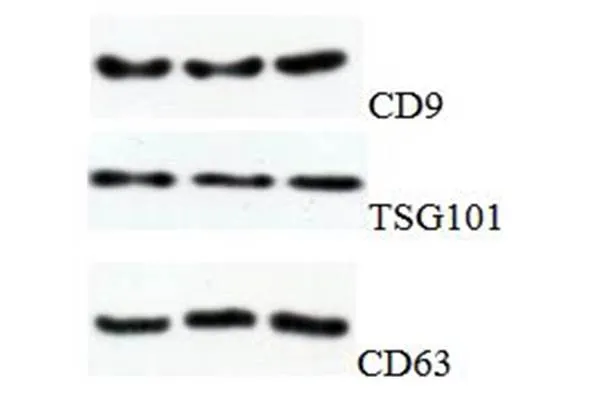
图1 小鼠血浆外泌体标记蛋白鉴定
样本悬液经磷钨酸悬滴负染,在透射电镜下(10~200×103倍)观察血浆外泌体形态特征(见图2),可见少量膜被囊泡,电子密度浅,直径50~100 nm,部分囊泡中央凹陷,符合外泌体形态特征。
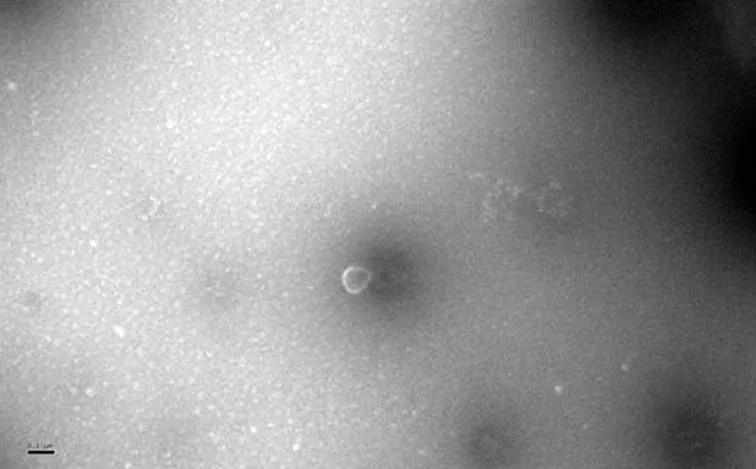
图2 小鼠血浆外泌体电镜下形态特征
2.4 Reads分析
经过图像识别和碱基识别后,从Illumina HiSeq测序仪上收获原始reads。使用cutadapt软件去接头,去低质量reads,获得高质量reads。使用STAR软件将clean reads比对到小鼠参考基因组(UCSC MM10)上,并以Ensembl转录组(v75)gtf文件为指导,使用DCC软件进行circRNA检测。测序产出数据质量显示,过滤后数据中的碱基数(clean reads)数据为5.5~6.5 G,错误率为0.01~0.02,Q30(碱基正确识别率为99.9%)>80%,G、C碱基含量在正常范围内。本研究的3组样品过滤后与参考基因组进行比对,比对到基因组上读段数的比例均高于78%(一般高于70%),比对到多位置的读段数比例均低于5%(一般低于10%),是后续分析内容的基础。与参考基因组比对的具体情况见表3。
2.5 circRNA差异表达基因筛选
与经典转录本相比,circRNA以环状剪接为主要特征。剪接reads的彻底鉴定促进了circRNA丰度的准确评估。在此,研究者以比对到的剪接读段(reads)数作为circRNA的表达水平。记录了每个样品中检测到的circRNA的连接读段(junction reads)数。使用edgeR默认的TMM方法,根据测序深度和变异程度对原始连接读段数进行标准化,并进行log2转化,得到logCPM值。利用标准化的读段数,计算两个或两组样品间的差异表达circRNA。计算倍数变化(fold change)和P-value。以倍数变化≥2.0、P-value≤0.05作为差异circRNA的阈值。
本研究共筛选到165个差异表达基因。模型组与正常组相比,该基因上调,而电针组该基因表达下调的基因为144个;模型组与正常组相比,该基因下调,而电针组该基因表达上调的基因为21个。将表达水平变化模式相同或相近的基因聚集成类,分析差异基因在不同组间的表达模式(见图3)。以上研究结果显示,电针对2型糖尿病小鼠血浆外泌体circRNA转录组表达水平有明显影响。
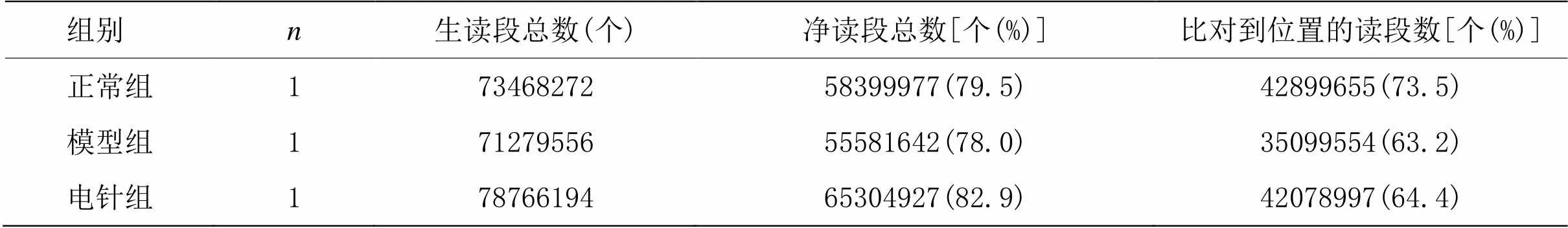
表3 RNA-seq测序参考序列比对情况
2.6 基因功能和信号通路富集分析
通过对模型组、电针组与正常组两两比较的基因功能富集分析,发现与电针作用有关的165个有差异的环状RNA基因(<0.05,假阳性率<0.05),主要包括基础代谢、细胞代谢、细胞大分子代谢、有机物质代谢、细胞生长、发育等相关功能。在信号通路分析中,发现111条有差异的信号通路,其中表达上调的信号通路主要包括甲状腺激素信号通路、鞘糖脂生物合成(神经节系列)通路、环磷酸鸟苷-蛋白激酶G(cGMP- PKG)信号通路、癌症转录误调控通路、癌症胆碱代谢通路、Rap1信号通路、肌动蛋白细胞骨架调控通路、腺苷酸激活蛋白激酶(AMPK)信号通路、脂肪细胞中脂细胞的调节通路等;表达下调的信号通路主要包括FcgR介导巨噬细胞吞噬作用信号转导通路、缺氧诱导因子HIF-1信号通路、磷脂酰肌醇信号系统通路、癌症胆碱代谢通路、赖氨酸降解通路、NOD样受体信号通路、mTOR信号通路、磷酸肌醇代谢通路、癌症蛋白聚糖通路等。前10位与电针调节2型糖尿病小鼠血浆外泌体circRNA基因功能和信号通路以及富集的基因见表4-7。

表4 电针后小鼠血浆外泌体circRNA差异表达基因的功能富集(表达上调)

表5 电针后小鼠血浆外泌体circRNA差异表达基因的功能富集(表达下调)

表6 电针后小鼠血浆外泌体circRNA差异表达基因的信号通路富集(表达上调)

表7 电针后小鼠血浆外泌体circRNA差异表达基因的信号通路富集(表达下调)

注:聚类分析图中黑色表示高表达基因,灰色表示低表达基因
2.7 qRT-PCR验证结果
对随机选取的10个差异基因进行qRT-PCR验证,结果显示,差异基因的相对表达量与RNA-seq检测结果趋势一致,验证了RNA-seq结果的可靠性。详见图4。
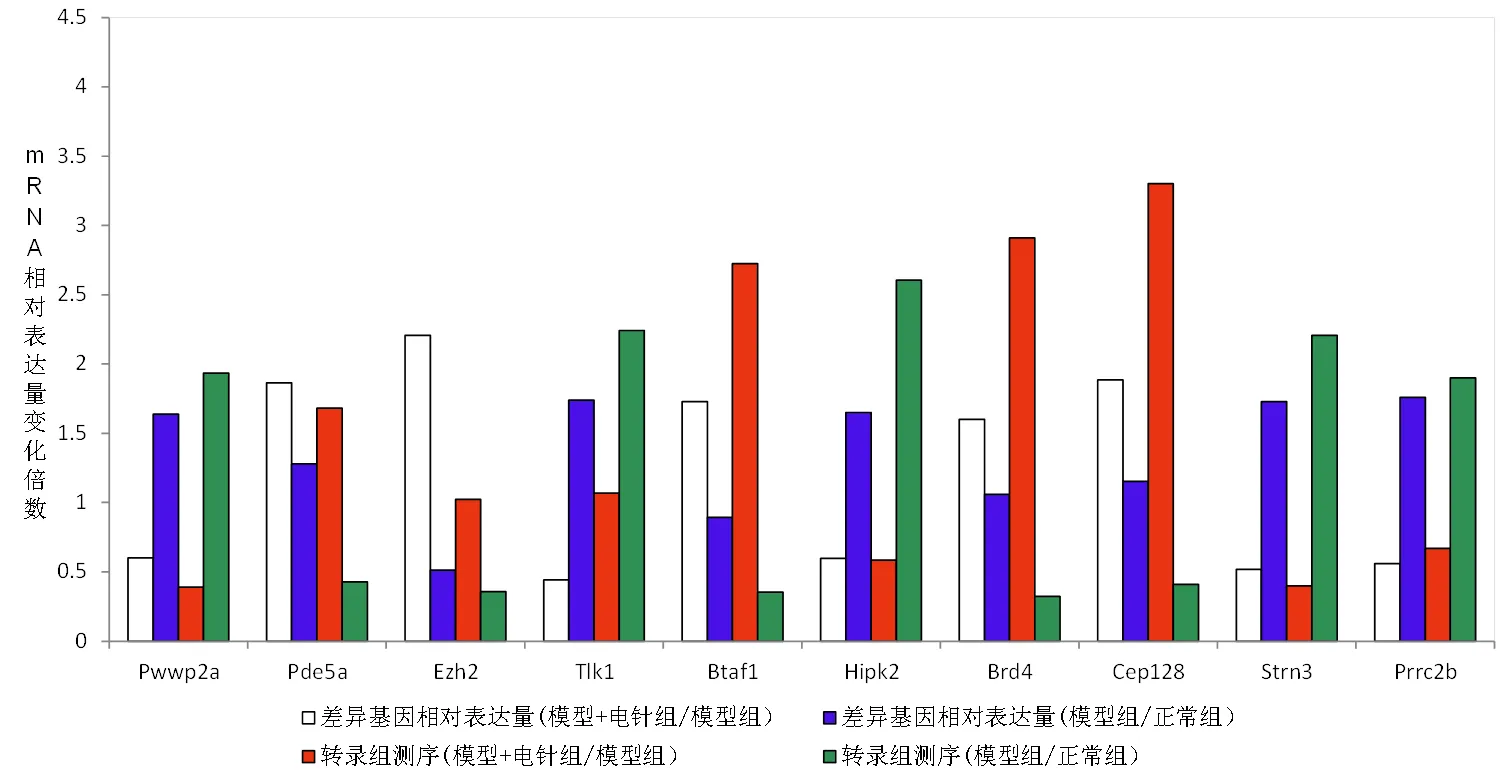
图4 电针后小鼠血浆外泌体circRNA差异表达基因的qRT-PCR验证
3 讨论
众所周知,胰岛素抵抗和b细胞功能缺陷是2型糖尿病的主要发病机制。近年来,实验研究表明,针灸可通过调整胰岛素抵抗、改善胰岛b细胞功能来治疗2型糖尿病。在动物实验中,针灸选穴绝大多数以足三里、脾俞、胃脘下俞、中脘等穴位为主[17-18]。本实验结果表明,造模成功后,小鼠空腹血糖明显升高,而治疗组治疗后空腹血糖相较模型组显著降低。说明电针对降低2型糖尿病小鼠空腹血糖具有一定的治疗作用,同前人的研究结果一致[18-20]。
RNA-seq结果显示,电针后共有165个circRNA表达有差异。通过对差异基因的功能和信号通路分析发现,电针对2型糖尿病小鼠的作用主要集中在调节多方面的代谢、细胞生长、器官发育有关的功能和通路上。其中表达上调的信号通路主要包括甲状腺激素信号通路、鞘糖脂生物合成(神经节系列)通路、cGMP-PKG信号通路、癌症转录误调控通路、癌症胆碱代谢通路、Rap1信号通路、肌动蛋白细胞骨架调控通路、AMPK信号通路、脂肪细胞中脂细胞的调节通路等;表达下调的信号通路主要包括FcgR介导巨噬细胞吞噬作用信号转导通路、缺氧诱导因子HIF-1信号通路、磷脂酰肌醇信号系统通路、癌症胆碱代谢通路、赖氨酸降解通路、NOD样受体信号通路、mTOR信号通路、磷酸肌醇(IP)代谢通路、癌症蛋白聚糖通路等。这些研究结果表明,电针对2型糖尿病的作用具有多环节、多层次、多水平的特点,调节血糖可能只是其中一个很小的方面,电针对于2型糖尿病还具有其他治疗作用,有待于进一步发掘。
有趣的是,在这些通路中,笔者发现甲状腺激素信号通路在电针对2型糖尿病的作用中表现十分活跃,既有表达上调的基因(MED13、MED13L、NCOA2、PIK3CB、SLC16A10),又有表达下调的基因(MED12L、PLCG2、PRKCA、TSC2)。这一结果表明,电针对甲状腺激素信号通路的调节非常显著。事实上,已有研究发现甲状腺功能亢进和甲状腺功能减退与2型糖尿病发生机制中的胰岛素抵抗存在着一定关联[21]。甲状腺激素具有较强的抗脂肪降解作用,故引起游离脂肪酸浓度升高,进而增强了葡萄糖的储存和氧化作用,且影响了胰岛素的分泌作用,阻碍了葡萄糖的糖代谢作用[22-23]。因此,本研究提示电针对2型糖尿病的作用可能通过对甲状腺激素的调节进而改善胰岛素抵抗从而产生对慢性高血糖的调节作用,这一推测有待通过进一步实验来证实。
通过本研究发现,造模后2型糖尿病小鼠血浆外泌体circRNA表达谱发生变化,电针能通过引起多环节的代谢、细胞生长与发育等功能与通路发生变化而产生干预作用。并且,电针对甲状腺激素信号通路的调节非常活跃。本研究既为电针作用机制的阐明提供新的研究切入点,又同时为寻找2型糖尿病的治疗新靶点提供参考。
[1] Bahartan K, Horman K, Gal A,. Assessing the Performance of a Noninvasive Glucose Monitor in People with Type 2 Diabetes with Different Demographic Profiles[J]., 2017:4393497.
[2] Ogurtsova K, da Rocha Fernandes JD, Huang Y,. IDF Diabetes Atlas: Global estimates for the prevalence of diabetes for 2015 and 2040[J]., 2017,128:40-50.
[3] 马国庆,叶婷,孙忠人.温针灸与常规针刺治疗阳虚寒凝、络脉瘀阻型糖尿病周围神经病变对比观察[J].中国针灸,2018,38(3):229-233.
[4] 王俊宝.针灸联合甲钴胺治疗糖尿病性周围神经病变的临床效果观察[J].临床合理用药,2018,11(2):28- 29.
[5] 贝毅桦,喻溥蛟,肖俊杰.小囊泡中的大学问——外泌体的前世今生[J].自然杂志,2017,39(3):191-200.
[6] van Niel G, D’Angelo G, Raposo,G. Shedding light on the cell biology of extracellular vesicles[J]., 2018,19(4):213-228.
[7] Trotta T, Panaro MA, Cianciulli A,. Microglia- derived extracellular vesicles in Alzheimer's Disease: A double-edged sword[J]., 2018,148: 184-192.
[8] Tao SC, Rui BY, Wang QY,. Extracellular vesicle- mimetic nanovesicles transport LncRNA-H19 as competing endogenous RNA for the treatment of diabetic wounds[J]., 2018,25(1):241-255.
[9] Xu T, Wu J, Han P,. Circular RNA expression profiles and features in human tissues: a study using RNA-seq data[J]., 2017,18(Suppl 6): 680.
[10] 曹萌,孙凤梅,尹立红,等.苯对C3H/He小鼠骨髓细胞转录组表达的影响:基于转录组测序技术[J].环境与职业医学,2017,34(7):577-585.
[11] Wang Z, Gerstein M, Snyder M. RNA-Seq: a revolutionary tool for transcriptomics[J]., 2009,10(1):57-63.
[12] Wu C, Bendriem RM, Garamszegi SP,. RNA sequencing in post-mortem human brains of neuropsychiatric disorders[J]., 2017,71(10):663-672.
[13] Ly P, Teitz LS, Kim DH,. Selective Y centromere inactivation triggers chromosome shattering in micronuclei and repair by non-homologous end joining[J]., 2017,19(1):68-75.
[14] Dobin A, Davis CA, Schlesinger F,. STAR: ultrafast universal RNA-seq aligner[J]., 2013,29 (1):15-21.
[15] Jakobi T, Czaja-Hasse LF, Reinhardt R,. Profiling and Validation of the Circular RNA Repertoire in Adult Murine Hearts[J]., 2016,14(4):216-223.
[16] Ma HB, Yao YN, Yu JJ,. Extensive profiling of circular RNAs and the potential regulatory role of circRNA-000284 in cell proliferation and invasion of cervical cancer via sponging miR-506[J]., 2018,10(2):592-604.
[17] Peplow PV, Baxter GD. Electroacupuncture for control of blood glucose in diabetes: literature review[J]., 2012,5(1):1-10.
[18] Cornejo-Garrido J, Becerril-Chávez F, Carlín-Vargas G,. Antihyperglycaemic effect of laser acupuncture treatment at BL20 in diabetic rats[J]., 2014,32(6):486-494.
[19] Jiang YL, Ning Y, Liu YY,. Effects of preventive acupuncture on streptozotocin-induced hyperglycemia in rats[J]., 2011,34(10):e355-361.
[20] Cao BY, Li R, Tian HH,. PI3K-GLUT4 Signal Pathway Associated with Effects of EX-B3 Electro- acupuncture on Hyperglycemia and Insulin Resistance of T2DM Rats[J]., 2016:7914387.
[21] Maratou E, Hadjidakis DJ, Kollias A,. Studies of insulin resistance in patients with clinical and subclinical hypothyroidism[J]., 2009,160(5): 785-790.
[22] van Tienhoven-Wind LJ, Dallinga-Thie GM, Dullaart RP. Higher Plasma ApoE Levels are Associated with Low-Normal Thyroid Function: Studies in Diabetic and Nondiabetic Subjects[J]., 2016,48(7): 462-467.
[23] Prats-Puig A, Sitjar C, Ribot R,. Relative hypoadiponectinemia, insulin resistance, and increased visceral fat in euthyroid prepubertal girls with low-normal serum free thyroxine[J].(), 2012,20(7):1455-1461.
Effect of Electroacupuncture on CircRNA Expression in Plasma Exocrine in Type 2 Diabetic Mice Based on Transcriptome Sequencing Technology
1,2,1,1,-1,1,-2,-2.
1.,201203,; 2.,,200080,
To study the effect of electroacupuncture on the expression of circular RNA (circRNA) in plasma exocrine and its signal pathway in type 2 diabetic mice based on transcriptome sequencing technology.Thirty C57BL/6 mice were randomized to normal, model and electroacupuncture groups, with 40 mice in each group. The model and electroacupuncture group received the injection of streptozocin (STZ) after a high-fat diet (HFD) feeding for 6 weeks, and the electroacupuncture group started electroacupuncture additionally after a HFD feeding for 4 weeks. Fasting blood glucose (FBG) in each group was detected. The plasma exosome was extracted by ultracentrifugation. The circRNA in plasma exosome was sequenced by RNA sequencing (RNA-seq) technology. Differential gene expression, gene function and signal pathway cluster were analyzed.Compared to the normal group, the FBG increased significantly after modeling in the model group (<0.01); compared to the model group, the FBG declined after the treatment in the electroacupuncture group (<0.01). RNA-seq results showed that a total of 165 circRNA expressions changed significantly after the treatment, 144 genes were down-regulated and 21 genes were up-regulated. The effect of electroacupuncture on type 2 diabetic mice mainly focused on the regulation of the functions and pathways related to multi-link metabolism, cell growth and organ development. Some circRNA expression (MED13, MED13L, NCOA2, PIK3CB and SLC16A10) in thyroid hormone signaling pathway was up-regulated after electroacupuncture, and some circRNA expression (MED12L, PLCG2, PRKCA and TSC2) were down-regulated.The circRNA expression profile changes in plasma exosome of type 2 diabetic mice. Electroacupuncture can interfere by regulating the functions and pathways related to metabolism, cell growth and development, and the regulation of thyroid hormone signaling pathway is very active.
Acupuncture therapy; Diabetes; Electroacupuncture; Plasma exocrine; Circular RNA;Transcriptome sequencing; Mice
1005-0957(2019)05-0565-09
R2-03
A
10.13460/j.issn.1005-0957.2019.05.0565
2018-12-03
国家自然科学基金面上项目(81373755);国家自然科学基金青年科学基金项目(81403470,81600611);上海市科学技术委员会科研计划中医引导类项目(17401932200);上海市第一人民医院院级课题(11B10)
寿崟(1984—),女,讲师,2016级博士生,Email:33359879@qq.com
徐平(1952—),女,教授,博士生导师,Email:xp99@163.com

