口服AdipoRon对2型糖尿病小鼠脾脏和胰腺功能的影响*
谢克俭, 黄 玲, 屈小虎, 李 雪, 王少杰, 肖 敏
(温州医科大学检验医学院、生命科学学院, 浙江 温州 325035)
2型糖尿病(type 2 diabetes melliters,T2DM)发病率逐年上升。据报道,全世界糖尿病患者已超过2亿,而且在未来20年内可能突破3亿[1]。T2DM是一种糖代谢紊乱的代谢性疾病,其发病机制主要分为:(1)胰岛β细胞功能受损导致胰岛素分泌缺失;(2)肝脏和肌肉组织对胰岛素的敏感性下降,对葡萄糖的摄取和利用发生障碍。2型糖尿病的临床特征主要是高血糖,发病原因复杂,常见因素有肥胖、缺乏锻炼和应激反应[2]。T2DM发展到后期,严重影响肾功能,可引发肾衰竭和其他并发症,严重影响患者的身体健康和生命安全。目前,该疾病的治疗方式是药物治疗(口服降糖药及胰岛素治疗)和非药物治疗(运动治疗和饮食治疗)[3]。T2DM仍然无法根治,临床上使用的药物只能相对控制血糖,所以开发新药是非常必要的。研究报道:脂联素(源于脂肪细胞)是一种脂肪细胞因子,脂联素能改善胰岛素抵抗,并且改正异常的糖脂代谢[4-5]。2013年,Okada-Iwabu M等发现AdipoRon(与脂联素作用相似的小分子化合物)能够降低2型糖尿病小鼠的胰岛抵抗,减弱脂肪组织炎症反应[6-7]。本课题组致力于研究AdipoRon,前期发现该小分子化合物能够促进骨骼肌细胞的胰岛素敏感性,减弱肝脏的氧化应激反应,降低2型糖尿病小鼠的胰岛素抵抗反应。本研究通过检测口服AdipoRon(50 mg/kg、20 mg/kg)对2型糖尿病小鼠胰腺和脾脏肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、胰岛素受体(insulin receptor,INSR)、胰岛素受体底物1(insulin receptor substrate 1,IRS-1)、脾脏系数,以及对胰腺磷酸化胰岛素受体底物1(phosphorylation insulin receptor substrate 1,p-IRS-1)和胰岛素(insulin)mRNA表达的影响,探讨AdipoRon对糖尿病小鼠脾脏和胰腺组织的保护作用机制,以期为临床治疗2型糖尿病提供新方案。
1 材料与方法
1.1 实验动物
SPF级雄性C57/BL6小鼠40只,体重(25.0~26.0)g,购自上海史莱克公司。
1.2 实验仪器
血糖测试仪A-3型(三诺),全自动生化分析仪(日本日立公司),小型台式高速冷冻离心机(Thermo),NanoDrop 2000核酸蛋白分析仪(Thermo),S1000TMThermal Cycler梯度PCR仪(Bio-Rad),CFX ConnectTM荧光定量PCR检测系(Bio-Rad)。
1.3 主要试剂
链脲佐菌素(STZ)、AdipoRon(购自上海恩美科技有限公司);Trizol(invitrogen),小鼠INSR、IRS-1和TNF-α的ELISA试剂盒(购自上海源叶生物科技有限公司);Insulin和actin primers(上海生工设计);PrimeScriptTM RT reagent Kit with gDNA Eraser(TakaRa);SYBR Green(Bio-Rad)。
1.4 模型制备及分组
40只SPF级雄性C57/BL6小鼠(由本院实验动物中心提供)体重25~26 g,随机分为正常对照组(NC)10只,造模组30只。造模组小鼠喂以高糖高脂饲料35 d后,每只小鼠在禁食12 h后腹腔注射链脲佐菌素40 mg/kg (临用前用0.1 mol/L柠檬酸钠缓冲液配成1% STZ、pH 4.2 的溶液),隔周再注射1次。注射后72 h取尾血测空腹血糖,血糖浓度≥11.6 mmol/L为糖尿病小鼠。造模成功小鼠随机分为糖尿病模型(DM)组、低剂量AdipoRon(DM+L)组、高剂量AdipoRon(DM+H)组,每组10只。
1.5 给药、标本采集及计算脾脏系数
使用去离子水溶解AdipoRon至终浓度1 mg/mL,DM+L组小鼠灌胃20 mg/kg AdipoRon,DM+H组小鼠灌胃50 mg/kg AdipoRon,NC、DM组则灌胃等体积去离子水,每日1次,共10日。末次干预后禁食12 h,称量小鼠体重。摘除眼球法取血液样本,3 500 r/min离心5 min,取上清,保存于4℃。取各组小鼠脾脏、胰腺。用电子天平称量小鼠脾脏质量,计算脾脏系数=脾脏质量(mg)/体重(g)。将部分胰腺放入对应编号的包埋盒中,以4%多聚甲醛溶液进行固定;剩余胰腺放入对应编号的冷冻管中,置-80℃冰箱中保存。
1.6 胰腺和脾脏INSR、IRS-1和TNF-α蛋白质含量测定
剪取30~50 mg的胰腺或脾脏(约绿豆大小),放于2 ml EP管中,加入800 μl PBS溶液,于8 000 r/min,4℃离心3 min,弃去PBS,反复清洗3次。每管样本加入500 μl RIPA裂解液,使用台式电动匀浆器研磨组织,13 000 r/min,4℃离心20 min,取上清至新的EP管中。采用BCA法测定上清蛋白质浓度,使用PBS将蛋白质浓度调至2 mg/ml。严格按照ELISA试剂盒说明书操作,测定胰腺和脾脏INSR、IRS-1和TNF-α蛋白质含量。
1.7 病理学观察
取各组4%多聚甲醛固定的胰腺标本,经梯度酒精脱水、二甲苯透明、浸蜡、石蜡包埋,切成4 μm厚切片,HE染色。用ECTIPSE 50I显微图像处理系统观察并采集图像,观察各组胰腺组织形态变化。
1.8 胰腺组织中p-IRS-1蛋白质水平测定
采用Western blot方法检测p-IRS-1蛋白质水平,使用Image J软件对各组条带进行灰度分析,各组样本灰度值比内参β-actin灰度值以相对量表示蛋白质量,使用SPSS 18.0软件进行统计学分析。
1.9 胰腺Insulin mRNA表达量测定
采用Trizol一步法提取小鼠胰腺总RNA,逆转录合成cDNA,操作严格遵照试剂盒说明书进行。用实时荧光定量PCR测定insulin mRNA表达量,以β-actin为内参。insulin mRNA上游引物序列 5’-GAC CCA GTA ACC ACC AGC CCT AAG T-3’,Insulin mRNA下游引物序列 5’-GAA CCA CAA AGG TGC TGC TTG AC-3’。严格按照荧光定量试剂盒操作,上机,扩增结果以△CT值表示,各组小鼠样本mRNA表达量以样本中β-actin的△Ct值为基准进行标准化计算,得到相对表达量,结果用2-△△Ct表示。
1.10 统计学处理
2 结果
2.1 各组胰腺INSR、IRS-1、TNF-α水平比较
与正常对照组比较,DM组、DM+H组、DM+L组小鼠胰腺TNF-α均升高,INSR和IRS-1水平均明显降低(P<0.05);与DM组比较,DM+H组、DM+L组小鼠胰腺TNF-α水平下降,INSR和IRS-1水平均明显升高(P<0.05);与DM+L组比较,DM+H组胰腺TNF-α水平明显下降,INSR和IRS-1水平均明显升高(P<0.05,表1)
NC: Normal control; DM: Diabetes model control; DM+L: Diabetes model control with low AdipoRon; DM+H: Diabetes model control with high AdipoRon
*P<0.05vsNC group;#P<0.05vsDM group;△P<0.05vsDM+L group
2.2 各组脾脏INSR、IRS1、TNF-α水平及脾脏系数的比较
与正常对照组比较,DM组、DM+H组、DM+L组小鼠脾脏TNF-α均明显升高,INSR、IRS-1水平和脾脏系数均明显降低(P<0.05);与DM组比较,DM+H组、DM+L组小鼠脾脏TNF-α下降,INSR、IRS-1水平和脾脏系数均明显升高(P<0.05);与DM+L组比较,DM+H组脾脏TNF-α明显下降,INSR和IRS-1水平均明显升高(P<0.05,表2)。
2.3 小鼠胰腺病理学观察
光镜检查正常对照组小鼠胰腺组织未见明显异常,细胞排列紧密、饱满、胰岛体积大;DM组小鼠胰腺细胞排列较为疏散、胰岛体积较小;DM+H组、DM+L组小鼠脾脏病理变化有不同程度减轻(图1)。

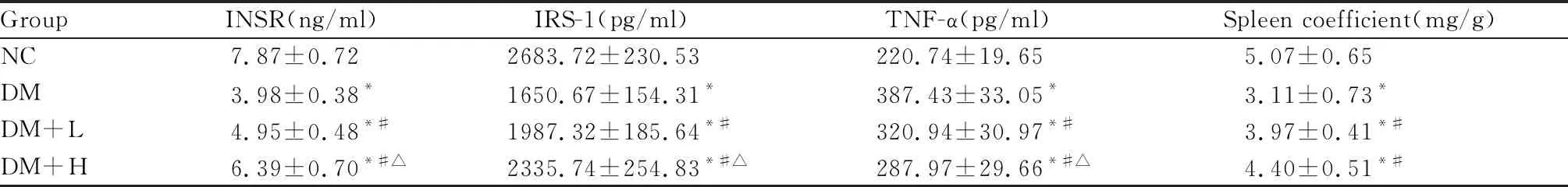
Group INSR(ng/ml) IRS-1(pg/ml)TNF-α(pg/ml)Spleen coefficient(mg/g)NC7.87±0.722683.72±230.53220.74±19.655.07±0.65DM3.98±0.38*1650.67±154.31*387.43±33.05*3.11±0.73*DM+L4.95±0.48*#1987.32±185.64*#320.94±30.97*#3.97±0.41*#DM+H6.39±0.70*#△2335.74±254.83*#△287.97±29.66*#△4.40±0.51*#
NC: Normal control; DM: Diabetes model control; DM+L: Diabetes model control with low AdipoRon; DM+H: Diabetes model control with high AdipoRon; INSR: Insulin receptor; IRS-1: Insulin substrate 1
*P<0.05vsNC group;#P<0.05vsDM group;△P<0.05vsDM+L group

Fig.1Comparison of hematoxylin-eosin (HE) staining on pancreas tissues in the four groups(×200)
NC: Normal control; DM: Diabetes model control; DM+L: Diabetes model control with low dipoRon; DM+H: Diabetes model control with high AdipoRon
2.4 各组胰腺组织中p-IRS-1蛋白质水平的比较
小鼠胰腺p-IRS-1蛋白质的免疫印迹灰度值统计分析结果显示,DM组小鼠p-IRS-1灰度值(0.54±0.05)明显低于NC组小鼠(1.42±0.15,P<0.01),DM+H组小鼠p-IRS-1灰度值(0.85±0.09)明显高于DM组小鼠(0.54±0.05,P<0.05),DM+L组小鼠p-IRS-1灰度值(0.70±0.06)与DM组小鼠(0.54±0.05)之间无显著性差异(P>0.05, 图2)。

Fig.2The comparison of p-IRS-1 level in pancreas among the four groups
NC: Normal control; DM: Diabetes model control; DM+L: Diabetes model control with low AdipoRon; DM+H: Diabetes model control with high AdipoRon; p-IRS-1: Phosphorylation insulin receptor substrate 1
**P<0.01vsNC group;#P<0.05vsDM group
2.5 各组胰腺组织Insulin mRNA表达的比较
对小鼠胰腺insulin mRNA表达量检测结果显示,DM组小鼠insulin mRNA相对表达量(0.54±0.06)较NC组小鼠(0.98±0.03)显著下降(P<0.01)。与DM组小鼠相比较,DM+H组小鼠insulin mRNA的相对表达量(0.87±0.08)均显著上升(P<0.05),DM+L组insulin mRNA的相对表达量(0.67±0.07)与DM组小鼠(0.54±0.06)无显著差异(图3)。
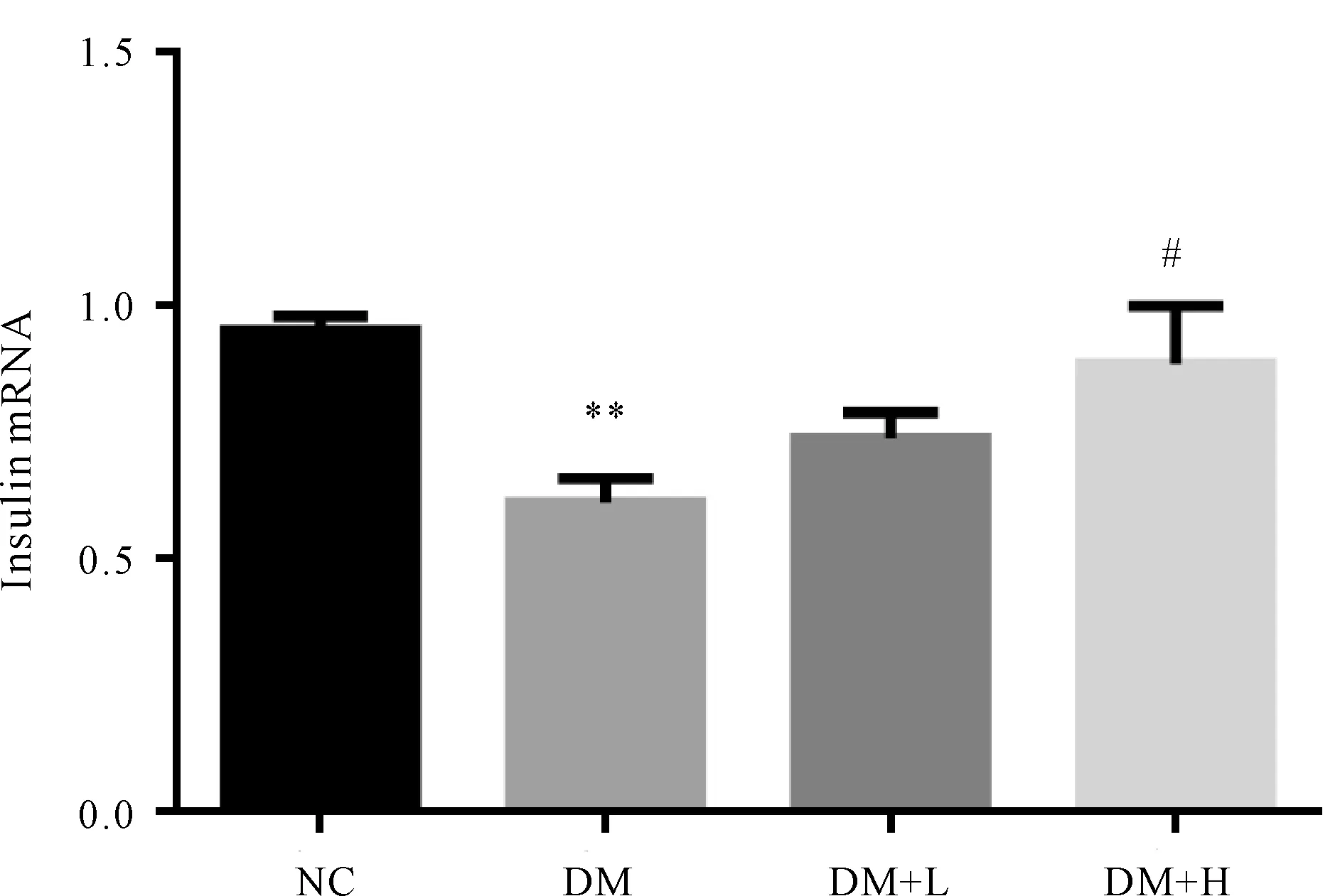
Fig.3Comparison of insulin expression in the tissues among four groups
NC: Normal control; DM: Diabetes model control; DM+L: Diabetes model control with low AdipoRon; DM+H: Diabetes model control with high AdipoRon
**P<0.01vsNC group;#P<0.05vsDM group
3 讨论
据文献报道,机体在高血糖和高游离脂肪酸刺激下会产生大量自由基,从而引起氧化应激,进而发生胰岛素抵抗、胰岛素分泌受损的情况。胰岛素抵抗可能先于糖尿病发生,当胰岛素抵抗增强时,血糖才开始升高;而高血糖则会加重氧化应激,同时也可能激活应激敏感信号通路,进一步加重胰岛素抵抗[8-9]。胰岛β细胞是氧化应激的靶点,胰岛β细胞内抗氧化酶活性下降到低水平时,氧化应激敏感性增强,进而损伤β细胞,促进细胞凋亡。同时,氧化应激可间接抑制β细胞功能(作用于胰岛素信号转导通路),使得机体内胰岛素分泌水平降低,血糖升高[10]。胰岛素受体(INSR)和磷酸化的胰岛素受体底物1(p-IRS-1)是胰岛素信号转导通路中的两个重要介质,在胰岛功能受损、胰岛素信号转导障碍、胰岛素抵抗和2型糖尿病的形成过程中发挥重要作用[11]。研究发现,肿瘤坏死因子(tumor necrosis factor α,TNF-α)可以使细胞摄取葡萄糖减少,导致以肌肉、脂肪组织的胰岛素受体自身磷酸化水平下降,胰岛素信号转导受到干扰,胰岛素的拮抗激素增多等多种方式来参与胰岛素抵抗,TNF-α被认为是观察胰岛素抵抗发生、发展及治疗效果的关键指标[11-12]。据报道,脂联素的作用为改善胰岛素抵抗,纠正糖脂代谢紊乱[4-5],同时可抑制TNF-α[6]。日本东京大学的研究人员认为,50 mg/kg AdipoRon能够激活AMPK受体,从而发挥其治疗作用[7]。本课题组前期实验探索表明,更低剂量的AdipoRon能增加细胞的耗糖量[13],故设计低剂量20 mg/kg和高剂量50 mg/kg药物组,选取高糖高脂饲料喂养并注射链脲佐菌素(STZ)诱导的2型糖尿病小鼠模型进行动物水平研究。此实验通过建立2型糖尿病小鼠模型,检测口服AdipoRon(50 mg/kg、20 mg/kg)对2型糖尿病小鼠胰腺和脾脏组织中INSR、IRS-1和TNF-α蛋白质含量,小鼠脾脏系数,胰腺组织中p-IRS-1蛋白和insulin mRNA表达水平的影响,旨在探讨AdipoRon对糖尿病小鼠脾脏和胰腺组织的保护作用及机制。
脾脏是机体的最重要的免疫器官,2型糖尿病会影响机体正常的免疫功能。而胰腺是机体负责消化液分泌和胰岛素分泌的重要器官。在本实验中,高糖高脂饲料喂养1个月加小剂量STZ(40 mg/kg)腹腔注射建立的糖尿病小鼠模型,断尾取血,空腹血糖均大于11.6 mmol/L,符合2型糖尿病的发病特点。形态学观察可见正常组小鼠胰腺组织细胞排列紧密、饱满、胰岛体积大;DM组小鼠胰腺组织细胞排列较为疏散、胰岛体积较小;口服AdipoRon组小鼠胰腺组织细胞基本紧密、饱满、胰岛体积略小,表明成功构建2型糖尿病小鼠模型。灌胃AdipoRon后发现:口服AdipoRon组小鼠胰腺和脾脏TNF-α含量明显下降,脾脏系数升高。结果提示:AdipoRon可能通过下调胰腺和脾脏TNF-α的表达,保护脾脏来调节机体自身免疫功能,进而抵御氧化应激对胰岛β细胞的损伤。与DM组比较,给予高剂量AdipoRon组小鼠胰腺和脾脏INSR和IRS-1水平均升高,胰腺p-IRS-1蛋白质水平和insulin mRNA表达均升高,均具有统计学意义(P<0.05)。结果提示:(1)AdipoRon可通过上调INSR和IRS-1的蛋白质表达水平,缓解糖尿病小鼠胰岛素信号转导障碍;(2)AdipoRon可通过上调胰腺p-IRS-1蛋白质水平和insulin mRNA的表达,对维持糖尿病小鼠胰岛β细胞正常功能有一定作用。口服AdipoRon通过下调糖尿病小鼠胰腺和脾脏TNF-α,上调INSR和IRS-1的蛋白质表达水平以及胰腺p-IRS-1蛋白,insulin mRNA的表达,对糖尿病小鼠脾脏和胰腺组织有一定的保护作用。
综上所述,本研究通过构建2型糖尿病小鼠模型,探讨胰腺及脾脏相关指标变化,证实AdipoRon对糖尿病小鼠胰腺和脾脏组织有一定的保护作用。

