大麻二酚对应激大鼠肺部损伤的预防保护作用
叶程龙,余伟,莫斯喻,任建辉,赵春鹤,臧林泉
(广东药科大学药学院,广东 广州 510006)
应激反应是由各种应激源引起的个体非特异性反应,处于应激状态下的神经内分泌系统主要依赖于肾素-血管紧张素系统和下丘脑-垂体-肾上腺轴(HPA轴)的激活。有研究报道发现急性应激障碍大鼠脑组织产生过多自由基产生脑损害[1],动物实验证明:在较为强烈的急性应激环境下大鼠肺部会出现一定程度的损伤,这可能是源于HPA轴的过度持续激活导致外周激素的分泌紊乱。大麻二酚(cannabidiol,CBD)是提取自植物大麻的一种化学成分,它和四氢大麻酚(THC)是自大麻植物中分离得到含量最高的2种大麻素[2]。CBD和THC在神经系统保护、抗炎抗氧化以及抗肿瘤方面具有很大的药用价值,所不同的是CBD并没有THC的致幻成瘾作用[3]。研究发现CBD可有效调控神经细胞的凋亡和调控星形胶质细胞的功能障碍降低脑受损功能,对于缓解抑郁和社交焦虑障碍也有一定作用[4],这表明CBD可能具备一定的抗应激能力,但未见相关文献报道。本研究旨在探讨应激大鼠给药后血清中CORT及肺损伤相关炎症因子TNF-α及IL-1β含量变化及CBD对应激大鼠的肺损伤的干预保护作用。
1 材料与方法
1.1 实验动物和主要试剂
健康雄性8周龄SD大鼠40只,体质量180~200 g,购自广东省医学实验动物中心,生产许可证号:SCXK(粤)2013-0002。
CBD购自广州合诚化学有限公司(批号:HS-180554);TNF-α、IL-1β、CORT的ELISA检测试剂盒购自上海酶联生物科技有限公司(批号:12/2018);OCT包埋剂购自美国Sakura公司;黏附载玻片购自江苏世泰实验器材有限公司;一次性病理刀片购自德国莱卡公司。
1.2 动物模型的建立与分组
将40只雄性SD大鼠随机分成5组并按预实验结果设置以下剂量:正常对照组(NS,10 mL/kg)、模型对照组(NS,10 mL/kg),低、中、高剂量CBD组(CBD,12 mg/kg、36 mg/kg、108 mg/kg),每组8只。采取灌胃给药的方式,各组大鼠在造模前3天开始每日早晚2次灌胃给药,最后一次给药结束后,除正常对照组外其他组大鼠均采用固定四肢的方式束缚于鼠板,置于20 ℃冷水中进行48 h的水浸束缚应激,中途短暂解绑休息并使其自由饮水。应激结束后对各组大鼠进行麻醉,然后腹主动脉取血,处死后解剖留取肺组织于-80 ℃超低温冰箱内保存。
1.3 肺脏器系数和肺组织湿/干质量(W/D)比值的测定
解剖前使用电子秤称量大鼠体质量。解剖后取大鼠完整肺组织,稍微吸干表面血液后于分析天平称量全肺质量,按脏器系数=脏器质量/体质量×100%公式计算各组大鼠脏器系数。再取大鼠右肺上叶于分析天平称量湿质量,将其置于60 ℃烘箱内烘烤72 h后取出称量其干质量,计算湿/干质量比值(wet/dry weight ratio)。
1.4 组织病理学方法检测肺组织形态学变化
按上述方法称肺全质量后,取左肺于4%(φ)多聚甲醛内固定24 h后按常规方法制作肺组织病理切片,HE染色后于光学显微镜下观察组织病理学变化。
1.5 ELISA法检测血清中CORT、TNF-α、IL-1β水平
大鼠麻醉后腹主动脉取血,室温下自然放置血液凝固30 min,4 ℃冷冻离心20 min(3 000 r/min)。仔细吸取上清,-20 ℃低温保存备用。
用酶联免疫吸附法(ELISA)测定大鼠血清中肿瘤坏死因子α(Tumor necrosis factor alpha,TNF-α)、白细胞介素1β(Interleukin-1β,IL-1β)、皮质酮(Corticosterone,CORT)含量,严格按照ELISA试剂盒说明书操作。
1.6 统计学处理
2 结果
2.1 各组大鼠肺脏器系数及肺组织W/D比较
实验结果表明:模型组肺脏器系数和W/D都明显高于正常组(P<0.01)。CBD中、高剂量给药组肺脏器系数和W/D值与模型组相比都显著降低(P<0.01),且呈剂量依赖性。见表1。
2.2 各组大鼠肺组织病理形态学比较
由HE染色结果可以看出:正常组大鼠肺组织结构、形态正常;模型组肺组织肺泡壁增厚,肺泡间隙变大,肺泡结构出现坍塌并伴有部分炎性细胞浸润。与模型组相比,CBD各剂量给药组肺组织结构的破坏和水肿程度都有减轻,且呈剂量依赖性。各组大鼠肺组织HE染色情况如图1所示。
2.3 各组大鼠血清中CORT、TNF-α、IL-1β含量比较
ELISA结果表明:模型组大鼠相较于正常组大鼠,血清中CORT、TNF-α及IL-1β浓度显著升高。与模型组比较,高剂量CBD给药组血清中CORT含量显著下降(P<0.01),中、高剂量CBD给药组血清中TNF-α及IL-1β含量显著下降(P<0.05或P<0.01)且下降程度呈剂量依赖性。各组大鼠CORT、TNF-α、IL-1β血清含量详见表2。
表1各组大鼠脏器系数及W/D
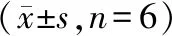
组别剂量/(mg·kg-1) 肺脏器系数/%W/D正常组- 1.395±0.067 4.533±0.339模型组- 1.518±0.053## 6.365±0.413##CBD 低剂量组121.438±0.0906.179±0.402 中剂量组36 1.421±0.051∗∗ 5.860±0.222∗∗ 高剂量组 108 1.397±0.053∗∗ 4.896±0.425∗∗
与正常组比较:##P<0.01; 与模型组比较:**P<0.01。

A.正常组; B.模型组; C.CBD低剂量组; D.CBD中剂量组; E.CBD高剂量组。
与正常组比较:##P<0.01; 与模型组比较:*P<0.05,**P<0.01。
3 讨论
应激是动物应对突变的外界状况而产生的一种情绪心理状态,也是当生物受到外界情况的变化时生物体对刺激的持续反馈状态,这些刺激可以是物理性的、躯体的,也可以是社会性的、心理的。处于应激状态下的神经内分泌系统主要依赖于肾素-血管紧张素系统和下丘脑-垂体-肾上腺轴(HPA轴)的激活,HPA轴主要分泌的促肾上腺皮质激素(ACTH)和CORT的水平变化常常被认为是判断应激程度的指标[5]。在较为强烈的应激源如剧烈的精神刺激或持续困境的作用下,HPA轴的持续激活会导致血中皮质酮浓度持续处于高水平状态从而打破原有的负反馈调节系统,这将严重影响机体器官组织的正常运作。在本实验中选择使用冷水浸泡束缚大鼠的方法意在通过创造一个对大鼠窘迫的生存困境,诱使其持续产生较为强烈的急性应激障碍,以模拟现代人群面对重大突发情况如失独或灾难等产生的心理应激状态。本研究发现在应激实验初期大鼠会产生类似过度通气的情况,在经过一段时间后的持续应激后其肺部会出现一定的肺充血现象和少量出血点,病理学切片检测发现较长时间的应激会使得大鼠肺脏局部出现较为明显的病理学变化。
近年来,欧美国家对具有非精神活性成分的大麻提取物CBD的药理研究和药物开发应用得到了较大的进展,CBD纯品的制剂已经被用于治疗多发性硬化症和儿童发作性癫痫[7]。研究发现CBD有一定的抗炎抗氧化作用,Ribeiro等[8]证实单剂量的CBD对脂多糖诱导的急性肺损伤和急性呼吸窘迫综合征有一定的保护作用。近年来有研究表明大脑中的糖皮质激素和大麻素受体系统被认为是治疗压力相关疾病的关键[9],同时CBD还可有效调控神经细胞的凋亡和调控星形胶质细胞的功能障碍降低脑受损功能,能一定程度缓解社交焦虑障碍和抑郁[10]。目前国内外对CBD的研究大多数集中在癫痫等中枢性疾病,本研究发现CBD可以有效降低应激大鼠外周血中CORT、TNF-α及IL-1β水平,该作用目前未见文献报道,这提示CBD对压力应激的调节作用同时体现在中枢和外周两方面。
本研究结果显示,模型组大鼠血清中CORT、TNF-α和IL-1β含量都相比正常对照组升高且差异有统计学意义,而CBD高剂量组的血清学指标则相对模型组有显著性下降,这说明高剂量的CBD对大鼠急性应激有明显的对抗作用。同时,在给予不同剂量的CBD后组织病理学切片结果显示CBD高剂量组相比模型组,其肺泡壁无明显增厚且炎症细胞浸润程度明显降低,这说明CBD对应激大鼠的肺部具有保护作用。
综上所述,可初步明确CBD对应激大鼠的肺部损伤有一定的改善作用,尤其以高剂量更为显著,其机制可能是通过抑制了HPA轴的激活导致外周CORT分泌的减少,进一步下调了血清TNF-α和IL-1β的表达,从而减弱肺部炎症信号间的传导间接减少氧化应激对肺部的损伤。从上述实验可推断CBD可能是急性应激障碍所致肺损伤的潜在治疗手段,因此有必要进一步对CBD的外周应激相关靶点进行更深入的分子机制研究。

