肉雏鹅源多杀性巴氏杆菌分离鉴定与致病性试验
刘 燕
(河南农业职业学院牧业工程学院,河南 中牟 451450)
多杀性巴氏杆菌(Pm)是畜禽养殖中常见病原菌之一,该菌可以感染多种动物及人,动物感染后可以引起禽霍乱、猪肺疫和牛出血性败血症等多种疾病[1]。鹅巴氏杆菌病该病由多杀性巴氏杆菌引起的一种急性、高度接触性、败血性传染病,又称鹅霍乱,该病可以感染不同日龄的鹅,尤其对雏鹅较易感,多数呈急性败血症型,具有发病急、死亡快特点,发病率高达35%以上,死亡率高达70%以上,当与其他疾病混合感染后,其死亡更高,该病成为养鹅业主要传染性疾病之一,严重影响着我国养鹅业发展[2-4]。目前,对多杀性巴氏杆菌没有有效的疫苗进行预防,主要使用抗菌药物进行预防与治疗,在养殖过程中由于抗菌药物的不合理使用,多杀性巴氏杆菌多重耐药越来越严重,应引起重视。
2018年9月,中牟地区某一肉鹅规模化养殖场,14日龄肉雏鹅出现呼吸困难、腹泻、个别呈现急性死亡。无菌采集病死肉雏鹅心血、肺脏、肝脏等病料组织中分离到1株病原菌,被鉴定为多杀性巴氏杆菌,本试验对分离的多杀性巴氏杆菌进行血清型鉴定、致病性检测及耐药性分析,为该病的防治提供参考依据。
1 材料与方法
1.1 病料来源 中牟地区某一肉鹅规模化养殖场,14日龄肉雏鹅出现呼吸困难、腹泻、个别呈现急性死亡。无菌采集病死肉雏鹅心血、肺脏、肝脏等病料组织。
1.2 主要试剂与仪器 MH琼脂培养基、普通营养肉汤,均购自北京陆桥生化试剂有限公司;美兰染色液试剂盒,购自青岛海博生物技术有限公司;ID32E肠道菌鉴定试条,购自bioMerieuxsa公司;小牛血清,购自四季青公司;药敏纸片,购自北京天坛药物生物技术开发公司;DL-2-000 Marker,购自北京中科瑞泰生物有限公司;2×Taq Marker Mix,购自北京康为世纪生物科技有限公司;全自动细菌生化鉴定系统(VITEK2型)由法国生物梅里埃公司生产;隔水式恒温培养箱由上海恒科学仪器有限公司生产;7%绵羊脱纤血液琼脂培养基由本实验自制由本实验提供。
1.3 实验动物 1日龄健康肉雏鹅60只,中牟地区某一肉鹅规模化养殖场提供,在河南农业职业学院牧业工程学院实习基地养殖至14日龄进行试验。
1.4 细菌分离与培养 采集病死肉雏鹅心血、肺脏、肝脏等病料组织无菌条件下接种于7%绵羊脱纤血液琼脂培养,37℃恒温培养12~18 h,选取单个优势菌落接种划含有10%小牛血清的普通培养基培养后,挑取单个的优势菌落接种在含10%小牛血清营养肉汤中纯化培养,取纯化培养的分离菌株进行美蓝染色镜检。
1.5 细菌的生化特性试验 取纯化培养的分离菌株,通过比浊法调整菌液浓度为0.5个麦氏浊度,按照说明加到ID32E肠道菌鉴定试剂条中进行培养,用全自动细菌生化鉴定系统对分离菌株进行生化试验。
1.6 细菌的PCR鉴定与测序 参考文献[5],根据多杀性巴氏杆菌基因序列设计特异性引物Kmt:P1 5′-ATCCGCTATTTACCCAGTGG-3′,P2 5′-GCTGTAAACGAACTGCCAC-3′由上海生工生化有限公司合成;预期扩增片段大小为457 bp。采用水煮法提取分离菌株的基因组DNA,以提取的基因组DNA为模板,多杀性巴氏杆特异性引物经行PCR鉴定。PCR扩增反应体系(50 μL):2 × Taq Marker Mix 25 μL,上、下游引物各 2 μL,DNA 模板 2 μL,ddH2O 19 μL。反应条件:94℃预变性5 min;94℃变性50 s,59.5℃退火50 s,72℃延伸50 s,72℃中延伸10 min,共30个循环。将目的基因片段回收并送生工生物工程(上海)股份有限公司进行序列测定,测序结果与Gen-Bank数据库中登录参考基因序列进行同源性比较。
1.7 细菌致病性试验 参考文献[6]设计致病性试验,并计算LD50。选择体重相近健康肉雏鹅60只随机分成6组,每组10只,1~5组的每只试验肉鹅腹腔注射分离菌株菌液0.2 mL,1~4组腹腔注射分离菌株菌液浓度分别为1.0×104CFU/mL、1.0×105CFU/mL、1.0 × 106CFU/mL、1.0 × 107CFU/mL、1.0×108CFU/mL,6组为空白对照组给予等量的无菌的生理盐水,攻毒12 h后观察7 d,并记录每个试验组肉鹅发病情况及死亡数据,对死亡的试验鹅鸭进行细菌学鉴定,用改良寇氏法计算分离菌株的LD50。
1.8 细菌的血清型鉴定 参考文献[7],设计多杀性巴氏杆血清型基因序列设计引物(表1),由上海生工生化有限公司合成,以提取的基因组DNA为模板,用PCR方法鉴定多杀性巴氏杆血清型。

表1 多杀性巴氏杆血清型引物序列设计
1.9 药敏试验 药敏试验按照美国临床检验标准委员会(NCCLS)推荐的标准K-B纸片法进行操作和结果判断[8]。
2 结果分析
2.1 细菌分离与培养结果 分离菌株7%的绵羊脱纤血液琼脂培养基长出灰白色的、圆形的、湿润的、均匀一致的露珠样小菌落;在含10%小牛血清普通营养琼脂上可见灰白色、圆形的菌落,在不含10%小牛血清普通营养琼脂生长贫瘠。美兰染色镜检可见分离菌株呈卵圆形,中央不易着色两极浓染球杆菌(见图1)。

图1 分离菌美蓝染色镜检结果 (1 000×)
2.2 细菌的生化鉴定结果 分离菌株分解葡萄糖、果糖、单奶糖、蔗糖和甘露糖,产酸不产气;可产生硫化氢,能形成靛基质,MR和V-P试验均为阴性;接触酶和氧化酶试验均为阳性。经全自动细菌生化鉴定系统检测分析,鉴定结果为多杀性巴氏杆菌,结果见表2,评定结果合格率为100.0%。

表1 生化试验鉴定结果
2.3 细菌的PCR鉴定与测序 用多杀性巴氏杆菌特异性引物对分离菌株Kmt 2基因PCR扩增出大约为457 bp左右的的目的条带,与报道的一致(见图2)。将分离菌株的测序结果进行拼接后与GenBank中登录的多杀性巴氏杆菌基因序列同源性在98.9%~100%之间,因此,分离菌株被鉴定为多杀性巴氏杆菌。

图2 分离菌株Kmt基因PCR鉴定结果
2.4 细菌致病性试验结果 1-5组试验试验肉鹅在攻毒后的24 h~96 h,出现不同程度死亡,对死亡的试验肉鹅进行细菌学鉴定,在死亡的试验肉鹅体内分离到了大肠杆菌菌,直到试验结束(7d),对照组试验肉鹅健康存活,1-5组死亡率分别为40%、70%、90%、100%、100%。用改良寇氏法计算致病性多杀性巴氏杆菌的LD50为5.86×106CFU/mL。
1.5 细菌的血清型鉴定结果 用多杀性巴氏杆菌血清型引物对分离菌血清型进行PCR检测,分离菌株扩增出A血清型大约为1058 bp左右的的目条带(图3),测序结果与与GenBank DNA序列数据库中已发表的多杀性巴氏杆菌荚膜A型菌株参考菌株同源性为99.9%,分离菌为多杀性巴氏杆菌荚膜型A型。

图3 多杀性巴氏杆菌血清型PCR鉴定结果
2.5 药敏试验结果 由表2可知,从肉雏鹅体内分离到的致病性多杀性巴氏杆菌对头孢曲松、头孢噻呋、强力霉素、恩诺沙星、环丙沙星、林可霉素6种药物高度敏感;对新霉素、庆大霉素、氟苯尼考、丁胺卡那霉素、大观霉素等5种药物中度敏感;对氨苄西林、阿莫西林、磺胺间甲氧嘧啶、红霉素、多粘菌素等5种药物耐药。
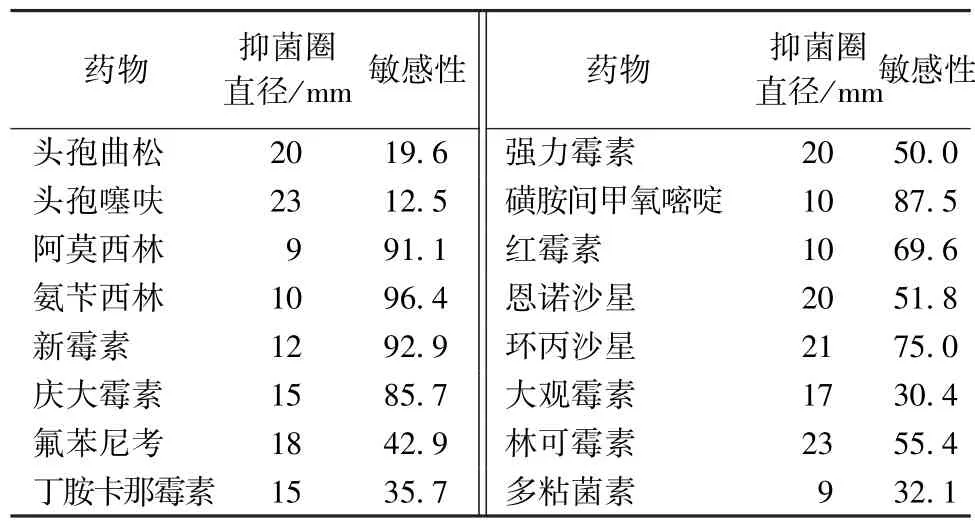
表2 药敏试验结果
3 讨论
近几年,随着我国养殖业的发展,肉鹅养殖数量越来越多,国内关于鹅巴氏杆菌病的报道逐渐增多,该病发病急、死亡快,其发病率和死亡率都很高特点,成为危害养鹅业主要细菌性传染疾病之一[9]。本试验从中牟地区某一肉鹅规模化养殖场中14日龄病死肉雏鹅心血、肺脏、肝脏等病料组织中分离到1株病原菌,被鉴定为多杀性巴氏杆菌,通过人工感染肉雏鹅验证其致病性,结果显示,从肉雏鹅体内分离到的多杀性巴氏杆菌对14日龄的雏鹅具有很强的致病性,其LD50为5.86×106CFU/mL。本试验分离的肉鹅源致病性多杀性巴氏杆菌致病性均高杨楠等[6]、张召兴等[10]报道的。可能与分离的区域有关。巴氏杆菌传播途径广泛,与外界环境的有很大关系,当外界条件该病时,可以诱发该病发生与流行。在肉鹅的养殖过程中应该引起重视。
多杀性巴氏杆菌抗菌结构复杂,其中荚膜抗原主要包括A、B、D、E和F5种,脂多糖抗原有16种,不同地区不同的宿主流行的血型也存在差异性。本试验结果显示,分离到肉鹅源致病性多杀性巴氏杆菌荚膜抗原血清型为A型。许多研究鹅源多杀性巴氏杆菌荚膜抗原血清型为A型。荚膜抗原血A型多杀性巴氏杆菌可能成为鹅源多杀性巴氏杆菌流行的主要血清型。在肉鹅养殖过程中,没有用多杀性巴氏杆菌多价疫苗进行预防,导致该病的发生与流行,临床中主要用抗菌药物进行防控,抗菌药物不合理使用,导致严重的耐药性,降低治疗效果。本试验药敏试验结果表明,分离菌株对对头孢曲松、头孢噻呋、恩诺沙星等6种药物高度敏感;对其他药物有不同的程度耐药性。因此,当发生该病时,应该选择敏感药物合理使用,减少抗药性产生,同时还要加强平时的饲养管理,注意养殖环境中的消毒。

