蓝舌病病毒血清I型VP2与VP5、VP3与VP7两组蛋白在杆状病毒系统中的表达与鉴定
李占鸿,杨 恒,宋子昂,高 林,李华春,廖德芳
(云南省畜牧兽医科学院,热带亚热带动物病毒重点实验室,云南昆明 650224)
蓝舌病(bluetongue,BT)是由蓝舌病病毒(bluetongue virus,BTV)感染引起的一种严重侵害反刍动物的烈性传染病。BTV通过库蠓(Culicoides)对牛、羊、骆驼等反刍动物的吸血性叮咬传播。绵羊对BTV最易感,发病率可达70%,病死率可达40%。发病绵羊的主要症状为高热、口唇充血肿胀及糜烂、鼻腔和胃肠黏膜出血溃疡[1]。BT的暴发和流行给牛羊养殖业造成严重经济损失,被世界动物卫生组织(OIE)列为须通报动物疫病[2]。
BTV为呼肠孤病毒科(Reoviridae)环状病毒属(Orbivirus)的代表成员,其病毒粒子由内部核心、内层衣壳与外层衣壳3部分组成[3],其中外层衣壳由Seg-2与Seg-6基因编码的VP2与VP5蛋白构成,氨基酸序列具有高度变异的特性,是诱导产生中和抗体的主要蛋白,决定着病毒血清型[4]。BTV的内层衣壳由Seg-3与Seg-7基因编码的VP3与VP7蛋白构成,氨基酸序列在不同血清型BTV毒株之间高度保守,可诱导BTV群特异性抗体产生[5]。
疫苗接种是防控BT的重要环节之一。目前商品化的BTV疫苗包括弱毒疫苗与灭活疫苗两类[6]。BTV弱毒疫苗存在病毒扩散、毒力返强以及与流行野毒株发生基因重配等风险[7-8];BTV灭活苗虽具有较高的安全性,但存在免疫保护期短、生产成本高、批间重复性差等问题[9]。此外,弱毒疫苗和灭活苗都存在难以区分疫苗免疫和自然感染的问题。因此,进一步开发安全高效且易于区别自然感染与疫苗免疫的BTV基因工程疫苗成为研究重点[6]。近年来已有关于BTV的活病毒载体疫苗[10]、DNA疫苗[11]、非感染性单复制周 期 疫 苗[12](disabled-infectious-single-cycle,DISC)以及通过昆虫杆状病毒表达系统制备的类病毒颗粒(virus-like particles,VLP)亚单位疫苗[5]等报道。
我国存在多种BTV血清型毒株的流行,不同血清型BTV毒株对绵羊的致病性存在较大差异。BTV1型为我国广泛流行的血清型之一,对绵羊具有较强的致病性[13],因此开发安全高效的BTV1型疫苗,对我国BT防控具有重要意义。本实验室前期成功开发了BTV1型灭活疫苗,并在绵羊上取得了良好的免疫保护效果[14]。但BTV1型基因工程疫苗的研究在我国尚属空白。本研究采用“Bac to Bac”双启动子杆状病毒表达系统,分别构建了共表达BTV1型病毒VP2与VP5蛋白,VP3与VP7蛋白两种重组杆状病毒。将重组杆状病毒感染Sf9昆虫细胞,通过免疫荧光( fluorescence immunoassay,IFA)和Western-blot证实,目的蛋白得以表达且具有良好的反应原性,这为进一步开发针对我国BTV1型的VLP亚单位疫苗奠定了基础。
1 材料与方法
1.1 毒株、细胞、质粒与抗体
BTV1型毒株(YNDH/V013/2014)、野生型杆状病毒、Sf9昆虫细胞、BHK-21细胞:均由本实验室保存;大肠杆菌Stable3感受态细胞:购自北京博迈德公司;大肠杆菌DHB10感受态细胞、杆状病毒双启动子表达质粒pFastBacDual:购自Invitrogen 公司;BTV1/V013毒株Seg-2、Seg-3、Seg-6、Seg-7全长序列克隆质粒PLB-BTV1/V013/Seg-2、PLB-BTV1/V013/Seg-3、PLB-BTV1/V013/Seg-6与PLB-BTV1/V013/Seg-7:由本实验室构建保存。
鼠源抗BTV VP7蛋白单克隆抗体:由中国农业科学院哈尔滨兽医研究所馈赠;兔抗BTV1型VP2、VP3与VP5蛋白多克隆抗体:由本实验室以大肠杆菌表达的BTV1型病毒VP2、VP3与VP5蛋白免疫家兔制备;HRP标记的羊抗兔IgG、FITC标记的羊抗鼠IgG、FITC标记的羊抗兔IgG:购自碧云天生物科技有限公司。
1.2 主要试剂
高保真DNA聚合酶Q5 High-Fidelity、DNA Polymerase与限制性内切酶:购自NEB公司;Protein Marker、DNA Marker、PCR产物纯化试剂盒、DNA凝胶回收试剂盒、质粒提取试剂盒等:购自宝生物工程(大连)有限公司;Easy Geno重组克隆试剂盒、RIPA高效组织细胞裂解液、HRPDAB底物显色试剂:购自北京天根生物技术公司;Cellfectin II Reagent转染试剂以及Grace's、Sf900 II培养基:购自Invitrogen公司。
1.3 引物设计与合成
根据前期获取BTV1型毒株YNDH/V013/2014全基因组序列设计引物,用于扩增该毒株的Seg-2、Seg-3、Seg-6与Seg-7的ORF区。采用重组克隆方式进行重组质粒构建,登录天根公司无缝克隆引物在线设计工具(http∶//123.56.75.195/)分别输入待克隆目的基因与pFastBacDual载体质粒序列,选择单酶切线性化质粒载体,获取引物序列(表1),引物由上海捷瑞生物公司合成。

表1 BTV1型毒株YNDH/V013/2014的Seg-2、-3、-6与-7基因节段ORF区扩增引物
1.4 重组质粒构建
1.4.1 重组质粒pBac-BTV1-VP5与pBac-BTV1-VP7构建 分别以BTV1/V013毒株的Seg-6与Seg-7 全长序列克隆质粒PLB-BTV1/V013/Seg-6与PLB-BTV1/V013/Seg-7为模板,使用BTV1-VP5-F/R、BTV1-VP7-F/R引 物, 采 用Q5 High-Fidelity DNA Polymerase扩增BTV1/V013毒株Seg-6与Seg-7的ORF区。提取pFastBacDual质粒,使用XhoI内切酶(酶切位点位于质粒pP10启动子下游)进行质粒的酶切线性化。PCR产物与酶切质粒经电泳胶回收后,使用Easy Geno重组克隆试剂盒按说明书将Seg-6与Seg-7 ORF区DNA克隆至线性化pFastBacDual质粒,挑取白色菌落进行PCR鉴定;将PCR阳性菌进行测序验证,对测序正确的质粒分别命名为pBac-BTV1-VP5与pBac-BTV1-VP7。
1.4.2 重组质粒pBac-BTV1-VP2/VP5与pBac-BTV1-VP3/VP7构建 分别以BTV1/V013毒株的Seg-2与Seg-3 全长序列克隆质粒PLB-BTV1/V013/Seg-2与PLB-BTV1/V013/Seg-3为模板,使用BTV1-VP2-F/R、BTV1-VP3-F/R引物,PCR扩增BTV1/V013毒株Seg-2与Seg-3的ORF区。提取pBac-BTV1-VP5与pBac-BTV1-VP7重组质粒,使用PstI(酶切位点位于质粒pPH启动子下游)对质粒进行酶切线性化,用Easy Geno重组克隆试剂盒将Seg-2与Seg-3的ORF区,分别克隆到pBac-BTV1-VP5与pBac-BTV1-VP7重组质粒的pPH启动子下游,构建出共表达BTV1型病毒的VP2与VP5蛋白、VP3与VP7蛋白的重组质粒pBac-BTV1-VP2/VP5与 pBac-BTV1-VP3/VP7,将重组质粒进行测序确认。
1.5 重组杆状病毒DNA获取
将构建的重组质粒pBac-BTV1-VP2/VP5与pBac-BTV1-VP3/VP7与空载体质粒pFastBacDual分别转化DH10Bac感受态细胞,涂布含卡那霉素 (50 μg/mL)、庆大霉素(7 μg/mL)、四 环 素(10 μg/mL)、 X-gal(100 μg/mL)与IPTG(40 μg/mL)的LB平板,30 ℃避光培养24~36 h,挑选白色菌落进行PCR鉴定。将PCR鉴定阳性菌在LB液体培养基中增菌,采用碱裂解法提取重组杆状病毒DNA,获取的杆状病毒DNA命名为Bac-BTV1-VP2/VP5、Bac-BTV1-VP3/VP7与pFastBacDual。
1.6 Sf9细胞转染与重组杆状病毒获取
将生长状态良好的Sf9细胞均匀接种6孔板细胞板,每孔细胞密度为1.6×106个/mL,将细胞置于28 ℃培养2 h后,吸弃SF900-II培养基,使用无血清的Grace's 培养基将细胞轻轻润洗1次;取1 μg杆状病毒DNA,使用Cellfectin II Reagent转染试剂按说明书转染Sf9昆虫细胞,同时设立空白转染对照;将转染后的细胞于28 ℃继续培养6~7 d,当转染细胞出现明显细胞病变(cytopathogenic effects,CPE)后,离心收集细胞上清,接种 Sf9细胞,连续盲传2代;收集第3代细胞培养物,使用病毒DNA/RNA提取试剂盒提取核酸,进行BTV Seg-2与 Seg-7的PCR扩增鉴定。
1.7 间接免疫荧光检测重组杆状病毒表达VP5与VP7蛋白
取P3代 培 养 的Bac-BTV1-VP2/VP5、Bac-BTV1-VP3/VP7重组杆状病毒与野生型杆状病毒感染12孔板培养的Sf9 细胞,置于28 ℃培养箱培养3 d后,用-20 ℃ 预冷的甲醛∶丙酮(1∶1)固定液,室温下固定20 min;使用含5%(m/v)脱脂奶粉的PBST于37 ℃封闭1.5 h;弃封闭液,分别加兔抗BTV1-VP5蛋白多克隆抗体(1∶500稀释)与鼠抗BTV1-VP7蛋白单克隆抗体(1∶4 000稀释),37 ℃ 孵育1 h;以PBST洗涤3次(5 min/次)后,分别加入1∶2 000稀释的FITC 标记山羊抗兔 IgG和 1∶1 500稀释的FITC 标记山羊抗鼠 IgG,37 ℃条件下避光孵育30 min;PBST洗涤5次(5 min/次)后,于倒置荧光显微镜下观察细胞的荧光产生情况。
1.8 Western-blot检测重组杆状病毒表达VP2与VP3蛋白
取 P3代 Bac-BTV1-VP2/VP5、Bac-BTV1-VP3/VP7重组杆状病毒与野生型杆状病毒,分别感染6孔板Sf9细胞,于28 ℃培养3 d,离心收集细胞,加入200 μL的RIPA组织细胞裂解液,冰浴静置10 min,8 000 r/min 离心10 min,取上清进行SDS-PAGE电泳,电泳结束后电转至聚偏二氟乙烯膜(PVDF);用含 5%(m/v)脱脂奶粉溶液的 PBST于37 ℃封闭2 h后,分别加入1∶500稀释的兔抗BTV1-VP2与兔抗BTV1-VP3多克隆抗体,37 ℃孵育1 h;以PBST洗涤3次(10 min/次)后,加入1∶1 000稀释的HRP 标记山羊抗兔IgG,37 ℃孵育45 min;用PBST洗涤3次(10 min/次),加入DAB底物显色试剂显色,在化学发光成像系统(上海勤翔)曝光,观察目的蛋白表达情况。
2 结果
2.1 目的基因扩增与重组质粒构建
BTV1型毒株YNDH/V013/2014的Seg-2、Seg-3、Seg-6与Seg-7的ORF区进行扩增,分别获得2.9、2.7、1.6与1 kb的特异性DNA条带(图1)。将BTV1型病毒的Seg-2或Seg-3插入杆状病毒双启动子pFastBacDual质粒载体的pPH启动子下游,将BTV1型病毒的Seg-6或Seg-7插入pFastBacDual质粒载体pP10启动子下游,构建出共表达BTV VP2与VP5、VP3与VP7蛋白的重组质粒pBac-BTV1-VP2/VP5与pBac-BTV1-VP3/VP7(图2)。对重组质粒的测序结果显示,插入的序列与前期获取的序列相似度为100%,表明重组质粒构建成功。
2.3 重组杆状病毒获取以及在Sf9细胞上引起的CPE
提取重组杆状病毒DNA,转染Sf9细胞,在转染后的6 d未观察到明显的CPE。取转染细胞的上清在Sf9细胞进行连续盲传,在盲传的第3代观察到感染病毒后的Sf9细胞出现明显的CPE,表现为细胞逐渐融合、崩解,部分细胞脱落(图3)。提取细胞核酸,使用本实验室开发的BTV1的Seg-2血清型特异性引物与BTV的Seg-7群特异性扩增引物,可分别扩增出大小约1.6 kb与1 kb的DNA条带,对扩增产物进行测序,结果显示为BTV1型毒株YNDH/V013/2014的Seg-2与Seg-7序列,表明获取了具有感染性重组杆状病毒。
2.4 重组杆状病毒在Sf9细胞中表达VP5与VP7蛋白检测
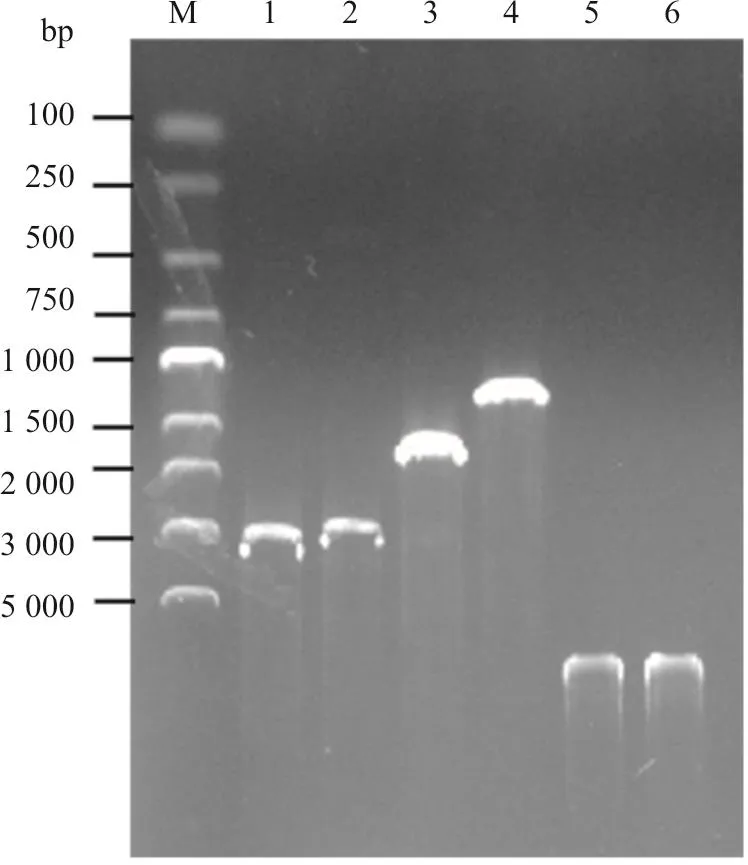
图 1 BTV1型毒株Seg-2、Seg-3、Seg-6与Seg-7的ORF区扩增以及获取的Bac-BTV1-VP2/VP5、Bac-BTV1-VP3/VP7重组杆状病毒DNA

图2 pBac-BTV1-VP2/VP5与pBac-BTV1-VP3/VP7质粒构建示意图

图3 重组杆状病毒Bac-BTV1-VP2/VP5与Bac-BTV1-VP3/VP7感染的Sf9细胞引起的CPE(100倍)
通过免疫荧光检测重组杆状病毒Bac-BTV1-VP2/VP5与Bac-BTV1-VP3/VP7感 染的Sf9细胞中VP5与VP7蛋白的表达结果如图4显示:使用抗BTV VP5蛋白抗体进行染色的Sf9细胞(感染Bac-BTV1-VP2/VP5)和使用抗VP7抗体进行染色的Sf9细胞(感染Bac-BTV1-VP3/VP7)均显示了强烈的绿色荧光,而野生型杆状病毒(未插入任何目的基因)感染的Sf9细胞未见任何特异性的荧光产生。结果表明,重组杆状病毒Bac-BTV1-VP2/VP5与Bac-BTV1-VP3/VP7感染的Sf9细胞可分别高效表达VP5蛋白与VP7蛋白。
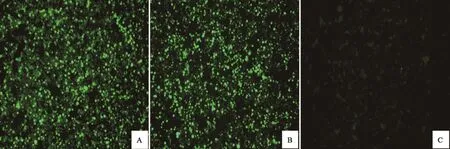
图4 重组杆状病毒Bac-BTV1-VP2/VP5与Bac-BTV1-VP3/VP7感染的Sf9细胞中VP5与VP7蛋白的免疫荧光检测(100倍)
2.5 重组杆状病毒在Sf9细胞中表达VP2与VP3蛋白检测
收获重组杆状病毒Bac-BTV1-VP2/VP5与Bac-BTV1-VP3/VP7感染的Sf9细胞,分别用兔抗BTV1病毒VP2蛋白多克隆抗体和兔抗BTV1病毒VP3蛋白多克隆抗体进行Western-blot检测。结果显示:重组杆状病毒Bac-BTV1-VP2/VP5与Bac-BTV1-VP3/VP7感染的Sf9细胞均可检测到大小约100 kD的特异性蛋白条带(图5),与预测的BTV1型YNDH/V013/ 2014毒株的VP2蛋白(112 kD)VP3蛋白(103 kD)大小基本一致;野生型杆状病毒感染的Sf9细胞中,在对应位置未检测到特异性蛋白条带出现。Western-blot的结果表明,重组杆状病毒Bac-BTV1-VP2/VP5与Bac-BTV1-VP3/VP7成功表达出BTV1型的VP2与VP3蛋白。
3 讨论
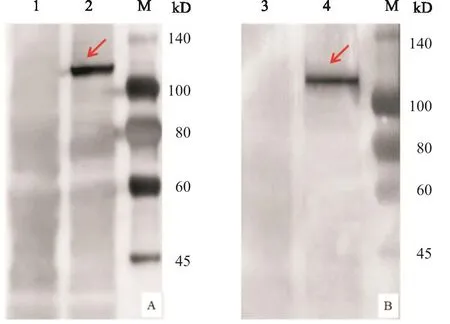
图5 Western-blot检测重组杆状病毒Bac-BTV1-VP2/VP5与Bac-BTV1-VP3/VP7感染Sf9细胞后VP2蛋白(A)与VP3蛋白(B)的表达
杆状病毒表达系统是目前最常用的真核表达系统之一,在病毒亚单位疫苗研究方面具有特殊的优势:(1)通过杆状病毒表达系统表达的外源蛋白可在昆虫细胞内进行正确的折叠,并完成翻译后的修饰加工,产生类病毒颗粒(VLP),可高效诱导动物机体产生体液免疫、细胞免疫为机体提供有效的免疫保护[15-16];(2)由于VLP只含有特定的病毒蛋白,便于通过抗体检测区分疫苗免疫和自然感染动物[16];(3)杆状病毒基因组作为表达载体可以容许多个外源基因的同时高效表达[17];(4)杆状病毒只感染节肢动物,对脊椎动物无感染性,具有很好的安全性。目前,已有多种利用该系统表达制备的亚单位疫苗通过批准上市,如抗猪瘟、猪霍乱、猪圆环病毒等亚单位疫苗[16-17]。
BTV的VP2蛋白是诱导机体产生特异性中和抗体的主要蛋白[4];VP5蛋白虽然不是激发特异中和抗体的蛋白,但研究表明VP5蛋白可通过影响VP2蛋白的构象从而影响影响VP2抗体的产生[4,18]。因此,本研究同时选择了BTV1病毒的VP2与VP5蛋白作为候选抗原进行杆状病毒的表达。VP3与VP7均为BTV的群特异性抗原,含有多个T淋巴细胞抗原表位,可刺激机体的细胞免疫应答[5,19],更为重要的是,研究表明通过在杆状病毒在Sf9细胞中表达VP2与VP5、VP3与VP7两组蛋白组装出VLP,只需使用单独表达VP2蛋白剂量的百分之一,即可激发与之相当的抗体水平[20],这是本研究构建共表达BTV的VP3与VP7蛋白杆状病毒的重要原因。下一步,将通过重组杆状病毒Bac-BTV1-VP2/VP5与Bac-BTV1-VP3/VP7共感染Sf9细胞的方式,进行BTV VLP组装。
由于抗BTV1的VP5与VP7蛋白的抗体具有构象依赖性,因此通过免疫荧光检测重组杆状病毒Bac-BTV1-VP2/VP5与Bac-BTV1-VP3/VP7感染的Sf9细胞中BTV1-VP5与BTV1-VP7蛋白的表达,结果感染Bac-BTV1-VP2/VP5和Bac-BTV1-VP3/VP7重组杆状病毒的Sf9细胞均显示了强烈的绿色荧光信号。这一方面证实了BTV1-VP5与BTV1-VP7蛋白在Sf9细胞中的高效表达,另一方面也证实了表达的BTV1-VP5与BTV1-VP7蛋白在Sf9细胞中形成了正确的构象。本实验室制备的抗BTV1-VP2多克隆抗体与抗BTV1-VP3蛋白多克隆抗体识别的抗原表位为线性表位,因此本研究通过Western blot验证BTV1-VP2与BTV1-VP3蛋白的表达。
本研究根据我国BTV1型流行毒株遗传信息所构建的,分别表达BTV1-VP2/VP5和BTV1-VP3/VP7的重组杆状病毒,可在昆虫细胞中有效表达,并具有良好的反应原性。接下来将尝试进行BTV1 VLP的组装、纯化等工作,并对BTV1 VLP的免疫保护效果进行验证,为开发针对我国BTV1毒株的亚单位疫苗据奠定一定的基础。
——一道江苏高考题的奥秘解读和拓展

