新型鸭呼肠孤病毒在DF-1细胞系中的增殖特性
云 涛,华炯钢,叶伟成,倪 征,陈 柳,张 存
(浙江省农业科学院 畜牧兽医研究所, 浙江 杭州 310021)
禽呼肠孤病毒(avian reovirus,ARV)是呼肠孤病毒科、正呼肠孤病毒属中的一员,为双链RNA,有10个节段,常见于鸡、火鸡、鸭、鹅及一些鸟类等宿主体内[1],以病毒性关节炎、肠道病、腱鞘炎、矮小综合征、免疫抑制性疾病及吸收不良综合征等为临床特征[2]。1997年以来,在我国福建、浙江等地雏番鸭中暴发番鸭呼肠孤病毒(classical duck reovirus,CDRV或Muscovy duck reovirus,MDRV)疫病,其临床病变特征为肝脾肿胀,肝脾表面覆有大量的白色坏死点,俗称番鸭“白点病”,该疫病的出现及流行给我国番鸭养殖业带来了较严重的经济损失[3-4]。
近年来,我国养鸭主产省份鸭、鹅群中暴发一种以肝、脾出现大量坏死灶为主要特征的新疫病,根据临床病理特征被命名为“出血性坏死性肝炎”和“脾坏死病”[5-11]。该病无明显季节性,发病以5~10日龄为主,多品种鸭(如番鸭、半番鸭、麻鸭、北京鸭、樱桃谷鸭等)和鹅均可发生[12-16]。该疫病不仅引起雏鸭发病和死亡,还可引起免疫抑制和生长发育障碍[6,11,17-18]。经病原分离与鉴定、全基因组序列破译与分析及系统进化树分析证实,该病原是一种新型的鸭呼肠孤病毒(new-type duck reovirus,NDRV),属于呼肠孤病毒科、正呼肠孤病毒属Ⅱ型的禽正呼肠孤病毒种成员[11-15]。
尽管CDRV和NDRV都属于禽正呼肠孤病毒群成员,两者的生物学特性有很多相似性,但在致病性和抗原性上存在显著的差异。在致病性方面,NDRV除可致死番鸭胚(仅用于分离CDRV)外,还可致死鸡胚和肉鸭胚,体外分离胚的种类增加[6,11,12,16];其次,NDRV除可引起番鸭和半番鸭致病(CDRV致病谱)外,还可引起多个品种的鸭及鹅致病,致病谱扩大[6,9-17];再者,NDRV主要引起肝、脾表面出现大量不同规则的出血斑和坏死灶,而CDRV主要引起肝、脾肿胀,表面覆有大量白色的坏死点[6,11,12,16]。在抗原性方面,血清交叉中和试验表明,CDRV与NDRV之间的抗原相关性低[7]。此外,CDRV与NDRV基因组的SDS-PAGE电泳图谱不同,CDRV为3/3/4图式,而NDRV为3/3/1/3图式[6,11,13,19]。与CDRV相比,NDRV的宿主范围更广、致病性更强。
虽然对CDRV的研究已经足够深入,国内也已有预防CDRV的商品化疫苗,但NDRV与CDRV之间在致病性、宿主特异性、抗原性及蛋白编码基因等方面存在差异[6,11-19]。目前并没有行之有效的预防与控制NDRV疫病的方法与技术。所以,研制能够预防NDRV的疫苗意义重大。本文旨在研究NDRV JDM10毒株在DF-1细胞中的增殖特性,并为进一步开展NDRV细胞灭活苗研制及分子致病机理研究奠定基础。
1 材料与方法
1.1 材料
1.1.1 病毒株与细胞系
NDRV JDM10毒株由浙江省农业科学院畜牧兽医研究所禽病研究室分离鉴定并保存,DF-1细胞系由浙江省农业科学院畜牧兽医研究所禽病研究室保存。
1.1.2 主要试剂
DL 2 000 DNA Marker,Mini BEST Viral RNA/DNA Extraction Kit Ver.5.0,PrimeScriptTMOne-step RT-PCR Kit Ver.2,MiniBEST Agarose Gel DNA Extraction Kit Ver.4.0,MiniBEST Plasmid Purification Kit Ver.4.0,pMD-T19 simple载体,宝生物工程(大连)有限公司;FITC和HRP标记的山羊抗鼠IgG二抗,北京中衫金桥生物技术有限公司;胎牛血清、DMEM培养基, 美国Gibco公司;抗NDRV σC单克隆抗体由浙江省农业科学院畜牧兽医研究所禽病研究室制备并保存。
1.2 方法
1.2.1 病毒接种DF-1细胞
取融合度达80%的单层DF-1细胞,用pH=7.0无菌PBS缓冲液清洗3次,加入种毒液作用吸附2 h,弃去吸附液,用含2% 胎牛血清的DMEM维持液替换,37 ℃、5% CO2培养箱中培养,用光学显微镜观察细胞病变情况。培养3 d后,收取细胞培养物,冻融3次收病毒,记为F1,-80 ℃冰箱中冻存备用。用F1毒接种DF-1细胞,并收取培养3 d后的细胞培养物F2,重复接毒3次,收集第3代细胞培养物F3。测定病毒效价。
1.2.2 引物设计与合成
根据NCBI上公布的NDRV JDM10株SigC基因的核苷酸序列(登录号:KF154116),用Oligo 6.0设计特异性引物,并由上海博尚生物技术有限公司合成。上游引物F: 5′-ACGATGGATCGCAACGAGGTG-3′,下游引物R: 5′-GATGAATAGCTCTTCTCATCGC-3′,扩增产物片段为1 001 bp。
1.2.3 RT-PCR检测
收取F3病毒液,提取病毒RNA, NDRVSigC基因特异性引物进行一步法RT-PCR扩增。扩增条件:50 ℃ 30 min;94 ℃ 2 min;94 ℃ 30 s,56 ℃ 30 s,72 ℃ 1 min,共35个循环。RT-PCR产物用1%琼脂糖凝胶电泳检测。
1.2.4 间接免疫荧光检测
将DF-1细胞培养于35 mm培养皿中,接种F3代病毒液。培养24 h后,将培养皿中的细胞液弃除,用pH=7.0无菌PBS细胞缓冲液清洗3次,然后用预冷的丙酮:甲醇体积比为1∶1的固定液4 ℃固定30 min;用含1% NP40的PBS细胞缓冲液洗3次,加入抗NDRV-σC 单克隆抗体A9-D4(1∶5 000),37 ℃孵育1 h;用NP40-PBS 洗3次,加入羊抗鼠的FITC-IgG为二抗(1∶1 000),37 ℃孵育1 h。在荧光显微镜下进行检测。
1.2.5 Western-blot检测
将NDRV JDM10毒株感染72 h的细胞培养物裂解后,经SDS-PAGE电泳后,转印至PVDF膜,用含5%脱脂乳的PBST溶液4 ℃封闭过夜,以抗NDRV-σC 单克隆抗体A9-D4(1∶5 000)为一抗,羊抗鼠的HRP-IgG为二抗(1∶5 000),37 ℃各孵育1 h。通过DAB法进行显色检测。
1.2.6 一步生长曲线
将收取的F3病毒液接种DF-1细胞,于接毒后2、24、36、48、60、72、84、96、108、120 h收取细胞培养物,-80 ℃冻存备用。将DF-1细胞接种到96孔细胞板,37 ℃ 5% CO2培养箱中过夜培养,病毒液进行10倍比稀释,按照每孔100 μL分别接种于病毒稀释液,37 ℃作用2 h,弃去病毒液,更换含2% FBS的DMEM维持液,37 ℃、5% CO2培养箱中培养观察致病变效应,记录各稀释度孔出现致病变效应的孔数(每个时间点病毒液测定3次)。采用Reed-Meunch方法计算10个时间点各病毒液的TCID50,以3次重复实验结果的平均值为最终值,并绘制病毒在细胞上的一步生长曲线。
2 结果与分析
2.1 细胞形态学观察
如图1所示,DF-1细胞在接种病毒的12 h后可观察到细胞病变,72 h时能观察到细胞破碎、萎缩、抱团、脱落,个别细胞出现空泡、边缘模糊、胞体变大,甚至死亡等特征病变。对照组细胞则生长良好。
2.2 RT-PCR检测
由图2可知,成功扩增出一条大小为1 001 bp的条带,而阴性对照无条带。对该片段进行测序分析,该扩增片段序列与NDRV JDM10毒株基因组序列的同源性在99.99%以上,说明NDRV JDM10毒株在DF-1活细胞中进行了增殖。

M,DL2 000 DNA Marker;1~2,RT-PCR扩增产物;3,阴性对照。M, DL2 000 DNA Marker;1-2, RT-PCR products;3, Negative control.图2 RT-PCR扩增产物鉴定Fig.2 RT-PCR amplification product identification
2.3 间接免疫荧光检测
NDRV JDM10在接种DF-1细胞24 h,以抗NDRV-σC单克隆抗体为一抗,以羊抗鼠FITC-IgG为二抗,进行间接免疫荧光检测。结果显示,DF-1细胞内有大量的特异性绿色荧光(图3),表明NDRV σC蛋白获得了良好的表达,且NDRV JDM10毒株能在DF-1细胞中增殖。
2.4 Western-blot检测
如图4所示,在细胞裂解物中能检测到分子量大小为34 ku的蛋白,与DNRV σC蛋白大小一致,且与抗NDRV σC单抗产生特异性免疫反应(图4),表明NDRV JDM10毒株能在DF-1细胞中增殖。

A,正常DF-1细胞;B,接种病毒24 h后的DF-1细胞。A, Normal DF-1 cells;B, Cell of DF-1 infected with NDRV JDM10 for 24 h.图3 NDRV-σC在DF-1细胞中表达的间接免疫荧光检测Fig.3 Detection of NDRV-σC expression in DF-1 cells with IFA

M,蛋白质分子质量标准;1,感染NDRV的DF-1细胞裂解物;2,正常DF-1细胞裂解物。M, Protein molecular weight marker; 1, DF-1 cells infected with NDRV; 2, Normal DF-1 cells.图4 NDRV σC蛋白的Western-blot检测Fig.4 Detection of NDRV σC by western-blot
2.5 一步生长曲线
将收取的F3病毒液接种DF-1细胞,于接毒后2、24、36、48、60、72、84、96、108、120 h收取细胞培养物,分别测定TCID50(每个时间点重复3次后取平均值),各时间点的TCID50分别为10-1.39、10-3.29、10-5.50、10-6.64、10-7.39、10-7.80、10-7.80、10-7.90、10-7.75、10-7.80·(0.1 mL)-1。经GraphPad Prism软件分析后绘制出一步生长曲线(图5)可知,NDRV JDM10毒株在接种DF-1细胞后,0~12 h为潜伏期,12~48 h为快速增长期,48 h后为稳定期,但在72 h病毒效价达到峰值,TCID50为10-7.90·(0.1 mL)-1,之后病毒效价维持在较高水平。
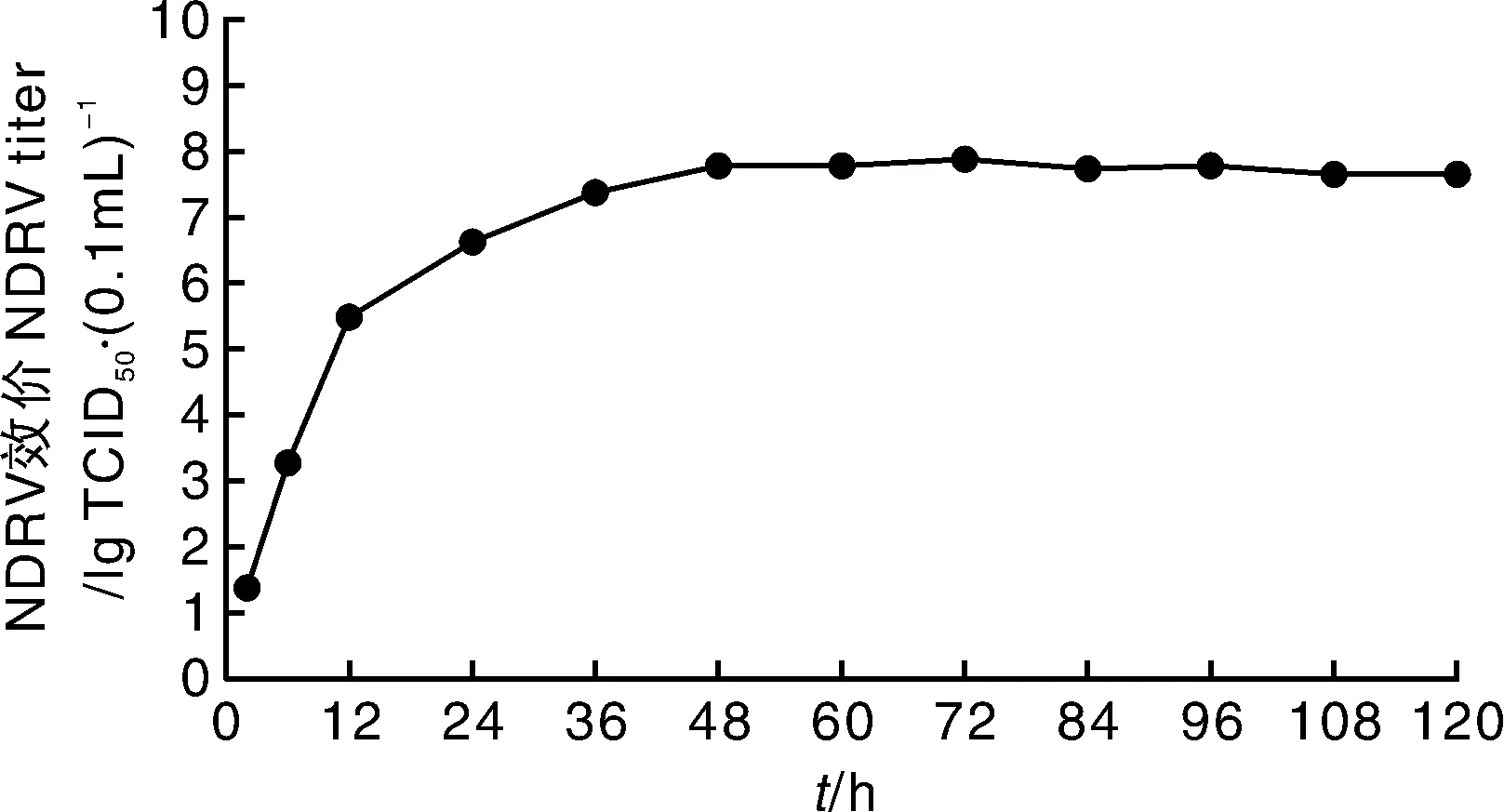
图5 NDRV JDM10毒株在DF-1细胞上的增殖动力曲线Fig.5 One step growth curve of NDRV JDM10 in DF-1 cells
3 讨论
近年来,我国养鸭主产省份及地区均相继暴发了新型鸭呼肠孤病毒病疫情,该病较以往疫情致病性更强,宿主范围更广,流行的疫区也逐年扩大,已给我国养鸭业造成了严重的经济损失,并成为一类重要传染病原,严重阻碍养鸭业的健康发展[10,17]。
研究发现,ARV、CDRV和NDRV均具有较广的细胞亲嗜性,可在Vero细胞、鸡胚成纤维细胞(CEF)、仓鼠肾细胞(BHK-21)、犬肾细胞(MDCK)、番鸭胚成纤维细胞(MDEF)、Vero细胞、AD293T细胞、Marc-145细胞等多种细胞系中增殖,并产生稳定病变[7,20]。而三者致细胞病变特征有所差异,ARV与NDRV均以巨融合为主,CDRV则以细胞圆缩坏死为主,且三者之间的抗原相关性较低,细胞培养特性也不尽相同[7,20]。沈文康等[21]在Vero细胞中接种ARV S1133,丁明洋等[22]在BHK-21细胞中接种NDRV TH11后结果均发现,ARV S1133和NDRV TH11等2种不同的病毒株在接种细胞后均可分为潜伏期、快速增长期和稳定期3个时期,且12 h时病毒效价最低,48 h时病毒效价达到峰值。Vero细胞和BHK-21虽是传代细胞系,已被广泛用于疫苗研制,但这2种细胞系均为哺乳动物细胞系,与禽类遗传关系甚远,用其生产的疫苗免疫家禽时可产生明显的副反应。
胚接种病毒是目前禽类病毒分离与增殖最常用的方法,虽然该方法有效、单次获毒多,但周期长、操作繁琐、容易污染的缺点,使得对病毒的分离培养有很大的局限性。为此,本研究利用DF-1细胞研究NDRV的增殖规律,充分利用了细胞增殖病毒周期短、可收获单一病毒等多种优点。DF-1细胞是一种可传代的鸡成纤维细胞系,是一种稳定的、无肿瘤基因、自发无限增殖的细胞系,已被广泛用于动物病毒研究、疫苗研制、癌症研究等诸多领域,是生命科学领域重要的病毒转染、培养生物材料[23]。本研究利用DF-1细胞研究NDRV在细胞中的增殖特性,结果表明,NDRV能在DF-1细胞中有效增殖,并产生明显的致病变效应。但NDRV JDM10在DF-1细胞上传至一定代数后才出现细胞融合现象,在此之前与CDRV引起的致病变效应相同。一步生长曲线用来定量描述病毒生长规律,可划分为3个时期,即潜伏期、突破期、稳定期[16-17]。NDRV JDM10毒株在DF-1生长也可分为3期,0~12 h为潜伏期, 12~48 h为快速增长期,48 h之后为稳定期,侵染细胞2 h时病毒就可增殖,72 h病毒效价达到峰值,病毒在细胞中的增殖趋势与上述报道结果基本一致。本研究发现,NDRV在DF-1细胞中可有效增殖,72 h病毒效价达到峰值,TCID50为10-7.90·(0.1 mL)-1。本研究为应用DF-1细胞研制NDRV细胞灭活疫苗和开展该病毒的分子致病机理研究提供了一个良好的操作平台。

