浙江省绍兴市茄子黄萎病菌菌株致病型鉴定及其生物学特性研究
李戌清,张敬泽,张 雅,吴根良
(1.杭州市农业科学研究院,浙江 杭州 310024; 2.浙江大学 农业与生物技术学院,浙江 杭州 310058)
自1914年美国弗吉尼亚州首次发现棉花黄萎病以来,该病传播到了世界各地,并成为了生产中发生普遍、造成损失严重、且防控难度较大的病害之一[1]。据报道,黄萎病病菌能侵染蔬菜、花卉、大田作物等逾200多种植物[2-3],也有报道认为可侵染约660种植物[4]。我国黄萎病病菌于1935年随引进美国棉种而传入[5]。20世纪50年代初,我国东北地区首次发现茄子黄萎病发生危害[6],后随着茄果类蔬菜种植面积的扩大而迅速蔓延,发病范围日益南扩[7]。茄田黄萎病流行后,发病率通常为40%~50%,严重时达70%以上,甚至绝收,不仅给茄农增加了种植管理难度,而且造成了严重的经济损失[8]。目前,人们对茄子黄萎病的研究大多集中在病害田间危害症状观测、病原菌种类鉴定、菌株致病力测定、菌株生物学特性研究、病害防控技术研究及茄子种质资源对黄萎病菌抗性鉴定等方面[9-11]。而对大丽轮枝菌的鉴定主要集中在棉花黄萎病上,而利用PCR特异性引物对病菌进行分子检测,确定其属于D致病型或ND致病型,极有利于病害的管理和防控决策的制定[12-13]。
就浙江省而言,随着近年来茄子生产的基地化和规模化发展,田间轮作倒茬频率减缓,土壤中病原菌积累增多,加之温暖湿润的气候条件,使得黄萎病对茄子生产的危害逐年加重。2017年1月12日浙江省绍兴市上虞区茄子专业合作社设施大棚中茄子黄萎病始发生(此时茄子处于首花开花结果期),1月18日调查结果显示田间茄子病株维管束变褐且植株萎蔫枯死,发病率在5.65%左右,且呈蔓延态势。茄子黄萎病已成为制约当地茄子生产的重要因素和急需解决的问题。本文通过对茄子黄萎病病菌的致病型鉴定及其生物学特性的分析,初步探明病害发生流行的成因,为进一步研究病害的发生规律和病害防控策略提供科学依据。
1 材料与方法
1.1 样品采集
于2017年1月,在浙江省绍兴市上虞区的温室大棚内,采集具典型症状的茄子病株,带回实验室,用于病原菌的分离。
1.2 病原菌的分离和纯化
采用常规组织分离培养方法对上述采集样品进行病原菌分离[14],然后进行单孢纯化。采用菌饼加30%甘油的保藏方法,将单孢菌株保藏在-70 ℃低温冰箱中。分离到的菌株通过形态学特征观察、微菌核产生情况及分子序列特征的分析(数据未显示),被鉴定为大丽轮枝菌。本研究选用5个代表性菌株(VD-sy1、VD-sy2、VD-sy3、VD-sy4和VD-sy5)进行研究。其中1株非落叶型参考菌株BP2来自江苏省农业科学研究院植物保护研究所棉花植株。
1.3 病原菌的培养和DNA的提取
选择上述5个代表性菌株,接种在马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)平板上进行活化,用直径0.5 cm打孔器在菌落边缘打取菌碟,后转接到PDA培养基平板中,置于25 ℃、24 h黑暗条件下培养2周。在超净工作台中,刮取收集菌体,用液氮冷冻干燥,然后研磨成粉,后采用CTAB法提取病原菌基因组DNA[15]。
1.4 特异性引物的合成和扩增
D致病型菌株和ND致病型菌株序列扩增所采用的特异性引物对分别为INTD2f(5′-ACT GGG TAT GGA TGG CTT TCA GGA CT-3′)和INTD2r(5′-TCT CGA CTA TTG GAA AAT CCA GCG AC-3′)[16]、INTND2f(5′-CTC TTC GTA CAT GGC CAT AGA TGT GC-3′)和INTND2r (5′-CAA TGA CAA TGT CCT GGG TGT GCC A-3′)[11,17],分别可扩增出462 bp和824 bp片段。上述引物均由生工生物工程(上海)有限公司合成。
用上述合成的引物对6个菌株的基因组DNA进行PCR扩增。其中,PCR扩增反应体系(50 μL)为:模板DNA 1 μL、10×PCR缓冲液(含Mg2+)5 μL、2.5 mmol·L-1dNTP 1 μL、10 pmol·μL-1引物各2 μL、5 U·μL-1Taq酶0.3 μL、ddH2O 38.7 μL;PCR扩增程序为:94 ℃预变性5 min,94 ℃变性45 s、60 ℃退火1 min、72 ℃延伸1 min、30个循环,72 ℃延伸10 min。PCR产物经1.5%琼脂糖凝胶电泳检测。
1.5 病原菌的生物学特性测定
1.5.1 温度对菌株生长速率的影响
采用菌碟接种法,即用直径为12 mm的打孔器,从预培养7 d的病原菌菌落边缘打出菌碟,将菌碟接种于新的PDA平板中央,分别置于10、15、20、25、28、30、32、35 ℃生化培养箱内培养,每个处理3次重复,培养至第7天时采用直尺十字交叉法测量菌落生长直径,至第14天时再测一次,进而计算菌丝日平均生长速率。
1.5.2 光照对菌株生长速率的影响
菌碟接种于PDA平板上,25 ℃下分别置于24 h光照、12 h光照/12 h黑暗、24 h黑暗培养,每个处理3次重复。菌落直径的测量和生长速率的计算方法同1.5.1节。
1.5.3 pH对菌株生长速率的影响
菌碟接种于不同pH值(pH 4.0~9.0)的PDA平板上,置于25 ℃下培养,每个处理3次重复。菌落直径的测量和生长速率的计算方法同1.5.1节。其中,将配制好的PDA培养基高压灭菌,后在热凝固前分别用0.1 mol·L-1HCl和0.1 mol·L-1NaOH调节培养基pH值至4.0、5.0、6.0、7.0、8.0及9.0,倒平板,即得到不同pH值的PDA平板。
1.5.4 不同碳源对菌株生长速率的影响
以查氏培养基(KNO32.00 g,K2HPO41.00 g,KCl 0.50 g,MgSO4·7H2O 0.50 g,FeSO40.01 g,蔗糖30.00 g,加水定容至1 L)为基础培养基。以KNO3为氮源,以半乳糖、可溶性淀粉、甘露醇、果糖、麦芽糖、葡萄糖、山梨醇、乙醇等量替换基础培养基中的蔗糖,置于25 ℃下培养,测定各碳源对菌株生长的影响,每个处理3次重复。菌落直径的测量和生长速率的计算方法同1.5.1节。
1.5.5 不同氮源对菌株生长速率的影响
以查氏培养基为基础培养基。以蔗糖为碳源,以甘氨酸、谷氨酰胺、脯氨酸、酵母膏、硫酸铵、牛肉浸膏、胰蛋白胨、氯化铵等量替换基础培养基中的KNO3,置于25 ℃下培养,测定各氮源对菌株生长的影响,每个处理3次重复。菌落直径的测量和生长速率的计算方法同1.5.1节。
2 结果与分析
2.1 菌株致病型的检测结果
用大丽轮枝菌落叶型特异性引物对INTD2f/INTD2r对6个黄萎菌(包括5个茄子黄萎病菌和1个棉花黄萎病菌)供试菌株进行PCR检测,除菌株BP2外,均扩增到大小约460 bp的特异性片段。而用大丽轮枝菌非落叶型特异性引物对INTND2f/INTND2r对上述6个黄萎菌供试菌株进行PCR检测,结果表明,仅菌株BP2扩增到一大小约820 bp的特异性片段(图1)。即,分离自浙江省绍兴市的5个菌株(VD-sy1、VD-sy2、VD-sy3、VD-sy4和VD-sy5)均被鉴定为落叶型。
2.2 病原菌的生物学特性
大丽轮枝菌VD-sy1在10~32 ℃均能生长,且在25 ℃菌落生长最快,日平均生长速率为4.31 mm·d-1,而在35 ℃菌落停止生长(图2)。
菌株VD-sy1在不同光照条件下菌落的生长速率不同,在24 h黑暗条件下菌落生长略优于12 h光照/12 h黑暗下,两者间差异不显著,但均显著优于24 h光照条件下。在连续光照的条件下,逐渐增加黑暗培养的时间可促进菌株VD-sy1菌落的生长(图3)。
不同pH条件对菌株VD-sy1生长速率的影响不同,其中pH 4.0时菌落生长最慢,为2.34 mm·d-1,显著低于pH 5.0~9.0。在试验pH范围内,随着pH值的升高,菌落生长速率先急剧升高后缓慢下降,在pH 5.0时菌落生长最快,为4.71 mm·d-1(图4)。
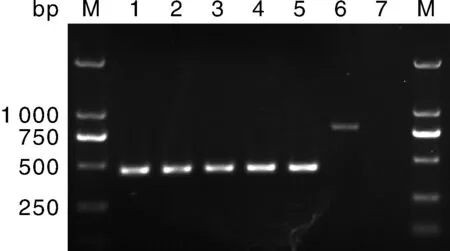
M,DNA marker D (100~2 000 bp);泳道1-5,依次为落叶型特异性引物对INTD2f/INTD2r对菌株VD-sy1、VD-sy2、VD-sy3、VD-sy4和VD-sy5 PCR扩增所得条带;泳道6,为非落叶型特异性引物对INTND2f/INTND2r对菌株BP2 PCR扩增所得条带;泳道7,清水对照。M, DNA marker D (100-2 000 bp); Lanes 1-5, PCR products of isolates VD-sy1, VD-sy2, VD-sy3, VD-sy4, VD-sy5 amplified by INTD2f/INTD2r, respectively; Lane 6, PCR product of isolate BP2 amplified by INTND2f/INTND2; Lane 7, CK.图1 落叶型和非落叶型特异性引物PCR扩增产物的琼脂糖凝胶电泳图Fig.1 Agrose gel electrophoresis of PCR products of defoliating and nondefoliating pathotype isolates obtained with the specific primer pairs

第7天和第14天分别进行差异显著性分析。不同的小写字母表示处理之间的差异显著(P<0.05)。下同。Significant difference analysis was done based on date of seventh day and fourteenth day, respectively. The different lowercase letters meant significant difference at 0.05 level among treatments. The same as below.图2 温度对菌株VD-sy1菌落生长的影响Fig.2 Effect of temperature on mycelial growth of strain VD-sy1
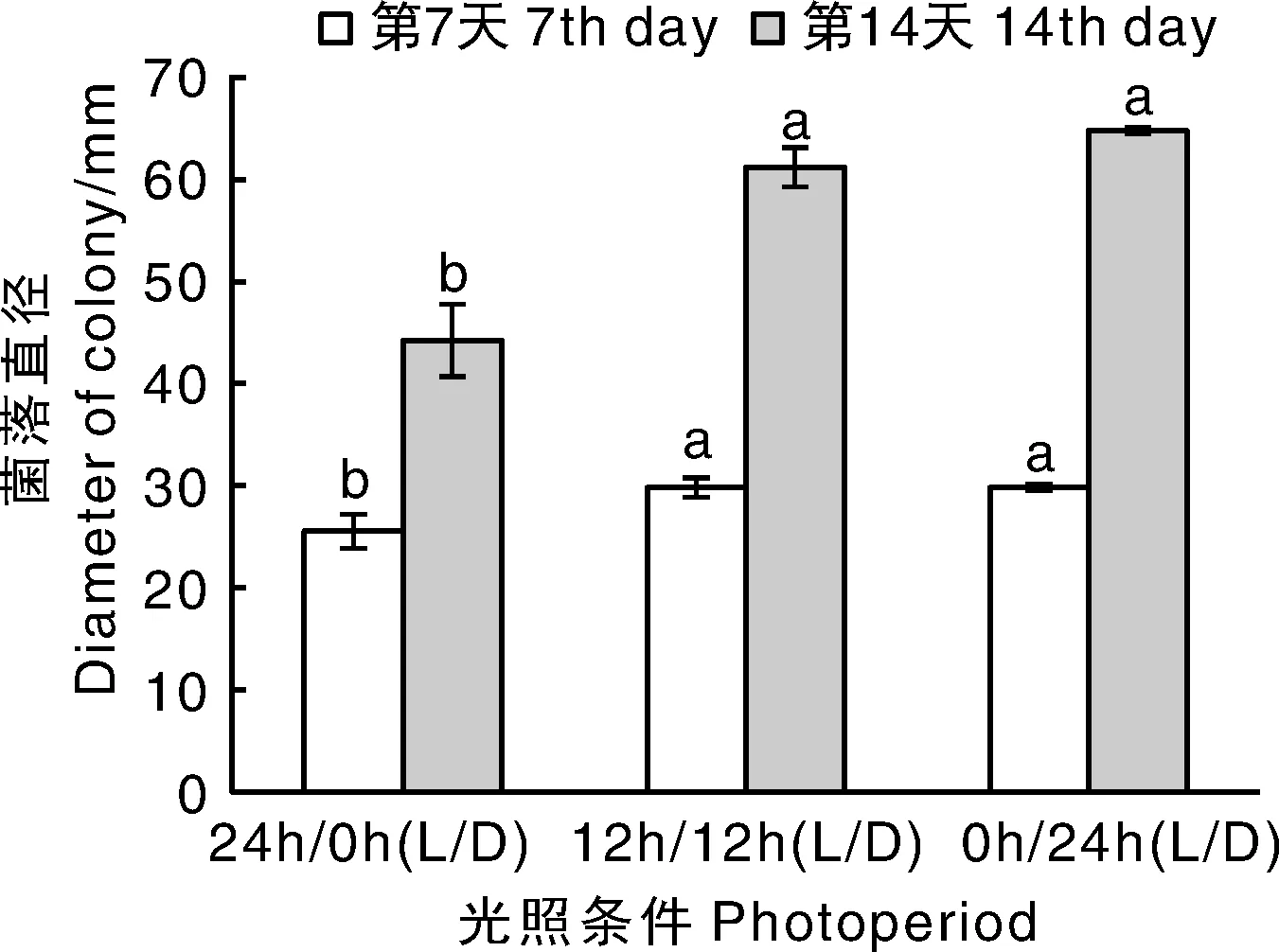
图3 光照条件对菌株VD-sy1菌落生长的影响Fig.3 Effect of photoperiod on mycelial growth of strain VD-sy1
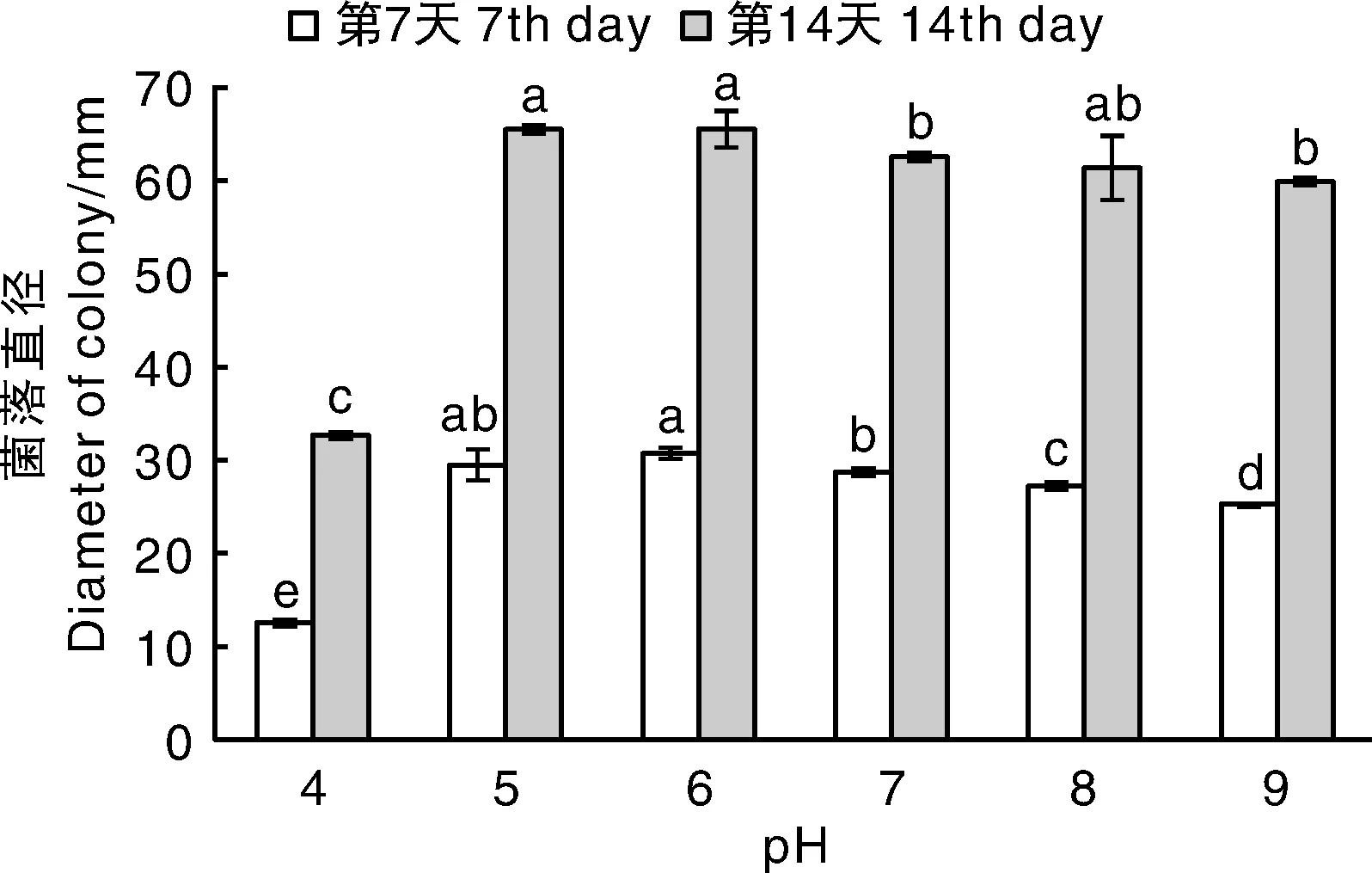
图4 pH对菌株VD-sy1菌落生长的影响Fig.4 Effect of pH of medium on mycelial growth of strain VD-sy1
菌株VD-sy1以蔗糖培养基上菌落生长最快,为4.25 mm·d-1,与乙醇和甘露醇培养基上菌落生长相当,显著优于果糖、麦芽糖和半乳糖(图5);以酵母膏培养基上菌落生长最快,为4.06 mm·d-1,其次为脯氨酸、胰蛋白胨、甘氨酸、谷氨酰胺,再次是硝酸钾,均显著优于硫酸铵、牛肉浸膏和氯化铵(图6)。

1,半乳糖;2,可溶性淀粉;3,甘露醇;4,果糖;5,麦芽糖;6,葡萄糖;7,山梨醇;8,乙醇;9,蔗糖。1, Galactose; 2, Starch; 3, Mannitol; 4, Fructose; 5, Maltose; 6, Glucose; 7, Sorbitol; 8, Ethanol; 9, Sucrose.图5 不同碳源条件对菌株VD-sy1菌落生长的影响Fig.5 Effect of carbon sources on mycelial growth of strain VD-sy1

1,甘氨酸;2,谷氨酰胺;3,脯氨酸;4,酵母膏;5,硫酸铵;6,牛肉浸膏;7,胰蛋白胨;8,氯化铵;9,硝酸钾。1, Glycine; 2, Glutamine; 3, Proline; 4, Yeast; 5, Ammonium chloride; 6, Beef extract; 7, Casein tryptone; 8, Ammonium chloride; 9, Potassium nitrate.图6 不同氮源条件对菌株VD-sy1菌落生长的影响Fig.6 Effect of nitrogen sources on mycelial growth of strain VD-sy1
3 讨论
目前,多数研究认为茄子黄萎病的病原菌为大丽轮枝菌(VerticilliumdahliaeKleb)[11,18-22],但也有文献报道为黑白轮枝菌(Verticilliumalbo-atrum)[23]。本研究中,将分离自浙江省绍兴市茄子田黄萎病病株的病原菌鉴定为大丽轮枝菌(数据未显示),且利用大丽轮枝菌落叶型和非落叶型特异性引物对对病原菌菌株进行了PCR扩增,结果显示,5个菌株均属于落叶型。
大丽轮枝菌是土壤中常见的一种真菌,适应性极强。张辉[11]认为,茄子黄萎病病菌扬州菌株VD9-yz1和VD9-yz2在20~25 ℃生长较快,30 ℃略有生长,33 ℃生长停止;张武军等[18]认为,四川雅安株系在10~30 ℃均可生长,且在22.5 ℃时生长最快;董国菊[24]认为山西晋中株系在5~30 ℃均可生长,适温范围为20~25 ℃,最适温度为25 ℃,超过30 ℃则不能生长。本研究结果表明,大丽轮枝菌浙江绍兴株系VD-sy1在10~32 ℃均能生长,在25 ℃菌落生长最快,而在35℃菌落停止生长,与上述研究的报道结果基本一致。张辉[11]研究表明,江苏扬州株系pH适应范围很广,在pH 5.5和pH 8.0时菌丝仍能快速生长,且在pH 6.5~7.0时最好;张武军等[18]认为,四川雅安株系的菌丝在pH 4.0~9.0均可生长,以pH 7.0时生长最快,pH 4.0~7.0范围内菌落直径随pH增大逐渐增大,pH 7.0~9.0菌落直径随pH增大逐渐减小;董国菊[24]研究认为,山西晋中株系的pH适应范围很广,在pH 4.5~9.0均可生长,且以pH 6.0~7.0最佳,这与本研究结果略有出入,本研究的浙江绍兴株系有较宽的酸碱度范围,在pH 4.0~9.0均能较好生长,且在pH 5.0~9.0差异不显著,但均显著快于pH 4.0。张武军等[18]报道四川雅安株系对碳源的利用以蔗糖较好,对氮源的利用以KNO3最好;董国菊[24]报道山西晋中株系在以蔗糖和乳糖为碳源的培养基上菌丝生长最好,而在氮源利用上,无论是硝态氮、氨态氮中菌丝均能生长,且以蛋白胨生长最好,而在本研究的浙江绍兴株系则以蔗糖为碳源和以酵母膏为氮源的培养基上菌丝生长较快,在以半乳糖为碳源和以氯化铵为氮源的培养基上生长较慢,这可能与菌株差异、菌株采集地理或生理性差异、所选择的碳、氮源不同等有关。
目前,大丽轮枝菌引起的茄子黄萎病在世界各地均有发生,且曾在日本和美国大面积发生及流行,防治非常困难,造成的经济损失惨重[25-26]。现有病害防控试验表明,水旱轮作、与豆科或瓜类等旱旱轮作3年以上、土壤热处理、嫁接、植株落叶前拔除病株等措施均可防控该病害[11,27],而用石灰氮和稀硫酸调节土壤pH效果不明显(pH 4.0以下发病减少,但亦明显影响了茄苗生长,而pH 5.0~9.0对病害防控效果不大)[27]。本文通过对茄子黄萎病病菌温度、光照、pH、碳源、氮源等生物学特性的分析,为进一步研究浙江省该类病害的发生规律和防控策略提供了参考依据。

