实时定量PCR法快速检测水产品中的副溶血性弧菌
陈 琳,周青青,顾 青,*,郦 萍
(1.浙江工商大学 浙江省食品微生物技术研究重点实验室,浙江 杭州 310018; 2.杭州娃哈哈集团有限公司,浙江 杭州 310018)
副溶血性弧菌又称肠炎弧菌,是一种广泛分布在海洋和水产品中的嗜盐性革兰氏阴性菌,在腌肉、咸菜等高盐制品中也可检出[1]。若含有该菌的水产品未煮熟或处理不当,食用后极容易引起食物中毒[2]。因此,快速高效地检测水产品中的副溶血性弧菌[3],对于及时诊断和降低此类风险至关重要。
目前,食品中副溶血性弧菌的检测方法主要可分为2类:一类是微生物平板计数方法;另一类是常规的PCR检测[4]。平板计数方法操作复杂,耗时;常规的PCR检测方法需要从反应体系中吸取产物做电泳,转移过程中易污染,从而造成假阳性,而且耗费时间[5]。随机扩增多态性分析(RAPD)是建立在PCR基础之上的一种可对整个未知序列的基因组进行多态性分析的分子技术,具有退火温度低、核苷酸引物与模板的结合稳定、扩大引物配对的随机性、检出率高、简单易操作、省时省力的特点[6]。实时定量PCR技术利用荧光信号实时监测PCR进程,直接进行定量分析[7],快速,准确,高效。
浙江省地处我国东南沿海长江三角洲南翼,水产品资源丰富。近年来,由副溶血性弧菌引起的食物中毒是该省报告发病最多的食物中毒病种。相关报告显示,浙江省细菌性食物中毒案例中, 43.06%为由副溶血性弧菌引起的食物中毒[8]。本文从20株副溶血性弧菌的基因中找出特异性高的序列,设计引物,建立一种基于荧光定量PCR快速检测副溶血性弧菌的方法,并通过对部分市售水产品中的副溶血性弧菌污染进行检测,测试该方法的可行性。
1 材料与方法
1.1 试验材料
1.1.1 试验菌株
副溶血性弧菌:本实验室从浙江、福建、山东等地分离到175株副溶血性弧菌,根据GB 4789.7—2013验证为副溶血性弧菌,由本实验室保藏。样本来源覆盖食物中毒病患和不同类别的水产品,如樱花虾、螠蛏、牡蛎、蛤蜊、花蛤、泥螺、盔螺、竹蛏、海螺、鲳鱼、墨吉对虾、明虾、独角对虾、灰背虾、小龙虾、竹蛏,具有较好的代表性。
其他菌株:拟态弧菌VibriomimicusATCC33653、创伤弧菌VibriovulnificusATCC27562,购于中国普通微生物菌种保藏管理中心(CGMCC);大肠埃希菌EscherichiacoliATCC 29877、枯草芽孢杆菌BacillussubtilisATCC6633、金黄色葡萄球菌StaphylococcusaureusATCC6538、沙门氏菌SalmonellaentericCMCC50760、植物乳杆菌LactobacillusplantarumZJ191、发酵乳杆菌LactobacillusfermentumZJ236,均为本实验室保存。
1.1.2 主要仪器
7500实时荧光定量PCR系统,赛默飞世尔科技有限公司;ABI 9700 PCR系统,赛默飞世尔科技有限公司;3K30台式高速冷冻离心机,德国西格玛有限公司;SW-CJ-2FD超净台,上海博迅公司;MJ PCT220 PCR仪,美国伯乐公司;7415 Nano核酸蛋白分析仪,英国捷恩维公司;Gel Doc XR+凝胶成像系统,美国伯乐公司。
1.2 试验方法
1.2.1 菌株培养
将实验室保藏的175株副溶血性弧菌菌株,以2%的接种量接种到APW液体培养基(pH 8.5),37 ℃培养18 h。拟态弧菌、创伤弧菌、大肠埃希菌、枯草芽孢杆菌、金黄色葡萄球菌、沙门氏菌,以2%的接种量接种到LB培养基中,37 ℃培养18 h。植物乳杆菌、发酵乳杆菌,以1%的接种量接种到MRS培养基中,37 ℃培养18 h。
1.2.2 DNA提取
取含有副溶血性弧菌及对照菌株的培养液以10 000 r·min-1的速度离心2 min,用0.85%无菌生理盐水清洗,使用UNIQ-10柱式细菌基因组DNA分离试剂盒[生工生物工程(上海)股份有限公司]提取基因组DNA,用核酸蛋白分析仪检测提取的DNA质量和浓度。
1.2.3 RAPD-PCR扩增
从175株副溶血性弧菌菌株中随机选取13株进行试验,以拟态弧菌、创伤弧菌、大肠埃希菌、枯草芽孢杆菌为对照菌株,选用S1引物(5’-CAACGTGAAAAAATTATTATTCGC-3’)进行RAPD-PCR扩增。RAPD-PCR反应体系为25 μL: 1×PCR缓冲体系(50 mmol·L-1KCl,10 mmol·L-1Tris-HCl,pH值8.3),3 mmol·L-1MgCl2,0.2 mmol·L-1dNTP,1.0 μmol·L-1S1引物,1 UTaq聚合酶及50 ng DNA模板。反应程序:94 ℃ 变性1 min,60 ℃ 退火40 s,72 ℃ 延伸35s,45个循环;72 ℃延伸7 min。扩增产物用质量分数为1.5%的琼脂糖凝胶电泳鉴定,重复3次。
1.2.4 副溶血性弧菌菌株特异PCR引物设计
经RAPD-PCR检测,在13株副溶血性弧菌中均发现了一个由S1引物扩增的普通DNA片段,将此片段纯化、克隆、测序,利用Primer Premier 5.0软件设计一对特异引物SF和SR。
1.2.5 设计引物的特异性和敏感性测试
从175株副溶血性弧菌菌株中随机选取20株进行试验,以拟态弧菌、创伤弧菌、大肠埃希菌、枯草芽孢杆菌为对照菌株,选用设计的引物,采用1.2.3节所述的25.0 μL PCR扩增体系进行PCR反应。PCR扩增程序: 94 ℃ 变性3 min,60 ℃ 退火30 s,72 ℃ 延伸45 s,30个循环;72 ℃延伸5 min。扩增产物用质量分数为1.5%的琼脂糖凝胶电泳鉴定,重复3次。
1.2.6 实时荧光定量PCR检测
在1.2.5节所述的PCR反应体系基础上,加入1.25 μL SYBR绿色Ⅰ荧光染料(Sigma,5 mL)(20×),从1.2.5节所选的20株副溶血性弧菌菌株中随机挑选4株,以拟态弧菌、创伤弧菌、大肠埃希菌、枯草芽孢杆菌、金黄色葡萄球菌、沙门氏菌、植物乳杆菌、发酵乳杆菌为对照菌株,进行荧光定量PCR扩增。PCR程序: 95 ℃预变性3 min;95 ℃变性25 s,60 ℃退火25 s,72 ℃延伸30 s,40个循环;75 ℃ 延伸30 s。
以连续稀释10倍的已知量(5 fg~50 ng)的副溶血性弧菌基因组DNA为模板进行荧光定量PCR扩增,以副溶血性弧菌已知的菌落数对数值为横坐标、荧光定量PCR荧光信号的荧光值为纵坐标绘制标准曲线,建立副溶血性弧菌荧光定量PCR检测标准曲线。
1.2.7 实时荧光定量PCR方法与国家标准方法的比较
从杭州某水产市场采集新鲜虾、蛤蜊、蟹等水产品20份,每份样品用无菌水浸泡1 h,取1 g样本接种10 mL APW溶液(1%生理盐水、1%蛋白胨),37 ℃、150 r·min-1振荡培养1 h,收集菌体,提取基因组DNA,进行实时荧光定量PCR检测。同时,参照国家标准GB 4789.7—2013方法对样品进行检测。
2 结果与分析
2.1 RAPD-PCR扩增产物的特异性
经核酸蛋白分析仪测定,所提取的副溶血性弧菌及对照菌株的DNAD280值都在1.6~1.8,可满足试验要求。13株副溶血性弧菌和4株对照菌株的RAPD-PCR扩增结果如图1所示,13株副溶血性弧菌在605 bp处均有目的条带产生,且条带单纯,而拟态弧菌、创伤弧菌、大肠埃希菌、枯草芽孢杆菌中均无对应条带扩增,说明605 bp的条带是副溶血性弧菌的特异性扩增片段。
2.2 副溶血性弧菌特异PCR引物设计与验证
取2.1节所述的605 bp片段进行纯化、克隆、测序,将其核苷酸序列在NCBI数据库(http://www.ncbi.nlm.nih.gov)上进行比对,结果显示,与副溶血性弧菌RIMD 2210633 DNA(GenBank登录号为BA000031)的一致性为99%,在副溶血性弧菌基因组中,仅发现位于1 365 448~1 366 047 bp位置片段的一个副本。根据该片段序列,设计一对副溶血性弧菌特异性PCR引物:SF,5’-GTGACATTGACGCTTGGGATT-3’;SR,5’-TGATGGTGGACGCTTTC-3’。
选用设计的引物,对随机挑选的20株副溶血性弧菌和4株对照菌株进行PCR扩增,结果如图2所示,20株副溶血性弧菌在352 bp处均有目的条带产生,而4株对照菌株中均无条带扩增,验证了所设计引物SF和SR的特异性。
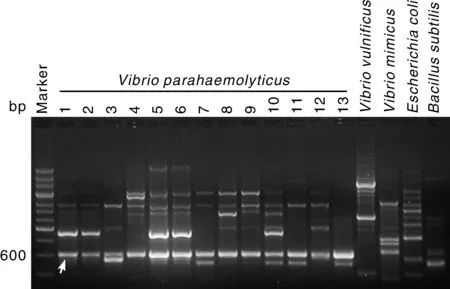
Marker为DNA Marker DL2000,1~13为不同来源的副溶血性弧菌株,其他通道为对照菌株。箭头所示为RAPD-PCR扩增出的副溶血性弧菌特异性片段。Marker: DL2000. Lanes 1-13, V. parahaemolyticus strains from different sources; Control: The other lanes. The arrow indicated the specific fragment amplified from V. parahaemolyticus strains by RAPD-PCR.图1 副溶血性弧菌及对照菌株的RAPD-PCR扩增结果Fig.1 RAPD-PCR amplification result of V. parahaemolyticus and reference strains
随机挑选4株副溶血性弧菌及8株对照菌株,以SF和SR为引物,实时定量PCR扩增的结果如图3所示,4株副溶血性弧菌均有特异性信号,而8株对照菌株均未观察到信号。连续稀释的DNA模板中,当模板量为50 ng~50 fg时均可以检测到信号,当模板量进一步降低到5 fg时,无信号产生(图4)。经测试,纯化的DNA的最小检测灵敏度为50 fg。
2.3 实时定量PCR检测副溶血性弧菌的标准曲线
以连续稀释10倍的已知量的副溶血性弧菌基因组DNA为模板进行荧光定量PCR扩增,以副溶血性弧菌菌落数的对数为横坐标,以荧光值为纵坐标绘制标准曲线(图5),标准曲线方程为y=-3.536x+38.04(R2=0.995 9)。
2.4 实时定量PCR方法与国家标准方法的比较
分别利用本文构建的实时定量PCR方法和国家标准中(GB 4789.7—2013)的平板菌落计数法对20份市售样品进行检测(表1)。实时定量PCR在20份样品中检出副溶血性弧菌含量大于105CFU·mL-1的样品2份,含量在103~104CFU·mL-1的样品4份,阳性检出率30%。经检验,2种方法的结果无显著差异。实时定量PCR方法的检测时间为1.5 h,而平板计数法的检测时间在48~72 h,说明实时定量PCR方法检测水产品中的副溶血性弧菌更加快速。
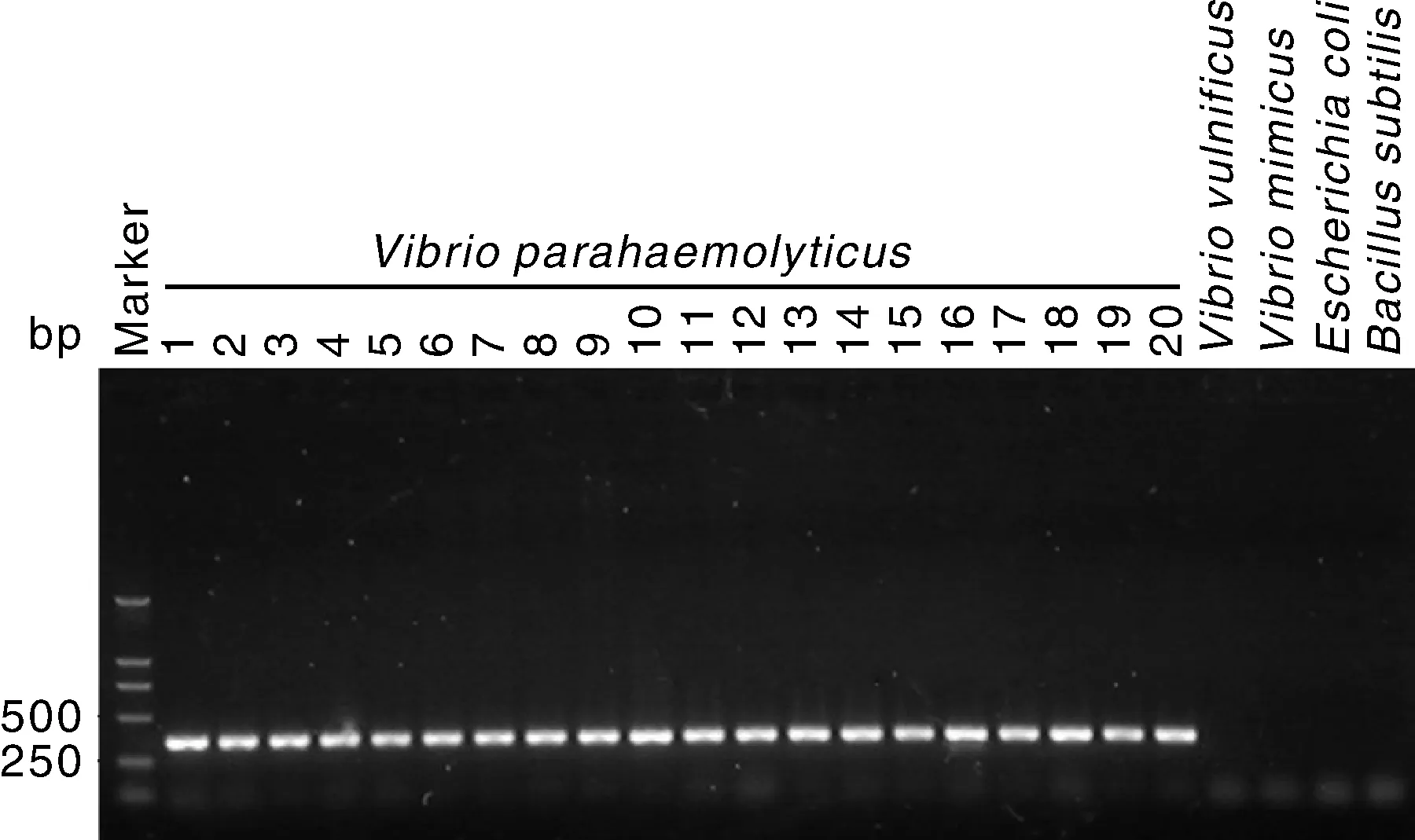
Marker为DNA Marker DL2000,1~20为不同来源的副溶血性弧菌菌株,其他通道为对照菌株。Marker: DL2000. Lanes 1-20, V. parahaemolyticus strains from different sources; Control, The other lanes.图2 引物SF和SR检测副溶血性弧菌的特异性Fig.2 Specificity test of primers SF and SR for detection of V. parahaemolyticus

样本1~4,副溶血性弧菌;5,拟态弧菌;6,创伤弧菌;7,大肠埃希菌;8,枯草芽孢杆菌;9,金黄色葡萄球菌;10,沙门氏菌;11,植物乳杆菌;12,发酵乳杆菌。Sample 1-4, Vibrio parahemolyticus; 5, Vibrio mimicus ;6, Vibrio vulnificus; 7, Escherichia coli; 8, Bacillus subtilis; 9, Staphylococcus aureus;10, Salmonella enteric; 11, Lactobacillus plantarum; 12, Lactobacillus fermentum.图3 实时PCR检测引物SF和SR的特异性Fig.3 Specificity test of primers SF and SR for real time PCR assay
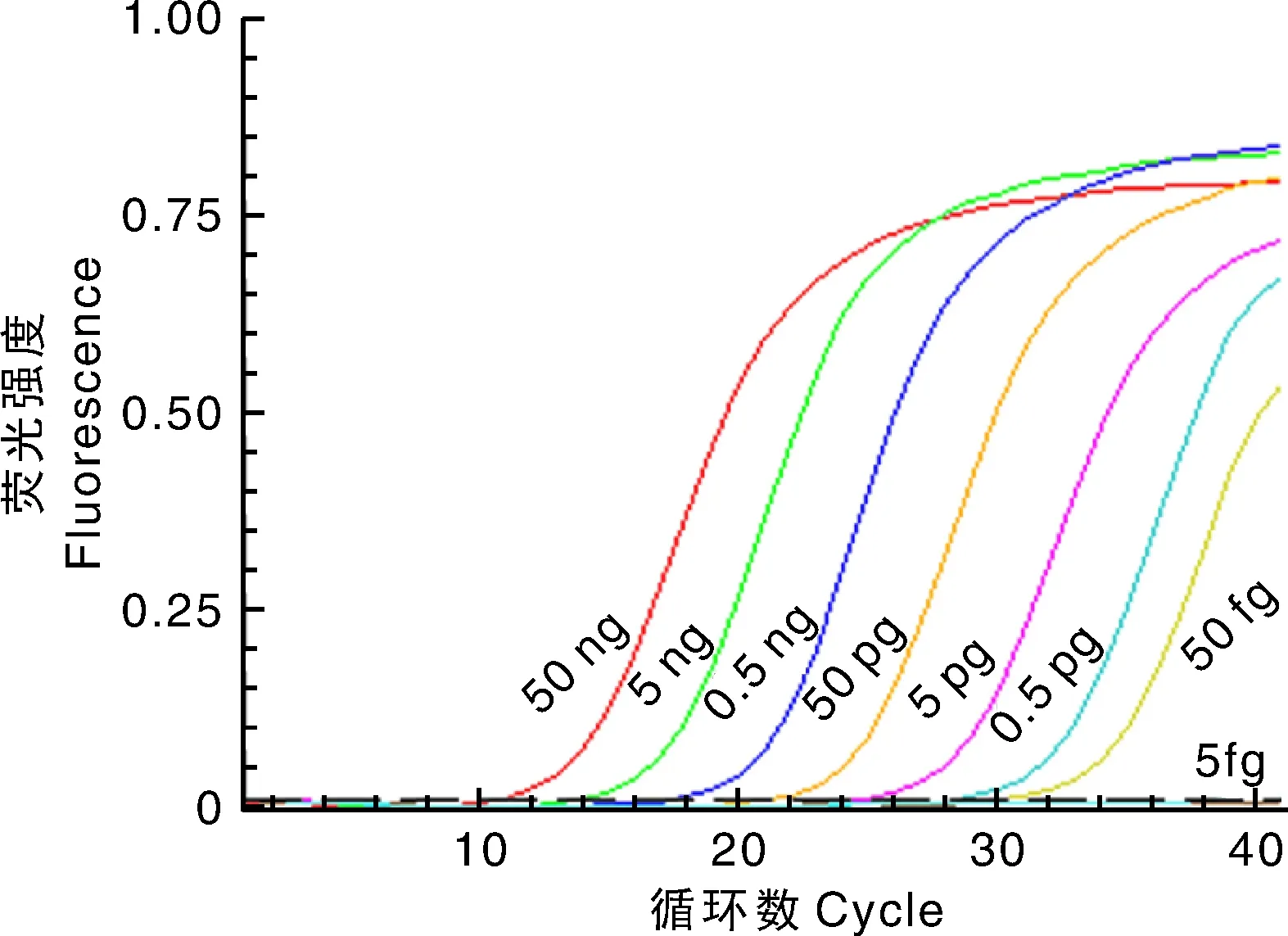
图4 不同量的副溶血性弧菌DNA模板下荧光信号的动力学Fig.4 Kinetics of fluorescence signal at different quantities of template DNA of V. parahaemolyticus
3 讨论
实时荧光定量PCR技术在PCR反应体系中加入荧光染料,实时在线监测整个PCR过程[9],具有反应快速、重复性好、灵敏度高、特异性强的特点[10]。荧光定量PCR可以检测多种致病菌,近年来,在农业卫生检测诊断中得到了广泛应用:荧光定量PCR方法可以快速检测原料乳中的大肠埃希菌,对原料乳中大肠埃希菌的检测限为1.7×103CFU·mL-1[11];采用荧光定量PCR法可快速检测蔬菜中的沙门氏菌,沙门氏菌的最低检出浓度为18 CFU·mL-1[12]。

图5 实时定量PCR检测副溶血性弧菌的标准曲线Fig.5 Standard curve for determination of V. parahaemolyticus by real-time PCR

表1 检测样品中副溶血性弧菌的计量结果(对数值)
关于副溶血性弧菌的检测技术已有很多报道。有研究人员从副溶血性弧菌toxR基因中找出一段特异性高的序列设计PCR引物,建立一种常规的PCR检测方法[13];也有研究人员以tlh基因为靶点,通过荧光定量PCR技术检测牡蛎组织和地幔液中的副溶血性弧菌[14];还有研究人员以副溶血性弧菌毒素基因为靶点,通过实时PCR方法测定海水和短颈蛤匀浆中的副溶血性弧菌,检出限为36 CFU·mL-1[15]。本文采用随机扩增多态性分析方法鉴定特异性片段,选取目的条带,进行克隆测序,设计出新的特异性引物,而此段序列还未被报道过。
经对比,本文建立的实时定量PCR方法快速、高效,与国家标准中给定的方法相比,显著缩短了检测时间,整个检测可在2 h内完成,非常适用于水产品中副溶血性弧菌的检测,具有推广及应用价值。

