苯并芘体外对人胎盘滋养细胞增殖和凋亡的影响及其机制
邹晓萍,吴维光
流行病学调查显示,环境污染可导致不良妊娠结局[1]。多环芳烃类(polycyclic aromatic hydrocarbons, PAHs)是常见的空气污染物,主要来源于煤炭燃烧、汽车尾气、烟草烟雾和室内烹饪产生的油烟,且易在土壤、水源和农作物中残留蓄积。苯并(a)芘[(benzo(a)pyrene, BaP)]是PAHs中最具有代表性的一种环境污染物,能增加胎停育、流产、早产、死产的发生率[3]。动物实验表明,BaP可影响胎盘滋养细胞的功能,进而影响胎盘功能[4-6],但具体机制还有待进一步阐明。PAHs进入体内后,与细胞内芳香烃受体(aryl hydrocarbon receptor, AhR)结合,AhR进入细胞核内后与芳香烃受体核转位蛋白(AhR nuclear translocation, ARNT)结合,启动下游一系列靶基因转录和代谢酶的活化[2]。在流产及早产的胎盘绒毛中AhR呈高表达。本研究以AhR阳性表达的人胎盘滋养细胞系JEG-3细胞为靶细胞,观察BaP 体外对JEG-3细胞增殖和凋亡的作用,同时观察AhR和 ARNT基因表达的变化,探讨BaP损害滋养细胞的作用及可能机制。
1 材料与方法
1.1 材料 来源于人胎盘滋养细胞的JEG-3细胞购自中科院细胞库,本科实验室保存。BaP购自美国Sigma公司,DMEM培养液和胎牛血清购自美国Gibco公司,Trizol和FITC-annexin V凋亡试剂盒购自Invitrogen公司,MTT试剂盒购自晶美公司,及转录试剂盒和SYBR Green Real-time PCR Master Mix购自日本TaKaRa 公司,鼠抗人AhR单克隆抗体和鼠抗人ARNT单克隆抗体购自美国Abcam公司,鼠抗人β-Actin单克隆抗体购自美国Genscript公司,辣根抗氧化物酶(HRP)标记的山羊抗鼠IgG购自美国KPL公司,增强型化学发光(ECL)试剂盒和BSA蛋白定量试剂盒购自北京康为世纪生物科技有限公司,PCR寡核苷酸引物由大连宝生物工程公司设计并合成。
1.2 方法
1.2.1 细胞培养及染毒 JEG-3细胞应用含100 mg/L胎牛血清的DMEM培养液,在37 ℃、50 ml/L CO2、饱和湿度条件下培养。取对数生长期细胞,细胞按1×106/孔接种于6孔细胞培养板中,细胞贴壁生长24 h后,培养液中加入二甲亚砜溶解的BaP,终浓度分别为0 μmol/L(对照组)、10 μmol/L(BaP低剂量组)、20 μmol/L(BaP中剂量组)和30 μmol/L(BaP高剂量组)。各组细胞在37 ℃、50 ml/L CO2、饱和湿度条件下继续培养24 h后,收集细胞进行检测。染毒实验重复3次。
1.2.2 MTT检测 将细胞浓度调整为5×105/ml,接种于96孔细胞培养板中,每组细胞设3个平行孔。细胞培养贴壁后,更换无血清DMEM培养液继续培养12 h。更换含100 mg/L胎牛血清的DMEM培养液,于37 ℃、50 ml/L CO2条件下继续培养72 h。加入20 μl浓度为5 mg/ml的四甲基偶氮唑蓝液,继续培养4 h,弃上清液后每孔加入150 μl的二甲基亚砜,振荡10 min,在酶标仪测定490 nm处吸光度值(A值)。细胞增殖率(%)=(实验组平均A值)/(对照组平均A值)×100%。
1.2.3 流式细胞仪检测 收集细胞,预冷的PBS液洗涤后,预冷的结合缓冲液重悬细胞,调整细胞浓度为5×106个/ml。取100 μl 的细胞悬液,加到流式管中,再加入5 μl 的Annexin V,混匀后室温下避光孵育15 min,再加入10 mg/L碘化丙锭染液5 μl。作用5 min后流式细胞仪检测细胞早期凋亡数,CELL Quest软件分析细胞凋亡率。
1.2.4 Real-time qPCR检测 Trizol试剂提取细胞总RNA,紫外分光光度仪测定A260/A280比值,以检测RNA样品的纯度和浓度。反转录试剂盒将RNA反转录为cDNA。应用SYBR Premix Ex Taq试剂盒进行实时荧光定量PCR分析,以磷酸甘油酸脱氢酶(GAPDH)为内参照。AhR上游引物:TGTCCTCTAAGGTGTCTGCTGCTGGA,下游引物:AACCCAACTGAGGTGGAAGTATTGA,扩增片段长度为130 bp;ARNT上游引物:CATCCACTGACGGCTCCTACAA,下游引物:ATACACCACTCGGCCAGTCTCAC,扩增片段长度为122 bp;GAPDH上游引物:GCACCGTCAAGGCTGAGAAC,下游引物:TGGTGAAGACGCCAGTGGA,扩增片段为138 bp。反应条件:95 ℃预变性3 min,95 ℃变性5 s,60 ℃退火20 s,共40个循环,65 ℃延伸15 s。目的基因表达量用2-ΔΔCt表示。
1.2.5 Western blot检测 蛋白裂解液提取细胞总蛋白,BSA蛋白定量试剂盒进行蛋白定量,取20 μg总蛋白后进行10%的SDS-PAGE凝胶电泳,分离后蛋白电转移至PVDF膜上,50 g/L脱脂奶封闭,洗膜后加及一抗(1∶300),于4 ℃孵育过夜,洗膜后再加入HRP标记的山羊抗鼠IgG(1∶1000),室温下孵育1 h。洗膜后ECL发光压片成像。以β-actin作为内参照,应用Quantity One软件,将条带转化为灰度值,蛋白表达量=目的条带灰度值/内参条带灰度值。

2 结 果
2.1 细胞增殖率检查结果 空白对照组、BaP低剂量组、BaP中剂量组、BaP高剂量组细胞增殖率见表1。与对照组比较,BaP低剂量组细胞增殖率差异无统计学意义(P=0.794);与BaP低剂量组比较,BaP中剂量组细胞增殖率降低,差异有统计学意义(P=0.013);与BaP中剂量组比较,BaP高剂量组细胞增殖率降低,差异有统计学意义(P=0.025)。
2.2 细胞凋亡率检测结果 空白对照组、BaP低剂量组、BaP中剂量组、BaP高剂量组细胞凋亡率见表1。与空白对照组比较,BaP低剂量组细胞凋亡率差异无统计学意义(P=0.293);与BaP低剂量组比较,BaP中剂量组细胞凋亡率增高,差异有统计学意义(P=0.003);与BaP中剂量组比较,BaP高剂量组细胞凋亡率增高,差异有统计学意义(P=0.023)。
2.3 AhR mRNA检测结果 空白对照组、BaP低剂量组、BaP中剂量组、BaP高剂量组AhR mRNA表达量见表1。与空白对照组比较,BaP低剂量组AhR mRNA表达量增高,差异有统计学意义(P=0.046);与BaP低剂量组比较,BaP中剂量组AhR mRNA表达量增高,差异有统计学意义(P=0.015);与BaP中剂量组比较,BaP高剂量组AhR mRNA表达量增高,差异有统计学意义(P=0.023)。
2.4 ARNT mRNA检测结果 空白对照组、BaP低剂量组、BaP中剂量组、BaP高剂量组ARNT mRNA表达量见表1。与空白对照组比较,BaP低剂量组ARNT mRNA表达量增高,差异有统计学意义(P=0.037);与BaP低剂量组比较,BaP中剂量组ARNT mRNA表达量增高,差异有统计学意义(P=0.010);与BaP中剂量组比较,BaP高剂量组ARNT mRNA表达量增高,差异有统计学意义(P=0.009)。
2.5 AhR蛋白检测结果 空白对照组、BaP低剂量组、BaP中剂量组、BaP高剂量组AhR蛋白表达量见表1。与空白对照组比较,BaP低剂量组AhR蛋白表达量增高,差异有统计学意义(P=0.011);与BaP低剂量组比较,BaP中剂量组AhR蛋白表达量增高,差异有统计学意义(P=0.028);与BaP中剂量组比较,BaP高剂量组AhR蛋白表达量增高,差异有统计学意义(P=0.024)。
2.6 ARNT蛋白检测结果 空白对照组、BaP低剂量组、BaP中剂量组、BaP高剂量组ARNT蛋白表达量见表1。与空白对照组比较,BaP低剂量组ARNT蛋白表达量增高,差异有统计学意义(P=0.028);与BaP低剂量组比较,BaP中剂量组ARNT蛋白表达量增高,差异有统计学意义(P=0.021);与BaP中剂量组比较,BaP高剂量组ARNT蛋白表达量增高,差异有统计学意义(P=0.020)。
表1 观察组与对照组细胞检测结果
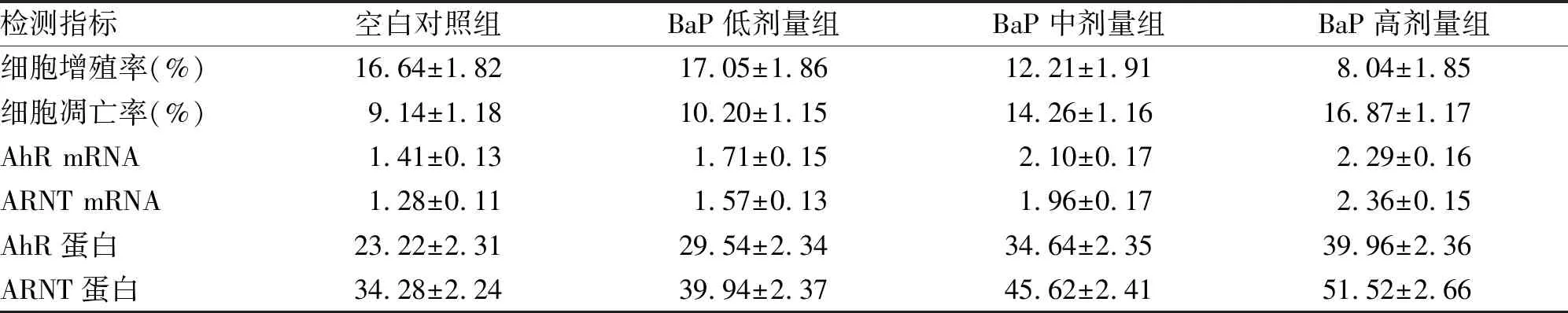
表1 观察组与对照组细胞检测结果
检测指标空白对照组BaP低剂量组BaP中剂量组BaP高剂量组细胞增殖率(%)16.64±1.8217.05±1.8612.21±1.918.04±1.85细胞凋亡率(%)9.14±1.1810.20±1.1514.26±1.1616.87±1.17AhR mRNA1.41±0.131.71±0.152.10±0.172.29±0.16ARNT mRNA1.28±0.111.57±0.131.96±0.172.36±0.15AhR蛋白23.22±2.3129.54±2.3434.64±2.3539.96±2.36ARNT蛋白34.28±2.2439.94±2.3745.62±2.4151.52±2.66
3 讨 论
芳香烃是含有苯环结构的碳氢化合物,BaP是芳香烃化合物之一。BaP为淡黄色长针状晶体,分子式为C20H12,为非极性物质,不溶于水,微溶于乙醇,但具有高脂溶性,易溶于有机溶剂,如乙醚、氯仿、甲醛、苯、丙酮、环乙烷等。BaP进入体内,经细胞色素P450混合功能氧化酶系统(cytochrome P450 enzymes, CYP450s )中的CPY1A1降解,可活化为BaP-7、8-环氧化物,通过氧化物水解酶,进一步代谢为BaP-7、8-二氢-9、10环氧化物,有极强氧化性,可引起DNA分子的氧化损伤;还可与DNA形成加合物,影响DNA复制,诱导细胞凋亡和引起基因突变[7]。研究发现,BaP可引起鼠胎盘组织CPY450活性增高、GSH-PX活性降低、超氧化物岐化酶活性增高,引起滋养细胞氧化损伤,影响胎盘的形成及功能[4-6]。体外研究也发现BaP可引起人绒毛滋养细胞DNA的损伤[8、9]。本研究发现,20 μmol/L和30 μmol/L的BaP体外诱导人胎盘滋养细胞系JEG-3细胞凋亡,抑制细胞增殖。
AhR也称二噁受体,是一种可溶性细胞浆内蛋白质,在人体多种脏器和组织细胞,如肝、肺、肾、胎盘、扁桃体、B淋巴细胞等表达。人AhR编码基因位于7号染色体的p15,基因包括10个内含子和11个外显子。AhR蛋白由805个氨基酸组成,属于螺旋-环-螺旋超家族中新发现的PAS亚家族,是一种配体激活转录因子,与多环芳烃化合物结合以前,它与两分子的热休克蛋白90(heat shock protein 90, HSP90)及其他分子形成复合物,处于休眠状态。当AhR与多环芳烃化合物结合后,AhR被激活,与胞浆中蛋白复合体解离,显露出核定位序列。AhR转位入核后与芳香烃受体核转位蛋白(AhR nuclear translocation, ARNT)形成异二聚体转录因子。ARNT也属于属于螺旋-环-螺旋转录因子超家族中的PAS亚家族,与AhR的异二聚化作用主要发生在靠近氨基末端的碱性螺旋-环-螺旋基序和PAS区。AhR-ARET异二聚体复合物与靶基因启动子区域二噁英效应元件(diocin response responsive elements, XREs)结合,进而转录一系列基因编码的外源代谢酶,产生相应生物学效应,参与组织细胞信号转导,细胞分化,细胞凋亡等。CPY1A1是AhR-ARNT复合物重要的靶基因,对环境中的毒物和化学物质代谢、调节生物节律、生殖、氧化应激等方面发挥重要作用[10-12]。AhR在人胎盘组织中的合体滋养细胞和胎盘血管内皮细胞中表达,参与了胎盘功能的调节,在维持妊娠中发挥重要的作用[13-14]。研究证实,AhR与滋养细胞的增殖和调亡密切相关,并且具有调节滋养细胞的细胞周期作用。AhR基因过表达可抑制早期滋养细胞增殖,抑制滋养细胞的侵袭能力,从而影响胚胎发育及胎盘形成[15-17]。本研究发现,BaP体外可直接诱导人胎盘滋养细胞系JEG-3细胞AhR及ARNT基因表达,是激活AhR转导通路的另一种方式。
综上所述,BaP可抑制胎盘滋养细胞增殖和诱导细胞凋亡,从而影响胎盘形成及胎盘功能,导致胎停育、流产及早产等不良妊娠结局。激活AhR信号转导通路,可能是BaP损害胎盘滋养细胞的机制之一。

