乳腺专用γ 显像的图像特征对乳腺病变的鉴别诊断价值
朱羽苑 张宏伟 谭辉 尹红燕 庞丽芳 顾宇参 严丽霞 陈曙光 石洪成
1 复旦大学附属中山医院核医学科,上海 200032;2 复旦大学附属中山医院普外科,上海 200032;3 复旦大学附属中山医院超声科,上海 200032
乳腺专用γ 显像(breast specific gamma imaging,BSGI)是一项高诊断效能的新技术,主要用于致密性乳腺及超声、钼靶诊断不明确的乳腺病例[1]。作为补充显像,其灵敏度优于钼靶,特异度优于超声和MRI[2-3]。中国女性患有致密性乳腺的比例较高,BSGI 的诊断价值尤为突出。
根据2010年美国核医学会发布的《BSGI 操作指南》1.0 版[4],乳腺影像报告和数据系统(breast imaging reporting and data system,BIRADS)主要参考病灶的放射性摄取程度、病灶形态及边缘进行诊断。已有部分研究者提出,基于上述标准,BSGI面临假阳性较高且特异性受限的问题[5-7]。Tan 等[8]和Park 等[9]曾分别使用最大肿瘤/非肿瘤比值(the ratio of tumor to non-tumor,T/NT)以及延迟相显像剂的洗脱,提高病灶诊断的特异度,但暂未进行病灶灰度分布特征的相关研究。本研究回顾性分析乳腺病灶的BSGI 图像特征,拟探讨有利于鉴别诊断乳腺病变的潜在图像特征。
1 资料与方法
1.1 一般资料
回顾性分析2014年7月至2015年6月在上海复旦大学附属中山医院核医学科进行BSGI并行后续手术治疗的中国女性乳腺患者。入选标准:①存在临床症状,如可触及乳腺包块、乳腺疼痛或乳头血性溢液,但超声和钼靶结果为阴性或不能完全解释症状者;②乳腺钼靶和(或)超声诊断模棱两可者及可疑恶性者;③BSGI 检查前活检病理明确,尚未行治疗的乳腺恶性肿瘤患者;④乳腺癌高危人群,如怀疑术后复发、直系亲属患乳腺癌等;⑤致密性乳腺行筛查者。所有入选患者均经病理证实。排除标准:BSGI 前已经行乳腺手术或放化疗的患者。患者或家属均签署了知情同意书。
1.2 显像方法
患者无需特殊准备,在患乳对侧的肘静脉或手背静脉注射99Tcm-MIBI(上海欣科医药有限公司)740 MBq,5~10 min 后嘱患者取坐位,使用乳腺专用γ 相机(Dilon 6800,Dilon Technologies,美国)分别采集双乳头尾位和侧斜位图像。每个体位采集6 min,能峰为140 keV,窗宽为±10%。
1.3 图像分析
在不知患者临床信息的情况下,由3 位有3~5年以上工作经验的核医学科医师同时在Dilon 6800 工作站上用黑白模式和(或)伪彩色模式观察病灶,记录病灶形态、病灶边缘是否清晰、灰度分布是否存在“偏心核心”、BIRADS 结果及最大T/NT[8]。
病灶的形态和边缘均为美国核医学会《BSGI操作指南》1.0 版[4]归纳的参考特征:斑片状或边缘模糊的病灶倾向于良性病变,结节状或边缘清晰的病灶倾向于恶性病变。“偏心核心”是指在病灶的非中心区域见到“星芒状”的局限性放射性摄取增高,该灰度分布特征由上海复旦大学附属中山医院核医学科首次提出,读图时能被肉眼清晰辨别,多见于乳腺腺病和纤维腺瘤等良性病变。最大T/NT 是以9 个像素ROI 分别勾画病灶及周围本底在头尾位和内外侧斜位中的放射性计数,选取2 个体位中较大的比值作为评价参数[8]。BIRADS 1~3 级诊断为良性,BIRADS 4~5 级诊断为恶性。当上述读图发生异议时,由3 位核医学医师共同商议达成一致。
1.4 统计学方法
图像特征(包括病灶形态、病灶边缘是否清晰、灰度分布特征是否存在“偏心核心”、最大T/NT和BIRADS)如提示恶性,被量化为1;如提示良性,被量化为0。灰度分布是否存在“偏心核心”因暂无成熟的经验参考,故缺乏“偏心核心”暂被量化为1,存在“偏心核心”暂被量化为0。将病灶的最大T/NT 与病理结果勾画受试者工作特征(receiver operating characteristic,ROC)曲线,获得诊断表现最佳的界值,大于或等于该界值的病灶视为恶性,量化为1,反之量化为0。病理结果中,乳腺导管上皮不典型增生作为良性病变被量化为0。
使用SPSS 20.0 软件进行统计学分析。将每个BSGI 图像特征与病理结果进行二变量秩相关分析,计算Spearman 相关系数,包括95%CI。将存在明显相关性的图像特征与病理结果进行二分类Logistic 回归分析,筛选出显著相关的图像特征。基于病灶计算所有图像特征的独立诊断效能以及上述显著相关特征的合并诊断效能(包括灵敏度、特异度、阳性预测值、阴性预测值、准确率)并勾画ROC 曲线。用MedCalc 软件行Z检验比较上述参数间的ROC 曲线,评估诊断效能的差异。P<0.05表示差异有统计学意义。
2 结果
2.1 入选病例结果
行BSGI 且乳腺病灶经手术病理确诊的女性患者有282 例,其中10 例为已确诊乳腺恶性肿瘤,且BSGI 检查前已行手术或放化疗,故予以剔除。本研究最终入组272 例患者,其中包括临床症状可疑者25 例、超声和(或)钼靶诊断模棱两可及可疑恶性者224 例、病理确诊但未行治疗者8 例、乳腺癌高危人群7 例、因致密性乳腺行筛查者8 例。患者年龄为20~89(51.63±12.43)岁,共293 个病灶,包括187 个恶性病灶(187/293,63.8%)和106 个良性病灶(106/293,36.2%)(表1)。187 个恶性病灶的最大长径为0.5~11.0 cm,其中0.5~1.0 cm 17 个、1.1~1.5 cm 43 个、1.6~2.0 cm 36 个、>2.0 cm 91 个。
2.2 最大T/NT 的最佳界值、秩相关分析及Logistic回归分析结果
病灶最大T/NT 与病理结果的ROC 曲线提示:ROC 曲线下面积为0.802(标准误:0.026;95%CI:0.750~0.853,P=0.000)。本研究中病灶最大T/NT 的最佳界值为1.75 (图1)。
二变量秩相关分析结果显示,病灶形态、病灶边缘是否清晰、灰度分布是否存在“偏心核心”(图2)、BIRADS 结果及最大T/NT(界值:1.75)都与病理结果存在显著的相关性(Spearman 相关系数分别为0.551、0.371、0.290、0.489 和0.436,均P=0.000),即结节状病灶、病灶边缘清晰、灰度分布缺乏“偏心核心”、BIRADS 4~5 级以及最大T/NT >1.75 均与恶性病灶呈正相关。
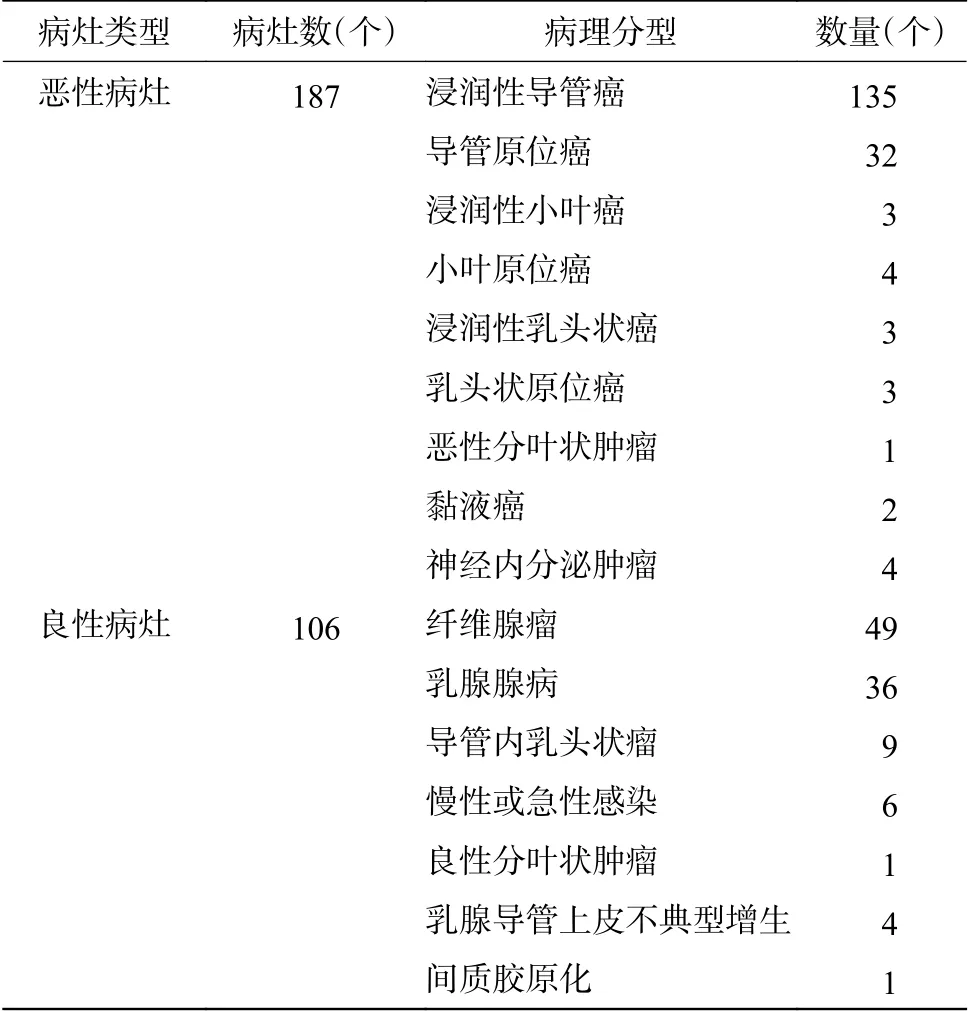
表1 入选病例的293 个乳腺病灶的病理分型Table 1 Pathological subtypes of the included 293 breast lesions
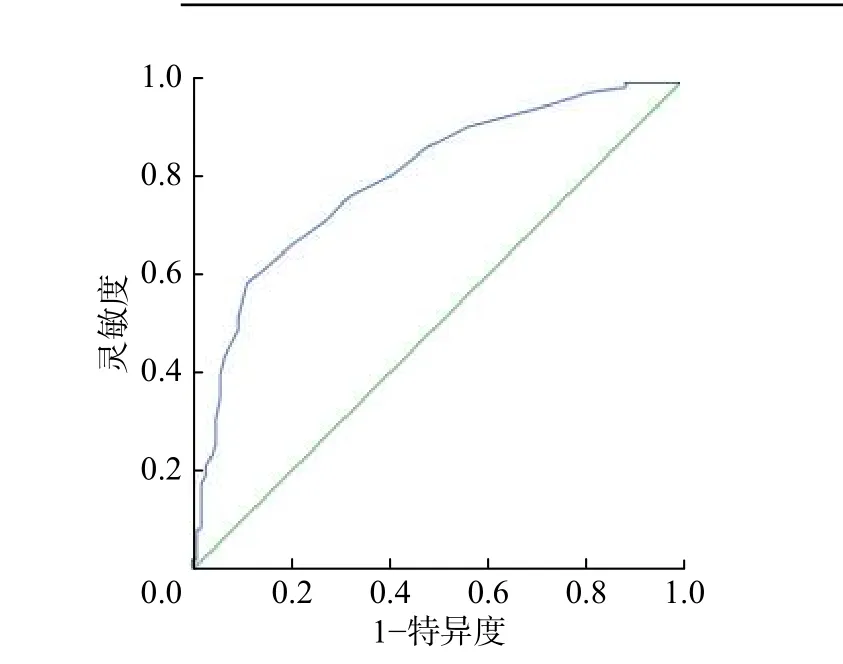
图1 乳腺病灶最大肿瘤/非肿瘤比值与病理结果的受试者工作特征曲线 Fig.1 Receiver operating characteristic curve between the maximum ratio of tumor to non-tumor and pathology for determining the best cut-off ratio of tumor to non-tumor in the diagnosis of breast cancer
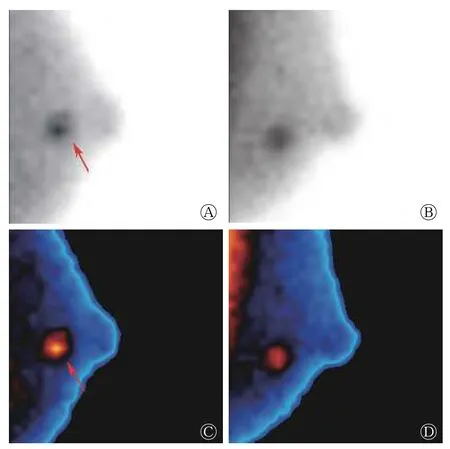
图2 乳腺病灶“偏心核心”的典型BSGI 图 患者女性,33 岁,发现左乳肿块1年,母亲有乳腺癌病史,CA125 为52.10 U/mL,AFP、CA199、CEA 均为(-),超声提示良性病变可能,大小约为1.7 cm×0.7 cm。图中,左乳结节状放射性异常浓聚灶,并见“偏心核心”(A 和C,红色箭头),左侧头尾位(A 和C)和左侧内外侧斜位(B 和D)的最大肿瘤/非肿瘤比值分别为2.0 和1.6。BSGI 诊断为BIRADS 5 级,考虑为恶性病变可能性大;术后病理为乳腺纤维腺瘤。BSGI:乳腺专用γ 显像;CA:糖类抗原;AFP:甲胎蛋白;CEA:癌胚抗原;BIRADS:乳腺影像报告和数据系统。 Fig.2 Characteristic image of "a decentered core" of the breast lesion in breast specific gamma imaging
二分类Logistic 回归分析结果显示,病灶形态(OR=0.013, 95%CI:3.664~21.846,P=0.000)、病灶边缘是否清晰(OR=2.121,95%CI:1.061~4.239,P=0.033)以及灰度分布是否存在“偏心核心”(OR=12.927,95%CI:5.415~30.863,P=0.000)均与病理结果的相关性有统计学意义,而BIRADS结果(OR=2.546,95%CI:0.944~6.867,P=0.065)和最大T/NT(界值:1.75)(OR=1.570, 95%CI:0.659~3.738,P=0.308)均与病理结果的相关性无统计学意义。
2.3 不同诊断标准的诊断效能以及基于ROC 曲线的Z 检验结果
BIRADS 结果、最大T/NT、病灶形态、病灶边缘是否清晰、灰度分布是否存在“偏心核心”对乳腺病变的诊断效能见表2。其中,病灶形态、病灶边缘是否清晰、灰度分布是否存在“偏心核心”对乳腺病变的合并诊断灵敏度、特异度和准确率分别为88.2%(165/187)、81.1%(86/106)和85.7%(251/293)。
不同诊断标准的ROC 曲线参见图3。图中,BIRADS 结果的曲线下面积为0.731(标准误:0.033;95%CI:0.667~0.795;P=0.000);最 大T/NT(界值:1.75)的曲线下面积为0.722(标准误:0.032;95%CI:0.659~0.785;P=0.000);病灶形态、病灶边缘是否清晰、灰度分布是否存在“偏心核心”的曲线下面积分别为0.752(标准误:0.032;95%CI:0.689~0.815;P=0.000)、0.693 (标准误:0.032;95%CI:0.630~0.756;P=0.000)和0.603 (标准误:0.036;95%CI:0.533~0.673;P=0.003)。病灶形态+病灶边缘是否清晰+灰度分布是否存在“偏心核心”合并诊断的曲线下面积为0.847(标准误:0.026;95%CI:0.796~0.898;P=0.000)。上 述ROC 曲 线 的Z检验结果提示:BIRADS 结果与最大T/NT(界值:1.75)的诊断效能差异无统计学意义(Z=0.379,P=0.704);病灶形态与病灶边缘是否清晰的诊断效能差异无统计学意义(Z=1.942,P=0.052);灰度分布是否存在“偏心核心”与病灶形态、病灶边缘是否清晰的诊断效能差异均有统计学意义(Z=3.574、2.316,均P<0.05);而病灶形态、病灶边缘是否清晰、灰度分布是否存在“偏心核心”三者联合诊断的效能均优于三者单独诊断的效能(Z=4.380、4.816 和9.275,均P<0.05),且 优 于BIRADS 结果和最大T/NT(界值:1.75)的单独诊断效能(Z=4.079、4.090,均P<0.05)。
2.4 假阴性及假阳性病灶
基于BIRADS 的独立诊断,本研究293 个病灶中有66 个病灶被误诊,包括22 个假阴性病灶[7 个低级别浸润性导管癌、10 个导管原位癌、1 个黏液癌、1 个恶性分叶状肿瘤和3 个浸润性小叶癌(上述病灶最大径均>1 cm)]和44 个假阳性病灶(22 个纤维腺瘤、8 个乳腺腺病、5 个导管内乳头状瘤、5 个感染性病变、2 个乳腺导管上皮不典型增生、1 个良性分叶状肿瘤和1 个间质胶原化)。
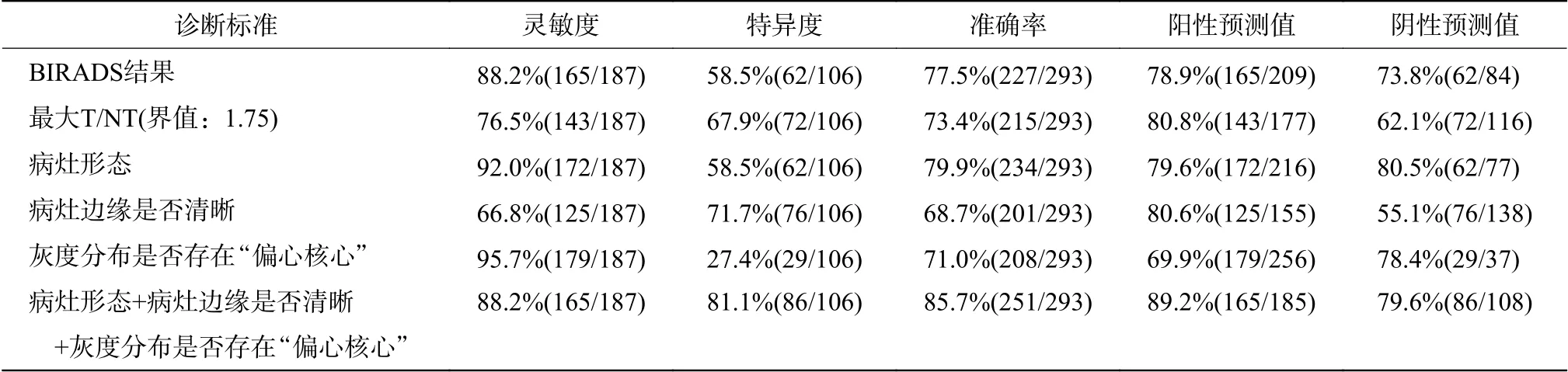
表2 BSGI 的图像特征中不同诊断标准对乳腺病变的诊断效能Table 2 Diagnostic efficacy of the different diagnostic standards in image feaures of breast specific gamma imaging
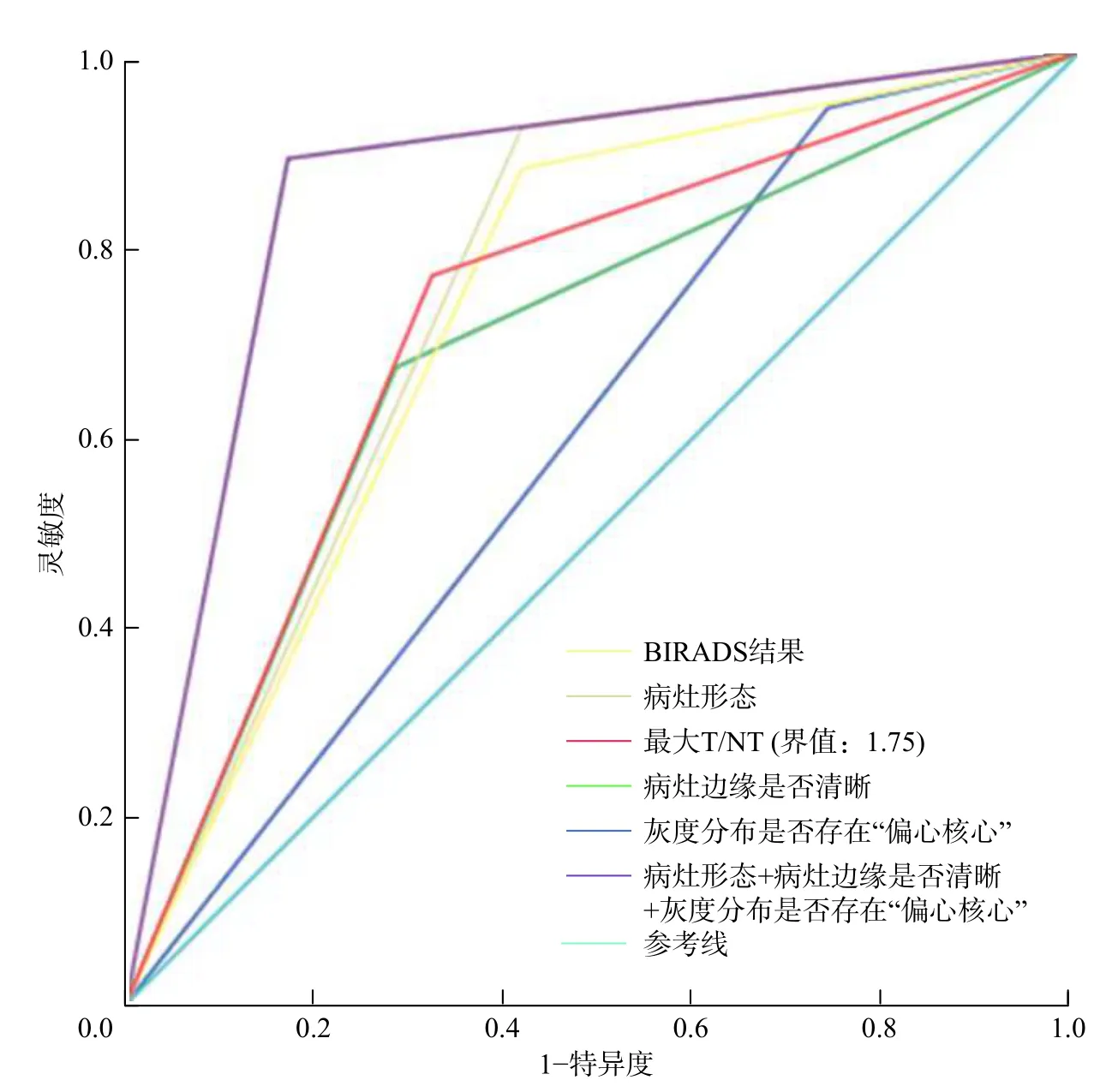
图3 BSGI 的图像特征中不同诊断标准的受试者工作特征曲线 图中,BSGI:乳腺专用γ 显像;BIRADS:乳腺影像报告和数据系统;T/NT:肿瘤/非肿瘤比值。 Fig.3 Receiver operating characteristic curves of different diagnostic standards in image feaures of breast specific gamma imaging
基于病灶形态+病灶边缘是否清晰+灰度分布是否存在“偏心核心”3 个图像特征的联合诊断,本研究293 个病灶中有42 个病灶被误诊,包括22 个假阴性病灶[9 个浸润性导管癌、7 个导管原位癌、1 个浸润性小叶癌、1 个浸润性乳头状癌、1 个小叶原位癌、1 个恶性分叶状肿瘤、1 个黏液癌和1 个神经内分泌肿瘤(上述病变最大径均>1 cm)]和20 个假阳性病灶(12 个纤维腺瘤、4 个乳腺腺病、1 个导管内乳头状瘤、1 个间质胶原化和2 个乳腺导管上皮不典型增生)。
3 讨论
作为乳腺钼靶、超声和MRI 的补充[1,4],BSGI在乳腺病灶中有较好的诊断表现,并且性价比高,是很有潜力的分子影像学检查方法。
Rechtman 等[10]的研究回顾性纳入343 例病理确诊的术前乳腺癌患者(包括恶性病灶343个),BSGI 的诊断灵敏度为95.4%。Cho 等[3]的研究回顾性纳入162 例钼靶和(或)超声诊断为BIRADS 4 级的可疑恶性患者(包括恶性病灶66 个、良性病灶96 个),BSGI 的诊断灵敏度、特异度分别为90.9%和78.1%。Brem 等[5]的研究回顾性入选146 例乳腺疾病患者(包括167 个病灶,其中恶性病灶83 个、良性病灶及交界性病灶84 个)。入选标准如下:①有乳腺肿块但钼靶无法解释;②经病理确诊的多灶性乳腺癌;③钼靶提示双侧腺体不对称但超声、MRI 或者临床检查结果无法解释;④例行筛查的乳腺癌高危病例。该研究结果显示BSGI 的诊断灵敏度、特异度分别为96.4%和59.5%。上述3 项研究均基于传统的视觉判断,但由于入选标准不同,BSGI 的诊断效能也不尽相同。在Brem 等[5]较广谱的入选标准中,BSGI 的诊断特异度偏低(59.5%),有假阳性病灶34 个、假阴性病灶3 个。根据既往对99Tcm-MIBI在乳腺病变中的病理生理研究结果,假阳性病灶多源于99Tcm-MIBI 高摄取的乳腺腺病、纤维腺瘤、炎症等良性病变,与血流及线粒体代谢相关[11];而假阴性病灶多源于乳腺恶性肿瘤的特殊病理类型以及小病灶[12-13]。根据《BSGI 操作指南》1.0 版,本研究的病例入选标准与Brem 等[5]的研究类似,纳入标准适应证较多,疾病谱较广,总共纳入272 例患者(293 个病灶),探讨了图像特征的鉴别诊断价值。
本文中首次提出“偏心核心”的灰度分布概念,经秩相关分析结果证实,其与恶性病变呈正相关(Spearman 相关系数:0.290,P=0.000),即存在“偏心核心”倾向于良性,缺乏“偏心核心”倾向于恶性。同时,在二分类Logistic 回归分析中,“偏心核心”的OR最高,为12.927(95%CI:5.415~30.863),这说明该图像特征在本研究中具有较高的诊断价值,但其独立诊断特异度仅为27.4%,限制了独立诊断能力。灰度分布是否存在“偏心核心”与病灶形态、病灶边缘是否清晰联合诊断达到了最高的诊断效能,优于BIRADS 和最大T/NT(界值:1.75)的诊断效能。与BIRAD 独立诊断相比,联合诊断的假阳性病灶由原来的44 个减少为20 个,在不降低灵敏度的基础上,特异度由58.5%提升至81.1%,准确率由77.5%提升至85.7%。由此看出,在本研究入选标准较宽泛的乳腺疾病人群中,图像特征联合诊断的效能优于传统的视觉和半定量诊断。
在本研究中,基于图像特征的联合诊断标准仍存在一定的假阳性和假阴性病例,原因为病灶形态、病灶边缘或者灰度分布“偏心核心”的图像特征不典型,而无法通过肉眼进行准确判断。因此,对于这类病例,需要积极结合患者的病史问诊、乳腺触诊、传统影像(钼靶、超声或MRI)结果,在获得更多临床信息的基础上,达到更高的诊断效能。同时,在核医学领域,应用18F-FDG高分辨率乳腺PET 成像仪已经实现了纹理分析(texture analysis)对于乳腺恶性肿瘤不同病理亚型的鉴别诊断[14]。BSGI 的图像分辨率与之相似,达3 mm[15],对于肉眼无法准确分辨的不典型病灶,纹理分析可能是潜在的鉴别诊断方法。
本研究的局限性如下:①本研究为回顾性研究,需要前瞻性队列研究的验证;②我们首次提出了“偏心核心”的概念,虽然确定了比较清晰的视觉评判定义,但是没有使用纹理分析参数,因此需要进一步使用图像处理软件,得出更明了的半定量灰度分布参数;③“偏心核心”的病理生理机制尚有待进一步研究。

