基于CT和18F-FDG PET/CT的肺癌风险预测模型对肺结节恶性风险的验证研究
丁辉 胡传贤 黄苏 潘全华
南京医科大学附属淮安第一医院心肺外科 223300
肺结节为小的局灶性、类圆形肉芽肿性疾病,其影像学表现为密度增高的阴影,可单发或多发,且不伴有肺不张、肺门肿大和胸腔积液。孤立性肺结节(solitary pulmonary nodule,SPN)无典型症状,常为单个、边界清楚、密度增高、直径≤3 cm且周围被含气肺组织包绕的软组织影[1-2]。CT 可用于肺部小结节的检查。随着肺癌CT 筛查的普及,检测到的结节数量逐渐增加。目前临床应用的定量预测模型可有助于辨别结节的良恶性。结合临床和CT 对结节特征的描述,Brock University(简称Brock)、 Mayo Clinic( 简 称 Mayo) 和 Veterans Association(简称VA)等肺癌预测模型的应用为临床分析提供了极大的便利[3-5]。CT 容易诊断具有良性钙化特征的结节,但对非钙化结节的诊断容易出现疑问,也不能反映SPN 的代谢及病理生理学信息,PET/CT 可同时进行PET 和CT 扫描,获得两者的融合图像,与单纯的PET 相比,PET/CT 可从解剖学方面对病变精确定位,既改善了PET 图像的分辨率,又缩短了患者的检查时间,一次检查可同时获得CT 解剖图像和PET 功能图像,两种信息互补,提高了对SPN 定性诊断的准确率。近年来,18F-FDG 作为常用的肿瘤显像剂,能提供病灶部位代谢信息,可用于临床良恶性疾病鉴别诊断,具有良好的诊断效能,Herder 预测模型是基于加入18F-FDG 对正电子发射的亲合力进行18F-FDG PET/CT 分析[5-7]。临床预测的不同模型适用的患者群体有所差异,Brock 模型和Herder 模型虽然被广泛应用,但各模型的优势缺乏相关实验的比较验证。因此,本研究重点比较不同模型在招募的患者群体中预测肺结节恶性风险的效能,为临床的合理应用提供依据。
1 资料与方法
1.1 一般资料
回顾性分析2009年7月至2016年7月于本院经CT 检查发现的肺结节患者120 例,其中,经分析可能为恶性结节的患者有59 例,行18F-FDG PET/CT 检查其恶性程度。患者通过肺癌多学科综合治疗和特定结节随访确诊。其中男女患者各60 例,患者年龄为30~81 岁,中位年龄为61 岁。120 例患者中,86 例(71.7%)患者为现在或之前吸烟者,18 例(15.0%) 患者在近5年有胸外癌史,5 例患者(4.2%)有超过5年的胸外癌史,3 例(2.5%)患者有既往肺癌史,112 例(93.3%)患者有单发结节,52 例(43.3%)患者的最大结节的最大直径≤10 mm。所有患者均于检查前签署了知情同意书。
纳入标准:①均为SPN,不伴有胸腔积液、淋巴结肿大或转移性疾病;②结节直径为4~30 mm;③有明确的组织病理学诊断结果,所有恶性诊断均经组织病理学证实;④行CT 增强扫描且无注射碘对比剂禁忌(无碘过敏,肾功能正常,无甲状腺功能亢进、心衰等)。
排除标准:①肺内结节直径>30 mm;②无检查记录或检查记录不完善;③肺内多发结节伴有肺炎、胸腔积液或纵隔淋巴结肿大;④最终诊断不确定的或依肺癌进行治疗的。
1.2 方法
1.2.1 影像学方法
多层螺旋CT 扫描:使用64 层螺旋CT(德国Siemens 公司 SOMATOM Sensation 64 型)进行扫描,扫描参数分别为管电压120 kV、管电流110~160 mAs,层厚及层间隔1.25 mm。扫描结束后自动行常规层厚的肺和纵隔窗重建,然后对病灶行薄层CT 重建,层厚1.0~2.0 mm。在工作站进行最大密度投影和容积再现等图像后处理,充分显示肺结节及其周围邻近组织结构改变的细节。
18F-FDG PET/CT 检查:采用Discovery LS4 PET/CT 一体扫描机(美国GE 公司),患者于检查前禁食4~6 h,在安静、避光条件下平卧15 min 后,静脉注射示踪剂18F-FDG,注射剂量按5.55 MBq/kg体重计算。在患者平静呼吸状态下行PET/CT 检查,取仰卧位,双上臂置于头上,以减少胸部伪影。CT 扫描参数:120 kV,60~80 mAs,0.8 s/帧,22.5 mm/s。PET 扫描行二维数据采集。采用有序子集最大期望值法重建图像,层厚5 mm,层间隔4.25 mm。
将采集数据经迭代重建后传至工作站进行PET 与CT 图像的融合,分别获得横轴位、矢状位、冠状位的PET、CT 以及PET/CT融合图像。此研究基于18F-FDG 亲合力的半定量评估(SUVmax)对结节进行分类,即微弱摄取SUVmax≤2.5(良性病变)、适度摄取SUVmax2.6~10.0(考虑有恶性病变可能)、强烈摄取SUVmax>10.0(恶性病变)。
1.2.2 模型排除标准和验证模型准确性的方法
VA 模型主要基于患者的吸烟史、年龄、戒烟时间的长短和结节的大小来建立;Brock 模型是目前收集样本例数最多、准确率最高的良恶性鉴别模型,具有非常高的诊断能力;Herder 模型以患者临床特征和影像学参数为基础,分析SPN 发生恶性肿瘤的概率[3-5]。
Brock 模型排除标准:结节<5 mm 且边缘规则,结节位于非上叶的位置,有既往肺癌史或近5年内有胸外癌病史。VA 模型排除标准:极少的吸烟史(<5年),结节<4 mm,有既往肺癌史或近5年内有胸外癌病史。Herder 模型排除标准:有先前的癌症史,结节边缘规则,位于非上叶的位置。
使用基于CT 的Brock 模型、VA 模型和基于18F-FDG PET/CT 的Herder 模型,计算肺结节恶化的可能性。模型都通过恶性肿瘤概率=1/(1+e-x)求出相应的SPN 恶性预测概率,其中,e 为自然对数的底数,VA 模型:x=-8.404+(2.061×吸烟史)+[0.779×年龄] + (0.112×直径)-[0.567×戒烟时间],Brock 模型:x=-6.6144+(0.6467×性别)+(-5.5537×直径)+(0.9309×毛刺征)+(0.6009×上叶),Herder 模型:x=-6.827 2+(0.0391×年龄)+(0.7917×吸烟史)+(1.3388×肿瘤史)+(0.1274×直径)+ (1.0407×毛刺征)+(0.7838×上叶)[3-5]。上述公式中,有既往肿瘤史、肿瘤家族史则记为“1”,无则记为“0”;直径指CT 测量的结节最大直径;有毛刺征、边界模糊以及胸膜牵拉征等影像学征象则记为“l”,无则记为“0”;上叶记为“l”,其他位置记为“0”。
根据每个模型的排除标准和所有患者的总队列,验证模型的准确性。通过受试者工作特征(receiver operating characteristic,ROC)曲线,计算曲线下面积(area under the curve,AUC)来评估每个模型的准确性。比较两个模型的效能时,每个模型的评分可用时患者才被收录。
1.3 统计学分析
采用SPSS 20.0 软件对数据进行统计学分析,计算AUC 的95%CI。采用MedCalc 软件行Z检验,进行ROC 曲线间的相关性分析,评价ROC 曲线用于鉴别诊断肺结节良恶性的效能。采用DeLong方法进行两条ROC 曲线的AUC 的Z检验比较。P<0.05 表示差异有统计学意义。
2 结果
120 例患者中,最终确诊49 例(40.8%)患有恶性结节,其中38 例为原发性肺癌、11 例为转移性疾病;71 例(59.2%)为良性病变为,其中61 例根据放射学稳定性和监测尺寸减少确诊、另外10 例通过组织病理学确诊。
每个模型的ROC 曲线见图1。各模型在不同条件下ROC 曲线的AUC 值详见表1,在不受排除标准限制的总队列中,与受排除标准限制的队列相比,每个模型的AUC 值(95%CI,n)均有所下降,但两类队列的AUC 值比较差异无统计学意义(Z=21.357,P=0.121)。总队列的3 种不同模型的恶性概率分布见图2,其中Herder 模型的数据显示为接受18F-FDG PET/CT 扫描的患者。
此外,我们还比较了52 例结节≤10 mm 的患者(不受排除标准限制)基于CT 预测模型的分析效能(表1)。
3 讨论
CT 对SPN 的诊断安全、迅速且无创伤性,有较高的准确率,可对肺癌的早期发现提供可靠依据。目前国内外学者对关于SPN 良恶性病变的影响因素开展了一系列研究,欧美学者侧重于将患者的年龄、吸烟史、肿瘤史等个人临床资料作为主要研究热点[8-9]。诊断SPN 的关键是确定或排除恶性结节,合理评价,使恶性病变得到及时、准确地诊断及治疗。因而临床上迫切需要能预测肺结节良恶性的模型,这种模型将综合考虑患者的临床资料和影像学特征,具有全面有效及定量化地评估结节的性质。
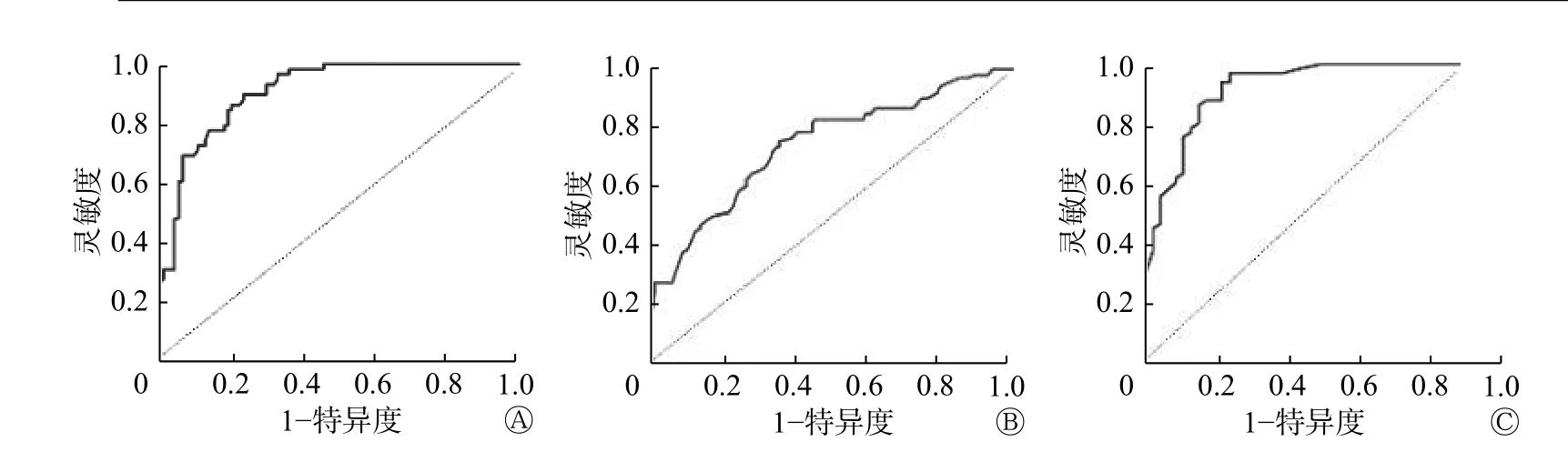
图1 各模型对肺结节恶性风险预测的ROC 曲线 图中,A:Brock University 模型;B:Veterans Association 模型;C:Herder模型。 Fig.1 The receiver operating characteristic curve of risk prediction for pulmonary nodules in various models
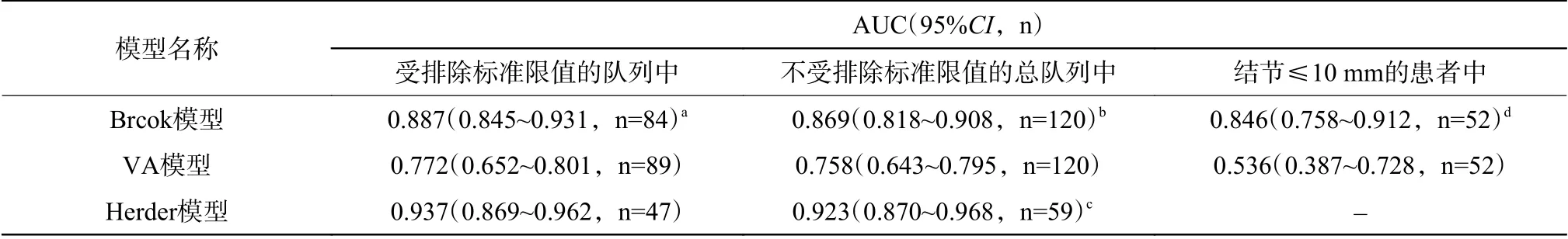
表1 各模型在不同条件下ROC 曲线的AUC 结果Table 1 The areas under the receiver operating characteristic curve of risk prediction for pulmonary nodules in various models

图2 各模型预测肺结节恶性风险的癌变概率 图中,Brock模型:Brock University 模型;VA模型:Veterans Association 模型。 Fig.2 Prediction of cancer probability of malignant risk of pulmonary nodules by various models
临床上对于不同预测模型的招募方法是不同的:Mayo 模型患者来自胸部X 线片基础上检测到的结节,而Brock 模型患者来自CT 筛查的患者群体,包含更大比例的亚厘米结节,亚厘米结节具有低恶性率[10]。此外,模型的群体受到各种排除标准的限制,进而限制其普遍性。Brock 和VA 模型均排除了既往肺癌患者或近5年内有胸外癌病史的患者,虽然预测风险率较低,但临床医师和患者仍需要有关恶性风险的指导,以便为后期监测和治疗方案的制定提供信息。Brock 模型是目前收集样本例数最多、准确率最高的良恶性鉴别模型,建立时共收集了1871 例患者,7008 个结节参与模型建立,且其验证数据集样本量达1090 例[10]。VA 模型建立时数据是不平衡的,有98%的患者为男性,有94%的患者以前或是现在吸烟,吸烟在VA 模型中占有较高的比重,如果评估的患者不吸烟者居多,那么该模型的适用性可能会较差[11]。Herder 等[5]建立的预测模型以患者临床特征和影像学参数为基础分析SPN 发生恶性肿瘤的概率,把流行病学特点(恶性SPN 的发病率)、临床因素(年龄、吸烟状态和癌症病史)、传统的解剖影像学特征(病灶位置、大小和边缘毛刺)和代谢或功能影像学特征四者有机地渗透并形成综合体,最大限度地反映SPN 的各种信息,准确地预测SPN 的性质(恶性或良性)[12-13]。
本研究结果显示,常规临床实验的结节队列中(剔除不符合相应入选标准的病例),Brock 模型的表现明显优于VA 模型;对于使用18F-FDG PET/CT检查评估的患者,Herder 模型在研究中具有最高的准确率(AUC 为0.937,95%CI为0.869~0.962)。当分析扩展到整个结节队列(即包括不符合相应入选标准的病例)时,每个模型的准确率都降低,但Brock 和Herder 模型的AUC 值仍然很高(分别为0.869 和0.923)。当考虑结节≤10 mm 时,Brock模型的AUC 值(0.846)相对较高,这表明预测的准确率较高。本研究对不同模型预测肺结节的恶性风险的准确率进行验证比较,提示在使用临床预测模型评估风险之前,临床医师应首先确定适用患者群体的有效模型。
总之,Brock 模型在表征常规临床预测肺小结节的恶性概率方面的AUC 值高,这表明其准确率较高。本研究结果证实,即使在不受纳入标准限制的队列中使用Brock 模型,预测的准确率也较高。当患者接受PET/CT 进行结节评估时(通常用于较大的结节,恶性程度较高),Herder 模型结合了结节对18F-FDG 的亲合力信息,具有最高的预测准确率。但本研究属于单中心回顾性研究,有一定局限性,后期还需要在相应前瞻性试验中进一步验证。

