新型细胞凋亡分子探针99Tcm-CP3-peptide的制备及在肺腺癌细胞系体内外的实验研究
孔琪 刘岩 刘治国 王晓慧 杨国仁
1 济南大学 山东省医学科学院 医学与生命科学学院 250000;2 山东大学附属山东省肿瘤医院核医学科,济南 250117;3 青岛市市立医院核医学科 266011
细胞凋亡又称细胞程序性死亡,即细胞在一定生理及病理条件下,通过一系列基因的激活、表达、调控,按照自身程序出现的主动性、生理性的死亡过程[1]。通过放化疗等手段诱导肿瘤细胞凋亡是各种抗肿瘤治疗的主要机制之一,而且细胞凋亡往往发生在肿瘤细胞死亡的早期阶段。因此,可以通过检测细胞凋亡评价抗肿瘤药物的早期疗效。
近年来,细胞凋亡探针成为研究热点,尤其在肿瘤疗效监测方面受到更多关注。文献报道最多的细胞凋亡分子探针为99Tcm-膜联蛋白(Annexin V),但是该探针特异性差,不能区分细胞凋亡和坏死,且相对分子质量大、药代动力学差[2-4],因此未能在临床得到推广。细胞凋亡的关键酶caspase-3 在凋亡早期阶段被激活,可用于凋亡的早期评价。天冬氨酸-谷氨酸-缬氨酸-天冬氨酸(Asp-Glu-Val-Asp,DEVD)是caspase-3 的作用底物,能特异性地被caspase-3 裂解而滞留于凋亡细胞中,基于此原理,笔者初步合成了含DEVD 链的多肽分子探针99TcmCP3-peptide,并研究其在凋亡模型体内外的生物学分布及SPECT 静态显像的初步分析。
1 材料与方法
1.1 仪器与试剂
ZD-6000 型γ 计数器:西安志达科技有限公司; Discovery NM/CT670pro SPECT 仪:美 国GE 公司;E2695 高效液相色谱分析仪:美国Waters 公司;CytoFLEX 流式细胞仪:美国BD 公司;游标卡尺:美国Starrett 公司;电子天平(BT1250D):北京赛多利斯有限公司。
紫杉醇(paclitaxel):山东齐鲁制药有限公司;Annxin V-Flous 流式细胞凋亡检测试剂盒:美国Roche 公司。
1.2 实验细胞及实验动物
肺腺癌A549 细胞由山东省肿瘤医院提供。正常雄性裸鼠BALB/c 28 只,4 周龄,体质量(21±2)g,由北京华阜康生物科技有限公司提供。实验动物许可证号:SCXK(京)2014-0004。
1.3 分子探针99Tcm-CP3-peptide 的制备及质量控制
在螯合剂联肼尼克酰胺(HYNIC)的作用下完成对多肽的99Tcm标记。CP3-peptide 购自上海吉尔生化公司,其内含有DEVD 核心,一端为HYNIC,一端为易渗透的聚乙二醇,共7 个氨基酸,相对分子质量为1030。用溶剂为0.1 mol/L 的稀盐酸配制成SnCl2缓冲液,浓度为0.65 mg/mL,蒸馏水配制Tricine 溶液,浓度为0.2 mg/mL,多肽CP3-peptide的浓度为0.2 mg/mL。在2 mL 微型离心管中加入SnCl2溶 液30 μL,多 肽 溶 液30 μL,辅 助 配 体Tricine 30 μL,高锝酸钠溶液(约74 MBq)0.1 mL,加蒸馏水定容至1 mL,110℃加热30 min。加热结束后常温放置即可。99Tcm-CP3-peptide 合成后,观察产品颜色及澄清度,利用精密pH 试纸测量酸碱度,利用分析型高效液相色谱(high performance liquid chromatography,HPLC)仪分别于0、1、2、4 和6 h 测量放射化学纯度(流动相为25%乙腈水溶液,0.1%三氟乙酸,流率为1 mL/min)。
1.4 99Tcm-CP3-peptide 的体外凋亡细胞结合实验
收集对数生长期的肺腺癌A549 细胞,以5×104个/孔接种于2 个12 孔板,一个板为化疗组,另一板为对照组,化疗组与对照组均为3 组,每组2 孔,置于37℃、5%CO2的培养箱中孵育过夜。24 h 后,取出12 孔板,弃培养基,每孔加入500 μL PBS 冲洗2 遍,加入完全培养基(10%胎牛血清和1%双抗的培养基)1 mL,化疗组每孔均加入200 nmol/L紫杉醇,对照组每孔加入等量PBS,置于37℃、5% CO2培养箱孵育24 h 后,弃培养基,用500 μL PBS 冲洗2 遍。分别对化疗组和对照组中的6 孔各加入99Tcm-CP3-peptide 0.37 MBq,静置30 min 后加入500 μL PBS 冲洗2 遍,胰酶消化细胞后离心,800 r/min (离心半径为8 cm),离心3 min,取上清液,用γ 计数仪测量细胞外放射性计数(Cout);之后加入1 mol/L NaOH 100 μL裂解细胞,收集细胞裂解液测量细胞内放射性计数(Cin)。同时处理另6 孔细胞,将其调整为5×105~1×106个/mL 单细胞悬液,应用Annexin V-Flous 试剂盒进行Annexin V-异硫氰酸荧光素(FITC)及碘化丙啶(propidium iodine,PI)标记,采用流式细胞仪进行肿瘤细胞凋亡检测。结果判定:Annexin VFITC 阴性/PI 阴性为正常细胞,Annexin V-FITC 阳性/PI 阴性为早期凋亡细胞,Annexin V-FITC 阳性/PI 阳性为晚期凋亡细胞,Annexin V-FITC 阴性/PI 阳性为坏死细胞。
1.5 肺腺癌A549 细胞荷瘤裸鼠模型的建立与99Tcm-CP3-peptide 体内生物学分布
BALB/c 裸鼠28 只,将肺腺癌A549 细胞制备成单细胞悬液(1×107个/mL),接种于裸鼠右下肢,每只接种0.1 mL,10 d 后,待肿瘤直径生长至1 cm 时,将荷瘤裸鼠模型进行实验研究。
荷瘤裸鼠18 只,应用随机数字表法分为6 组,每组3 只,腹腔注射紫杉醇(40 mg/kg)48 h 后,尾静脉注射99Tcm-CP3-peptide 3.7 MBq(约100 μL),分别于注射后5、15、30、60、120、240 min 各处死3 只,即刻取血液及心脏、肝脏、脾脏、肾脏等主要脏器,分别测量各脏器质量及放射性计数,计算不同时间点的每克组织放射性摄取值(%ID/g)。
1.6 荷瘤裸鼠化疗后SPECT 静态显像
10 只荷瘤裸鼠,分为化疗组和对照组,每组5 只。化疗组腹腔注射紫杉醇(40 mg/kg),对照组腹腔注射相同体积的生理盐水。48 h 后经尾静脉注射37 MBq99Tcm-CP3-peptide,于给药后1 h 行SPECT 静态显像,条件为矩阵256×256,配备低能高分辨平行孔准直器,采集时间5 min。勾画ROI,计算肿瘤和对侧肌肉组织的放射性比值(T/NT)。
1.7 肿瘤组织形态学检测
显像结束后,取肿瘤组织即刻固定(10%中性甲醛溶液)、脱水、石蜡包埋后切成3~5 mm 薄片,常规苏木精-伊红染色后滴加树脂封片,置于光学显微镜下(×400)观察肿瘤细胞形态。
1.8 统计学方法
采用SPSS 22.0 软件进行统计学分析。数据符合正态分布且方差齐,以±s表示,两组比较采用t检验,相关性研究采用双变量相关分析。P<0.05 表示差异有统计学意义。
2 结果
2.1 99Tcm-CP3-peptide 的制备及质量控制
成功制备99Tcm-CP3-peptide,合成率为(64.5±5.2)%,产品为无色透明溶液,pH 值为6.5~7.5。99Tcm-CP3-peptide 标记率>99%,放射性出峰时间为5.74 min,室温放置0、1、2、4 和6 h 的放射化学纯度分别为(99.33±0.12)%、(99.30±0.38)%、(99.02±0.13)%、(97.54±0.12)%和(97.02±0.26)%。
2.2 肺腺癌A549 细胞化疗后99Tcm-CP3-peptide 摄取及流式细胞仪检测结果
紫杉醇诱导肺腺癌A549 细胞凋亡后,用γ 计数器测定细胞及上清液的放射性计数,其中化疗组Cin/Cout 为10.27±2.02,对照组Cin/Cout 为1.09±0.03,化疗组为对照组的7.3 倍。肿瘤细胞凋亡检测结果见图1,由图1可知,化疗组细胞凋亡率为(75.62±2.57)%,对照组细胞凋亡率为(3.42±0.32)%,化疗组细胞凋亡率高于对照组,差异有统计学意义(t=6.97,P<0.05)。化疗组和对照组的 Cin/Cout 与流式细胞仪检测的凋亡细胞百分比呈正相关,且差异有统计学意义(r=0.970,P<0.05)。
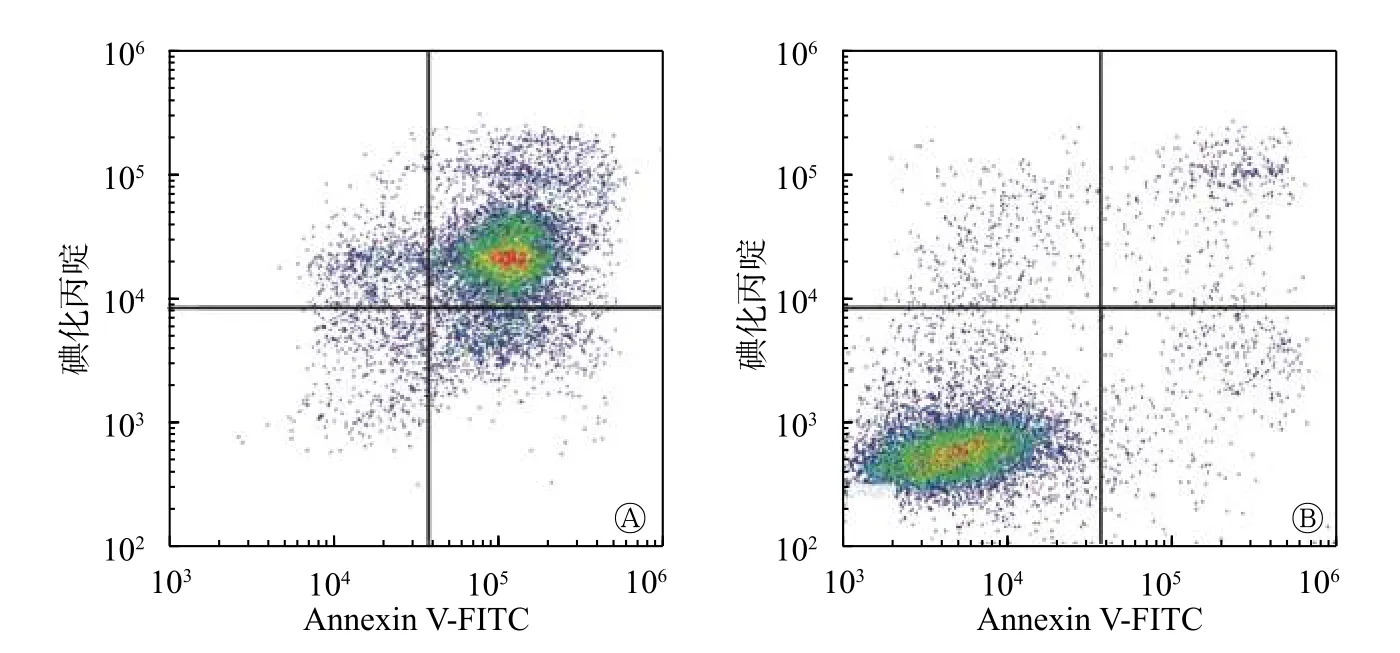
图1 肺腺癌A549 细胞化疗组与对照组细胞凋亡分析图 图中,A:化疗组,细胞凋亡率为(76.52±2.57)%;B:对照组,细胞凋亡率为(3.42±0.32)%,化疗组细胞凋亡率高于对照组,且差异有统计学意义(t=6.97,P<0.05)。FITC:异硫氰酸荧光素。 Fig.1 Apoptosis analysis of lung adenocarcinoma A549 cells in the chemotherapy group and the control group
2.3 99Tcm-CP3-peptide 在肺腺癌A549 细胞荷瘤裸鼠体内的生物学分布结果
由表1可见,肾脏是99Tcm-CP3-peptide 放射性浓聚最多的器官,注射后15 min 达到峰值,为(8.95±0.51)%ID/g,2 h 为(2.25±0.78 )%ID/g,清除较快;血液中放射性清除速度很快,到2 h 即下降到(2.25±0.24)%ID/g;肿瘤组织在注射后1 h 放射性摄取值达到峰值(4.26±1.03)%ID/g;心脏、脾脏、肺等重要器官放射性摄取值均较低;但在肝脏中摄取稍高:5 min 时为(3.21±0.75)%ID/g,到1 h时降为(2.81±0.72)%ID/g,下降速度较慢。
2.4 荷瘤裸鼠99Tcm-CP3-peptide SPECT静态显像结果
图2显示,注射99Tcm-CP3-peptide后1 h 即可获得清晰图像,化疗组(图2中A)肿瘤部位有明显放射性摄取,对照组(图2中B)肿瘤部位仅有少量放射性摄取。化疗组T/NT 为3.83±0.11,显著高于对照组(1.57±0.09),且差异有统计学意义(t=16.19,P<0.05)。
2.5 肿瘤组织形态学检测
光镜下,肿瘤组织苏木精-伊红染色示化疗组肿瘤组织(图3中A)见大量核固缩(细胞核体积减小,嗜碱性增强)、核碎裂(核膜破裂,细胞核碎裂)及凋亡细胞(细胞体积缩小,胞质致密,嗜酸性增强);对照组(图3中B)仅见少量核固缩、核碎裂及少量凋亡细胞。
3 讨论
细胞凋亡是一系列基因、蛋白质严密调控下的细胞自杀行为,细胞接受各种凋亡信号诱导,通过内源性或外源性途径激活凋亡相关酶或蛋白。Caspase 作为一组天门冬氨酸特异性的半胱氨酸蛋白酶,在细胞凋亡中起关键作用,其中与细胞凋亡相关的半胱氨酸蛋白
表1 不同时间99Tcm-CP3-peptide 在肺腺瘤A549 细胞荷瘤裸鼠体内的生物学分布( ±s,%ID/g)Table 1 Biological distribution of 99Tcm-CP3-peptide in nude mice with tumor at different time points ( ±s,%ID/g)

表1 不同时间99Tcm-CP3-peptide 在肺腺瘤A549 细胞荷瘤裸鼠体内的生物学分布( ±s,%ID/g)Table 1 Biological distribution of 99Tcm-CP3-peptide in nude mice with tumor at different time points ( ±s,%ID/g)
组织或器官 注射后时间5 min 15 min 30 min 60 min 120 min 240 min血液 10.51±3.21 9.50±2.71 6.34±1.24 4.25±1.02 2.25±0.24 2.65±1.31心脏 1.27±1.21 1.35±1.51 1.02±0.85 0.86±0.95 0.68±0.65 0.45±0.23肝脏 3.21±0.75 3.33±1.41 2.54±0.54 2.81±0.72 1.85±0.54 1.24±0.32脾脏 2.91±1.21 2.11±0.35 1.56±0.35 0.86±0.30 0.54±0.25 0.15±0.24肾脏 4.85±1.20 8.95±0.51 6.34±1.26 4.22±0.42 2.25±0.78 1.84±0.31肺2.67±1.01 2.31±0.85 1.85±0.62 1.32±0.21 1.15±0.78 0.65±0.33小肠 1.13±0.22 1.24±0.21 1.08±0.35 0.75±0.32 0.54±0.51 0.24±0.05肌肉 1.31±1.20 1.52±0.89 1.27±0.81 1.08±0.63 0.68±0.31 0.47±0.21骨骼 1.69±1.24 2.21±1.61 1.78±0.84 1.23±0.86 0.86±1.10 0.57±0.34肿瘤 2.75±0.31 3.21±1.03 3.73±0.84 4.26±1.03 3.21±0.96 1.30±0.56
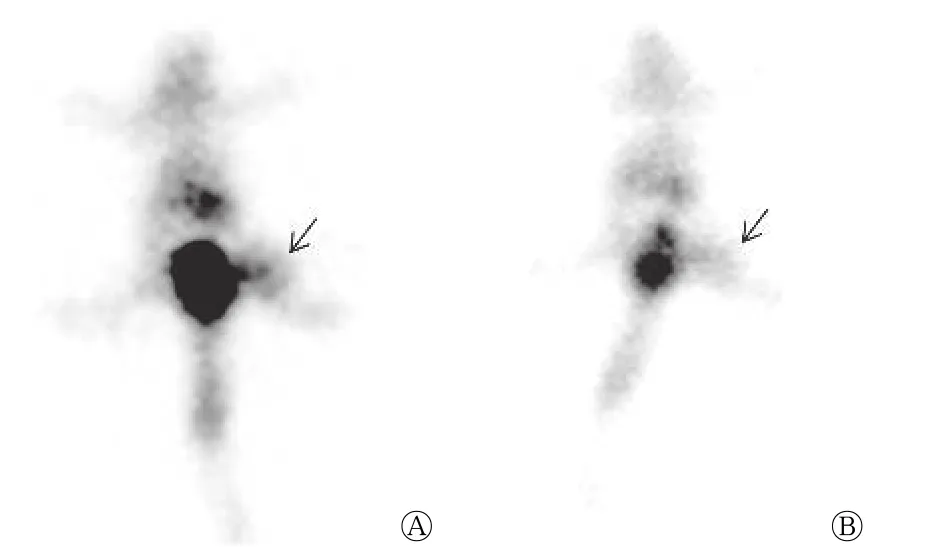
图2 肺腺瘤A549 细胞荷瘤裸鼠注射99Tcm-CP3-peptide 1 h后SPECT 静态显像图 图中,A:化疗组,肿瘤区域可见放射性浓集(箭头所示);B:对照组,肿瘤区域仅可见少量放射性摄取(箭头所示)。Fig.2 99Tcm-CP3-peptide SPECT static imaging of tumor-bearing nude mice
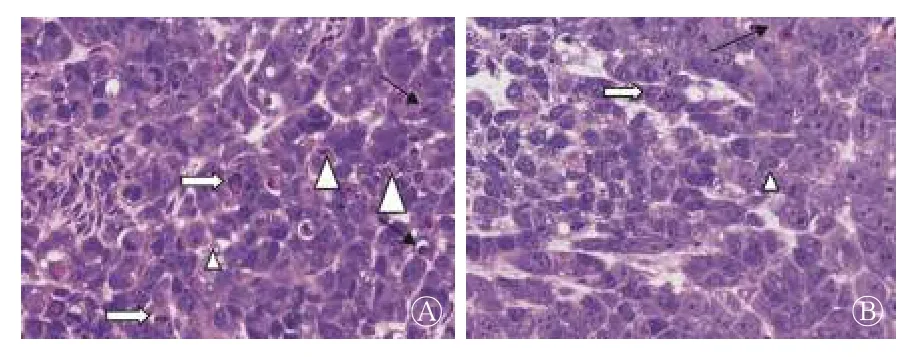
图3 肺腺癌A549 细胞荷瘤裸鼠肿瘤组织病理图(苏木精-伊红染色,×400) 图中,A:化疗组;B:对照组。黑箭头表示核固缩,白箭头表示核碎裂,三角形表示凋亡。 Fig.3 A549 lung cancer tumor-bearing nude mice tumor tissue sappanine-eosin staining figure
酶是caspase-2、3、7。caspase-3 是细胞凋亡过程中的关键元件,是细胞凋亡蛋白酶级联反应的必经之路,其激活与超常表达均引起细胞凋亡。当蛋白水解级联反应介导凋亡发生时,该酶参与凋亡起始、调节和执行下游一系列酶联反应事件[5-6],继而发生磷脂酰丝氨酸和磷脂酰乙醇胺的外翻,最终细胞质收缩、细胞膜破裂,形成凋亡小体。文献报道的分子探针多为靶向细胞凋亡过程中磷酯酰丝氨酸和磷脂酰乙醇胺,如99Tcm-Annexin V,其在肿瘤化疗[7-8]和放疗[9-10]的疗效评价和预测方面有一定应用价值,但该探针特异性较差、相对分子质量大、药代动力学差,而且不能区分坏死和凋亡,因此限制了其在临床上的应用。
在细胞凋亡早期阶段caspase-3 被激活,在细胞凋亡晚期或坏死时,其活性明显下降,因此靶向caspase-3 既可用于检测细胞凋亡的早期过程,也可在一定程度上区分细胞凋亡和坏死。张宝石等[11]研发含DEVD 核心的正电子核素标记的caspase-3多肽活性显像剂,动物实验结果表明,18F-CP-18比18F-FDG 能够更早、更准确地反映肿瘤对化疗所产生的凋亡反应,但是后来的研究证明,肿瘤细胞的18F-CP-18 摄取值与caspase3表达程度的相关系数较低[12]。Shen 等[13]设计了一种新型细胞凋亡探针——18F-caspase3 敏感性纳米聚合体示踪剂(caspase-3 sensitive nano-aggregation tracer,CSNAT),因其具有强疏水性,可以原位组装成高比活度的纳米聚合物,不易被细胞排出,注射后凋亡细胞摄取值随时间延长而增加,有利于增强PET 显像的对比度;荷瘤裸鼠化疗后18F-CSNAT 的肿瘤摄取、浓聚结合速率常数和肿瘤/肌肉摄取比值均显著升高,但是18F-CSNAT 在腹腔的摄取较高,影响腹部肿瘤的显像[14-15]。
在本研究中,99Tcm-CP3-peptide 作为一种新型99Tcm标记的细胞凋亡显像剂成功制备,HPLC检测结果示:99Tcm-CP3-peptide 标记率较高、稳定性好,即刻放射化学纯度达(99.33±0.12)%,且4 h放化纯度仍高达(97.54±0.12)%,这表明该放射性药物体外稳定性较好,可以保持较高的放化纯度;体外凋亡细胞化疗组和对照组Cin/Cout 与流式细胞仪检测的细胞凋亡呈正相关(r=0.970,P<0.05),这表明99Tcm-CP3-peptide 能较好地靶向体外凋亡肿瘤细胞,可进一步用于动物细胞凋亡显像研究;99Tcm-CP3-peptide 在正常小鼠体内分布良好,肾脏在注射后15 min 达峰值(8.95±0.51)%ID/g,2 h后降为(2.25±0.78)%ID/g,清除较快,这表明此药物主要经肾脏排泄;注射显像剂2 h 后,血液放射性摄取减少约为78.6%,这说明此放射性药物在血液中清除较快,这些因素均有利于荷瘤裸鼠凋亡显像。另外,小鼠在注射显像剂1 h 后经SPECT 显像,勾画ROI 示:化疗组T/NT 为3.83±0.11,显著高于对照组T/NT(1.57±0.09),两组间差异有统计学意义(t=16.19,P<0.05),与肿瘤组织的苏木精-伊红染色结果相符,提示肿瘤组织对该显像剂的放射性摄取与细胞凋亡相关,但仍需后续的病理实验如caspase-3 免疫组化、Tunel 等凋亡相关分析进一步验证该相关性。以上研究结果提示,99Tcm-CP3-peptide 能够较灵敏较早期地反映肿瘤细胞化疗后的细胞凋亡情况。
本研究中,肝脏、肾脏摄取稍高,可能会影响动物腹部的显像效果,有待动物实验显像的进一步研究。荷瘤裸鼠SPECT 静态显像发现,肿瘤对该显像剂的摄取为局灶性,而非均匀性,可能因为化疗后对肿瘤细胞杀伤是非均匀性的,与肿瘤的生长有关。此外实验仍需对化疗后荷瘤裸鼠在30、60、120、240 min 分别进行SPECT 显像,以获取最佳显像的时间点。
综上所述,99Tcm-CP3-peptide 作为一种新型细胞凋亡探针,其标记方法简单、稳定性好,且生物分布较理想,对监测化疗后肿瘤细胞凋亡的显像具有潜在的价值,在化疗疗效预测方面有较好的应用。后续的动物显像实验有待进一步研究。

