微RNA-210抑制人退行性变髓核细胞自噬影响椎间盘退行性变
杜世也,张 颖,袁 文
海军军医大学附属长征医院骨科,上海 200003
椎间盘退行性变(IDD)是引起下腰痛的主要原因之一[1],严重危害公众健康,并给社会带来巨大的经济负担[2]。微RNA(miRNA)是一种能够调控包括造血作用、器官形成、细胞凋亡、细胞增殖和肿瘤发生等多种细胞活动的非编码单链RNA分子,可通过与靶基因mRNA的3'非翻译区(3'-UTR)结合干扰其翻译过程或使其降解来抑制靶基因的表达[3]。研究表明,miRNA在髓核细胞、纤维环细胞、软骨终板细胞的凋亡、增殖及细胞外基质代谢中起到关键作用[4],但其机制尚不完全清楚。研究发现,在慢性阻塞性肺疾病患者的肺成纤维细胞中,过表达miRNA-210可以降低自噬的发生率[5],而在鼠髓核细胞中肿瘤坏死因子-α(TNF-α)引起的自噬激活会下调基质金属蛋白酶-3(MMP-3)的表达[6]。本研究旨在探讨在发生退行性变椎间盘髓核细胞中miRNA-210是否通过调节细胞自噬参与细胞外基质代谢,进而影响IDD进程。
1 材料与方法
1.1 材料和设备
收集24例IDD患者(男16例、女8例,年龄39 ~ 60岁、平均51.4岁;IDD组)和6例腰椎骨折患者(男5例、女1例,年龄18 ~ 25岁、平均22.2岁;对照组)的椎间盘组织,所有患者均知情同意。实验所用主要试剂及设备:DMEM-F12培养液、胎牛血清(FBS)、TRIzol细胞RNA抽提裂解液、Lipofectamine 3000转染试剂、Opti-MEM培养液(Gibco公司,美国),BCA蛋白浓度检测试剂盒、ECL发光试剂盒(上海碧云天生物技术有限公司,中国),单丹磺酰尸胺(MDC)染色试剂盒(北京索莱宝科技有限公司,中国),SuperScriptⅡReverse Transcriptase试剂盒、SYBR Green Real-Time PCR Master Mix试剂盒(TaKaRa公司,日本),LC3、Beclin-1、Ⅱ型胶原(ColⅡ)、蛋白多糖、MMP-3抗体、MMP-13抗体(Cell Signaling公司,美国),miRNA-210 mimic、miRNA-210 mimic control、miRNA-210 inhibitor、miRNA-210 inhibitor control、自噬相关蛋白(ATG)siRNA、Quik ChangeⅡXL Site-Directed Mutagenesis试剂盒(Thermo Fisher Scientific公司,美国),自噬抑制剂3-甲基腺嘌呤(3-MA;Selleck公司,美国),双荧光素酶质粒(Promega公司,美国),ABI 7500实时荧光定量聚合酶链反应(FQ-PCR)仪、ABI 2720 cDNA反转录仪(Life Technologies公司,美国),恒压恒流电泳仪(申华生化技术开发公司,中国),核酸蛋白测定仪(Eppendorf公司,德国)。
1.2 髓核细胞分离及培养
收集髓核组织并用眼科剪将髓核组织剪至1 mm×1 mm×1 mm的小块,置于离心管中。加入0.25%胰蛋白酶水浴37℃消化,每5 min摇动1次,20 min后离心(1 500 r/min,离心半径10 cm,10 min)。弃除上清液后加入0.2%ColⅡ酶37℃水浴消化3 ~ 4 h,每5 min摇动1次。随后加入含有20%FBS的DMEM-F12培养液终止消化,离心(1 500 r/min,离心半径10 cm,10 min)后弃除上清液。加入培养液重新悬浮细胞后接种于培养皿中。将培养皿置于含5% CO2、37℃的细胞培养箱中,每2 ~ 3 d更换1次培养液,每天观察细胞生长及贴壁情况,细胞生长至80% ~ 90%融合时进行传代。实验用细胞为3代细胞。
1.3 MDC染色
将细胞用胰蛋白酶消化后离心(1 500 r/min,离心半径10 cm,10 min),加入1×洗涤缓冲液清洗细胞后再次离心(1 500 r/min,离心半径10 cm,10 min),弃除上清,加入适量体积的1×洗涤缓冲液使细胞重悬并将细胞密度调整至106/mL。将细胞悬液与MDC染色液混合均匀(细胞悬液体积∶MDC染色液体积= 9∶1),避光室温下染色20 ~ 50 min。离心(1 500 r/min,离心半径10 cm,10 min)收集细胞,加入100 μL收集缓冲液重悬细胞,将细胞悬液滴在载玻片上,荧光显微镜下观察并拍照(激发滤光片波长355 nm,阻断滤光片波长512 nm)。
1.4 细胞转染及干预
在细胞融合度达到70% ~ 80%时进行细胞转染。先将Opti-MEM分别与Lipofectamine 3000转染试剂及miRNA序列混合均匀,再将2种混合液混合孵育5 ~ 10 min。将miRNA序列与脂质体的复合物均匀滴到细胞表面,置于细胞培养箱中24 h,完成转染。根据实验目的需要,部分实验在进行miRNA-210 inhibitor和miRNA-210 inhibitor control转染前需先用ATG siRNA或自噬抑制剂3-MA处理。
1.5 FQ-PCR
将经过转染和干预后的髓核细胞依照TRIzol试剂说明书方法提取细胞RNA,使用分光光度计检测RNA浓度和纯度,并以适当比例稀释浓度过高的RNA,按照SuperScriptⅡReverse Transcriptase试剂盒反转录合成cDNA。应用FQ-PCR仪,按照SYBR Green Real-Time PCR Master Mix试剂盒说明书检测相关指标的表达。
1.6 蛋白质印迹分析
应用RIPA裂解液裂解细胞提取细胞蛋白,测定蛋白浓度,上样进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,初始以80 V恒压电泳40 min,后提升电压至120 V电泳80 min。将蛋白条带从凝胶转移至硝酸纤维素膜,将膜放入封闭液中室温下摇晃封闭1 h,随后按一定浓度加入不同一抗,4℃孵育过夜。洗膜后加入二抗室温下摇晃孵育1 h,清洗后滴加ECL发光液显影,拍照,分析蛋白相对表达量。
1.7 生物信息学分析和双荧光素酶报告实验
用Target Scan预测miRNA-210靶基因,寻找与自噬相关的靶基因及其与miRNA-210的结合位点。应用PCR扩增靶基因的3'-UTR,并将其插入到荧光素酶报告基因质粒中,使用QuikChangeⅡ XL Site-Directed Mutagenesis试剂盒构建突变型荧光素酶报告质粒。随后用Lipofectamine 3000转染试剂将双荧光素酶报告质粒和miRNA-210 mimic、miRNA-210 mimic control、miRNA-210 inhibitor、miRNA-210 inhibitor control转染到髓核细胞中,应用双荧光素酶报告系统检测其荧光活性。
1.8 统计学处理
采用GraphPad Prism 7.0软件对数据进行统计学分析并作图。对于符合正态分布且方差齐性的组间独立样本均数的比较采用单因素方差分析,对于不符合正态分布或方差不齐的组间独立样本均数比较采用Wilcoxon秩和检验;以P < 0.05为差异有统计学意义。
2 结 果
2.1 miRNA-210与细胞自噬的关系
蛋白质印迹结果显示,在IDD组中,自噬相关蛋白LC3Ⅱ/Ⅰ和Beclin-1的表达量明显低于对照组,差异有统计学意义(P < 0.05,图1a);FQ-PCR结果显示,IDD组miRNA-210表达量明显升高,与对照组相比差异具有统计学意义(P < 0.05,图1b)。MDC染色结果显示,IDD组细胞自噬水平低于对照组(图1c,d)。以上说明发生退行性变的椎间盘髓核细胞自噬水平降低,miRNA-210表达量增加。
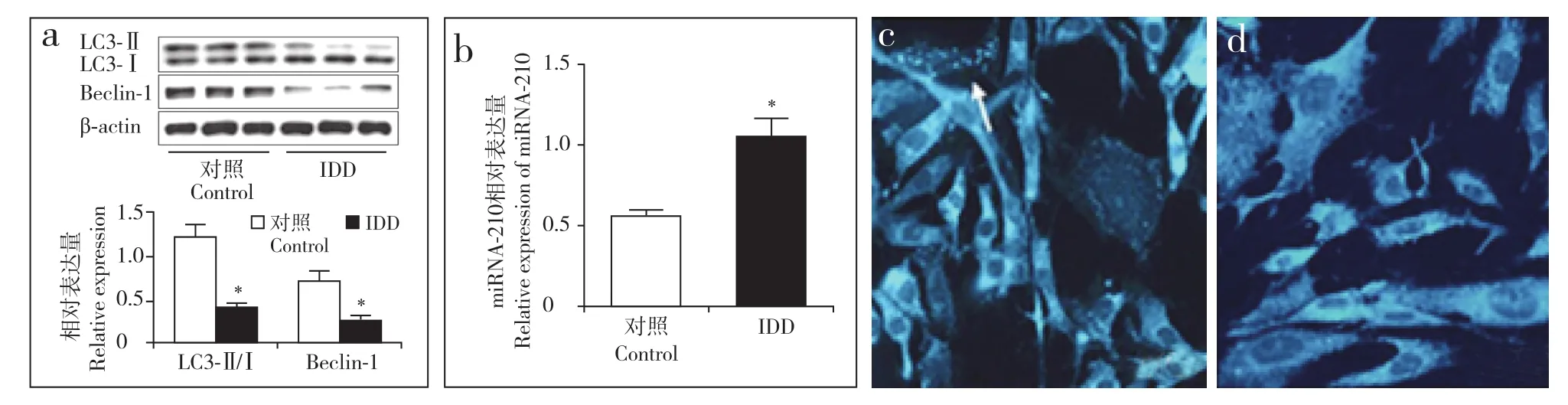
图1 髓核细胞自噬水平和miRNA-210表达量Fig. 1 Expression of miRNA-210 and autophagy in nucleus pulposus cells
miRNA转染效率如图2a所示。蛋白质印迹分析结果显示,IDD组上调miRNA-210会导致髓核细胞中Beclin-1和LC3Ⅱ/Ⅰ表达量降低,下调miRNA-210会导致Beclin-1和LC3Ⅱ/Ⅰ表达量增加,与对照组相比差异均具有统计学意义(P < 0.05,图2b,c)。以上结果说明miRNA-210可以抑制髓核细胞自噬。
2.2 miRNA-210对细胞外基质代谢的影响
FQ-PCR和蛋白质印迹分析结果显示,IDD组上调miRNA-210导致髓核细胞中ColⅡ及蛋白多糖表达量降低,MMP-3和MMP-13表达量升高;下调miRNA-210导致髓核细胞中ColⅡ及蛋白多糖表达量升高,MMP-3和MMP-13表达量降低;与对照组相比差异均有统计学意义(P < 0.05,图3)。以上结果说明在发生退行性变的椎间盘髓核细胞中,miRNA-210激活MMP-3和MMP-13,促进细胞外基质降解。
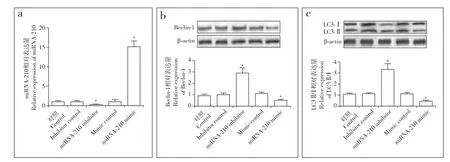
图2 miRNA-210抑制髓核细胞自噬Fig. 2 miRNA-210 inhibiting autophagy of nucleus pulposus cells

图3 miRNA-210对ColⅡ、蛋白多糖、MMP-3和MMP-13的影响Fig. 3 Effects of miRNA-210 on expression of ColⅡ,aggrecan,MMP-3 and MMP-13
自噬抑制剂3-MA会减弱miRNA-210对ColⅡ、蛋白多糖、MMP-3和MMP-13的调节作用(图4),说明miRNA-210对细胞外基质代谢的调节是通过影响细胞自噬进行的。
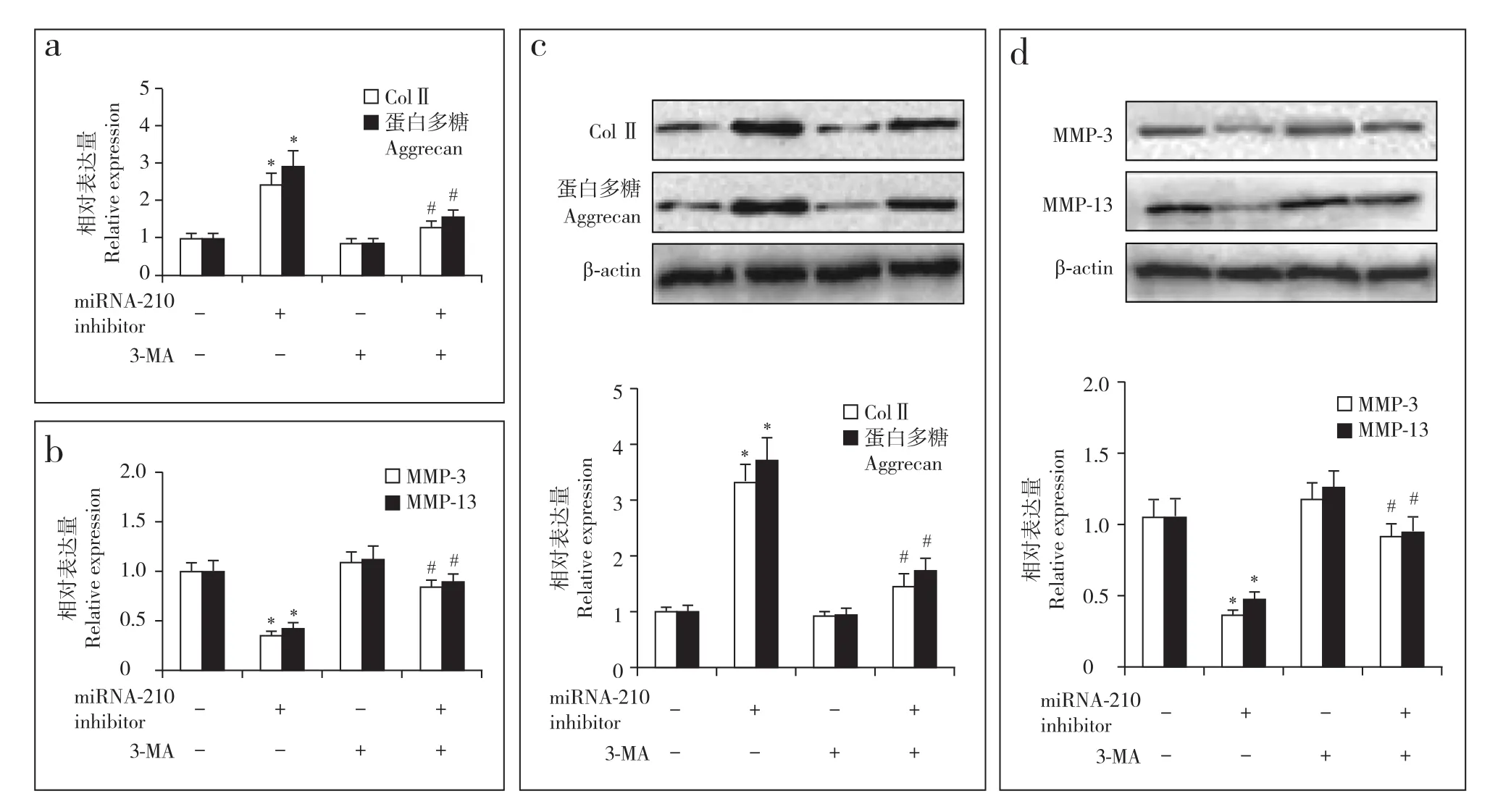
图4 细胞自噬参与miRNA-210对细胞外基质代谢的影响Fig. 4 Involvement of autophagy in effects of miRNA-210 on extracellular matrix metabolism
2.3 miRNA-210与ATG7的关系
Target Scan预测到42个miRNA-210靶基因,其中ATG7为自噬相关基因。ATG7的双荧光素酶报告实验结果显示,IDD组中,上调miRNA-210的髓核细胞野生型荧光素酶报告质粒荧光活性明显降低,与对照组相比差异均有统计学意义(P < 0.05),而突变型荧光素酶报告质粒荧光活性没有发生明显改变;下调miRNA-210的髓核细胞野生型荧光素酶报告质粒荧光活性明显升高,与对照组相比差异均有统计学意义(P < 0.05),而突变型荧光素酶报告质粒荧光活性没有发生明显改变(图5)。以上结果说明ATG7为miRNA-210的靶基因,且miRNA-210直接与ATG7的3'-UTR互补结合;在发生退行性变的椎间盘髓核细胞中miRNA-210靶向作用于自噬相关基因ATG7并抑制其表达以调节髓核细胞自噬。
ATG7 siRNA和miRNA-210 inhibitor共转染后沉默ATG7,会减弱miRNA-210对ColⅡ、蛋白多糖、MMP-3和MMP-13的调节作用(图6),说明ATG7参与细胞外基质代谢,miRNA-210通过沉默ATG7抑制髓核细胞自噬,激活MMP-3和MMP-13,促进细胞外基质(ColⅡ和蛋白多糖)降解,参与IDD进程。

图5 双荧光素酶报告实验检测荧光活性Fig. 5 Detection of fluorescence activity by dual-luciferase reporter assay

图6 miRNA-210通过沉默ATG7引起细胞外基质降解Fig. 6 miRNA-210 promoting extracellular matrix metabolism via silencing ATG7
3 讨 论
miRNA与许多疾病的预后和进展息息相关,是细胞生理和病理过程的重要调节分子,在细胞增殖、凋亡、分化和癌变等过程中发挥重要作用[7]。miRNA通过与靶基因mRNA的3'-UTR结合,部分或完全抑制其翻译过程,甚至直接分解靶基因mRNA来沉默靶基因的表达[8],因此有潜力成为未来基因治疗的靶点[9-11]。随着研究者对于IDD机制研究的深入,越来越多的研究发现miRNA在人正常椎间盘和发生退行性变的椎间盘组织中存在差异性表达,这些差异性表达的miRNA在细胞凋亡、蛋白水解酶和细胞外基质的降解等生物过程中发挥着重要作用,这说明miRNA在IDD发生的机制中是不可或缺的重要调节分子[12-15]。本研究发现,与对照组相比,miRNA-210在发生退行性变的髓核细胞中表达明显增加,进一步证实了miRNA-210参与IDD进程。
细胞自噬是一种由30多个自噬相关基因以及多种信号通路共同调节的多环节复杂细胞生命活动[16]。自噬活动主要表现为细胞内部分长寿蛋白或细胞器被单层或双层膜包裹后形成自噬体,自噬体再与溶酶体结合形成自噬溶酶体进行消化和降解,从而实现损伤细胞器更新和细胞代谢[17]。本研究发现,与对照组相比,在发生退行性变的髓核细胞中自噬水平显著降低。这与Caramés等[18]在关节领域的研究结果一致,他们发现在正常的人和小鼠关节软骨中,自噬标志性基因LC3、Beclin-1和ULK-1呈高表达,而在发生退行性变的人和小鼠关节软骨中,自噬的标志性基因表达明显减少。
ColⅡ和蛋白多糖是椎间盘细胞外基质的主要组成成分,细胞外基质由椎间盘内的细胞不断合成和降解且处于动态平衡[19]。当椎间盘发生退行性变时,蛋白水解酶降解作用增强,使ColⅡ和蛋白多糖等细胞外基质大量降解,导致动态平衡被打破,最终引起椎间盘高度下降、组织韧性降低等一系列病理改变[20]。ColⅡ和蛋白多糖的丢失被认为是椎间盘退行性变的早期指标[21]。MMP-3和MMP-13是基质金属蛋白酶家族的主要成员,众多研究表明,MMP-3和MMP-13过表达会引起ColⅡ和蛋白多糖降解,最终导致IDD[22-24]。本研究发现,上调miRNA-210会导致ColⅡ及蛋白多糖表达量降低,MMP-3和MMP-13表达量升高;下调miRNA-210导致ColⅡ及蛋白多糖表达量升高,MMP-3和MMP-13表达量降低;说明miRNA-210可以通过增加MMP-3和MMP-13的表达使细胞外基质降解增加,打破细胞外基质合成与分解原有的动态平衡,促进IDD的进展。
近期研究显示,自噬在细胞外基质代谢的过程中也起到重要作用,如在人椎间盘细胞中白藜芦醇通过激活自噬降低TNF-α介导的MMP-3的表达[6],在鼠髓核细胞中氨基葡萄糖通过促进自噬抑制白细胞介素1β引起的蛋白多糖降解等[25]。本研究发现,IDD组上调miRNA-210会降低髓核细胞自噬相关蛋白Beclin-1和LC3Ⅱ/Ⅰ的表达,自噬抑制剂3-MA会减弱miRNA-210对ColⅡ、蛋白多糖、MMP-3和MMP-13的调节作用,说明在发生退行性变的髓核细胞中,自噬参与调节细胞外基质代谢。
由于ATG7在自噬体和囊泡的形成过程中发挥重要作用,因此,在众多的自噬相关基因中,ATG7是激活细胞自噬必不可少的基因[26]。一方面,ATG7起到连接酶样作用,使ATG5和ATG12结合,这是自噬体形成过程中重要的一步[27];另一方面,ATG7可以使不成熟的胞质蛋白LC3Ⅰ转化为成熟的自噬体膜蛋白LC3Ⅱ[28]。有研究报道,ATG7缺陷小鼠由于缺乏自噬通路,出生后1 d内就会死亡[29]。近期大量研究指出,许多miRNA(如miRNA-20a、miRNA-17和miRNA-137等)可以通过靶向沉默ATG7抑制细胞自噬过程[30-32]。本研究通过生物信息预测软件预测出ATG7是miRNA-210的靶基因,并运用双荧光素酶报告实验证实了这一预测,且用siRNA沉默ATG7会减弱miRNA-210 inhibitor引起的ColⅡ和蛋白多糖表达量升高及MMP-3和MMP-13表达量降低的现象。
综上,本研究发现,miRNA-210在发生退行性变的椎间盘组织中的表达量较健康椎间盘组织明显升高,过表达的miRNA-210通过与自噬相关基因ATG7的3'-UTR结合沉默其表达,导致细胞自噬受到抑制,引起细胞外基质中MMP-3和MMP-13表达量升高,ColⅡ和蛋白多糖降解增加,从而促使IDD进展。

