黄连素在脊髓损伤中对线粒体的保护作用及机制
王 奕,于荣华,徐 炜,朱晓东,林浩东*
1.海军军医大学附属长征医院骨科,上海 200003
2.上海市交通大学医学院附属同仁医院骨科,上海 200050
脊髓损伤(SCI)是骨科、神经科的严重疾病之一,常导致完全或不完全性的感觉、运动以及自主神经功能障碍等[1-2],严重威胁患者的健康和生命[2-3]。SCI具有十分复杂的病理生理过程,主要分为原发性损伤和继发性损伤。原发性损伤指外力导致的直接性破坏,通常是不可逆的[4]。而继发性损伤是导致SCI后病理级联反应的主要组成部分,是可逆的,因此,目前的研究多集中在继发性损伤方面。继发性损伤包括炎性反应、Ca2+超载、氧化应激、兴奋性氨基酸释放、线粒体应激等一系列病理过程,最终导致神经元、胶质细胞凋亡,引发运动和感觉障碍[5]。线粒体在中枢神经系统的多种疾病中扮演着非常重要的角色,通过干预线粒体氧化损伤以抑制SCI后细胞凋亡、促进神经功能恢复已经成为研究前沿与热点。
黄连素(小檗碱)是从中国传统中药黄连中提取的一种天然的异喹啉类生物碱,具有抗炎、抗菌、抗癌及降糖等多种药理作用[6-7]。近年来,黄连素在神经系统疾病中的作用日益被重视。研究发现,黄连素可保护运动神经元[8],对神经退行性病变具有潜在治疗作用[9],并且可减轻脑缺血再灌注损伤[10]。与此同时,有研究证实黄连素具有抗氧化应激、保护线粒体的作用,Zhang等[11]通过体外实验证明黄连素可以保护干细胞,降低低氧诱导的细胞凋亡率;Gomes等[12]发现黄连素可以介导SIRT1依赖的线粒体途径减轻胰岛素抵抗。本研究旨在通过测定黄连素对SCI后线粒体氧化和神经细胞凋亡的影响,研究黄连素对SCI的可能作用与机制。
1 材料与方法
1.1 试剂和仪器
黄连素购自Sigma-Aldrich公司;PSI-IH脊髓打击器购自新泽西州立大学;丙二醛(MDA)试剂盒、还原型谷胱甘肽(GSH)试剂盒和超氧化物歧化酶(SOD)试剂盒、BCA蛋白浓度测定试剂盒、RIPA裂解液(强)、线粒体和胞质蛋白制备试剂盒购自碧云天生物技术研究所;细胞色素C(Cyt C)单克隆抗体(ab110325,1∶1 000稀释)、羊抗兔IgG-HRP抗体(ab6721,1∶2 000稀释)、羊抗鼠IgG-HRP抗体(ab6789,1∶2 000稀释)、NeuN单克隆抗体(ab177487,1∶1 000稀释)、FITC标记的羊抗兔IgG(ab6717,1∶500稀释)购自Abcam公司;caspase-3单克隆抗体(9661s,1∶1 000稀释)、cleaved capase-3单克隆抗体(8172S,1∶1000稀释)、β-actin单克隆抗体(4970S,1∶1 000稀释)购自CST公司;TUNEL染色试剂盒(In Situ Cell Death Detection Kit,TMR red;12156792910)购自Roche公司。全自动酶标仪和电泳仪购自Bio-Rad公司;-80℃超低温冰箱购自Thermo公司;高速冷冻离心机购自Eppendorf公司;冰冻切片机购自Leica公司;荧光显微镜购自Olympus集团。
1.2 SCI模型制备与动物分组
SPF级健康雄性C57小鼠36只(上海交通大学医学院附属同仁医院实验动物中心),体质量250 ~300 g,采用随机数字表法平均分为3组(n=12),即假手术组、SCI组、黄连素组。假手术组仅去除椎板和棘突显露脊髓,不进行造模打击;SCI组、黄连素组使用PSI-IH脊髓打击器制备SCI模型[13],打击点T10,损伤力为0.6 N,停留时间为0 s。模型成功标准:脊髓充血,双下肢痉挛抽动,尾巴痉挛摆动,BBB评分为0分。模型制备成功后立即经腹腔注射给药一次,剂量为10 mg/kg(根据前期预实验结果及参考文献[14]方法确定,SCI组注射生理盐水,黄连素组注射黄连素)。术后小鼠自由进食和饮水,饲养环境室温维持在23℃ ~ 25℃,保持干燥通风。协助SCI小鼠排尿、排便,每日3次。
1.3 小鼠脊髓组织线粒体GSH、MDA、SOD的检测
各组小鼠于SCI后24 h麻醉,迅速取出以打击点为中心、头尾端各0.5 cm(共计1.0 cm)的脊髓组织,进行生物化学检测和蛋白质印迹分析。取脊髓组织,剪碎、匀浆,根据线粒体和胞质蛋白制备试剂盒说明进行操作,分离线粒体和胞质蛋白。取提纯的线粒体,按照GSH、MDA、SOD试剂盒说明书进行操作,使用全自动酶标仪进行检测,最后根据BCA法测得的线粒体蛋白浓度进行换算,得出各组线粒体中GSH、MDA、SOD的水平。
1.4 小鼠脊髓组织caspase-3、cleaved caspase-3以及细胞质内和线粒体内Cyt C的检测
取相应的脊髓组织、胞质蛋白或提纯的线粒体,制备蛋白样品,进行凝胶电泳。电泳完毕后将蛋白转移至PVDF膜上,将转印后的PVDF膜置于封闭液中室温下摇床封闭1 h。根据检测蛋白所在区域裁剪PVDF膜,分别置于caspase-3一抗(1∶1 000稀释)、cleaved caspase-3一抗(1∶1 000稀释)、Cyt C一抗(1∶1 000稀释)和β-actin一抗(1∶1 000稀释)中,4℃摇床孵育过夜。用TBST室温洗膜3次,将膜置于山羊抗兔IgG、山羊抗鼠IgG二抗(1∶2 000稀释)中,室温摇床孵育1 h。取出后再用TBST洗膜3次。将超敏ECL试剂盒中A液和B液等体积混合后滴加于PVDF膜上,利用凝胶成像系统曝光成像,保存蛋白图像,利用Image J软件对蛋白图像进行分析。
1.5 脊髓组织中神经细胞凋亡的检测
SCI后24 h麻醉小鼠,仰卧位胸部备皮,打开胸腔暴露心脏,迅速将细针刺入小鼠主动脉,用止血钳固定,连接恒流泵进行灌注。灌注50 mL生理盐水后,再低速灌注4%多聚甲醛溶液20 min。灌注完成后立即取出以打击点为中心、头尾端各0.5 cm(共计1.0 cm)的脊髓组织,用4%多聚甲醛浸泡固定24 h,20%、30%蔗糖溶液梯度脱水各24 h。脱水完毕后,在-20℃环境中用OCT包埋剂包埋脊髓组织。使用冰冻切片机在-20℃条件下连续切取脊髓冠状面组织切片,切片厚度为5 μm。从打击中心开始,头尾端每隔3张切片取1张,每个组织共取6张切片,将组织切片贴附于载玻片上,放入冰箱中以备免疫荧光染色检测。
取出制备好的切片,复温后用PBS浸洗3次,加正常驴血清封闭1 h。将一抗NeuN(1∶1 000稀释)滴加到切片上,4℃避光孵育过夜,用PBS浸洗3次。加入FITC标记的羊抗兔IgG(1∶500稀释),室温避光孵育1 h,用PBS浸洗3次。按照TUNEL染色试剂盒说明书进行操作。最后每张组织切片滴加30 μL的DAPI溶液(2 μg/mL),避光、室温孵育3 min。在200倍视野下,每张切片随机选取6个视野,观察计数绿色荧光的NeuN标记与红色的凋亡小体标记共同定位的TUNEL阳性细胞数。
1.6 统计学处理
采用SPSS 19.0软件对数据进行统计学分析。实验数据均采用±s表示,多组间比较采用单因素方差分析,两两比较采用LSD-t检验;以P < 0.05为差异有统计学意义。
2 结 果
2.1 小鼠SCI模型的可重复性和标准性
采用PSI-IH脊髓打击器制备小鼠SCI模型,全程计算机控制,打击脊髓后小鼠双后肢迅速出现痉挛性抽搐,尾巴翘起并左右摇摆,随后出现双后肢肌力丧失,锐器刺激双下肢无反应,丧失自主排尿能力。通过IH Spinal Cord Impactor Software V5.0.4软件瞬间获得脊髓受打击时的所有信息,如位移/打击力曲线、设定力大小、实际撞击力大小、脊髓位移等,各实验动物SCI模型曲线一致。同时分析各实验动物实际打击力量,符合正态分布[打击力为(0.581 67±0.049 97)N],说明SCI模型具有良好的稳定性和适用性。
2.2 各组小鼠脊髓组织线粒体中MDA、GSH、SOD水平
与假手术组相比,SCI组、黄连素组小鼠脊髓组织MDA水平增高,GSH、SOD水平降低;与SCI组相比,黄连素组小鼠脊髓组织MDA水平降低,GSH、SOD水平增高;差异均有统计学意义(P < 0.05,图1)。
2.3 各组小鼠脊髓组织线粒体和细胞质内Cyt C表达水平
与假手术组相比,SCI组、黄连素组小鼠脊髓组织线粒体中Cyt C表达量减少,细胞质内Cyt C表达量增多;与SCI组相比,黄连素组小鼠脊髓组织线粒体中Cyt C表达量增多,细胞质内Cyt C表达量减少;差异均有统计学意义(P < 0.05,图2)。
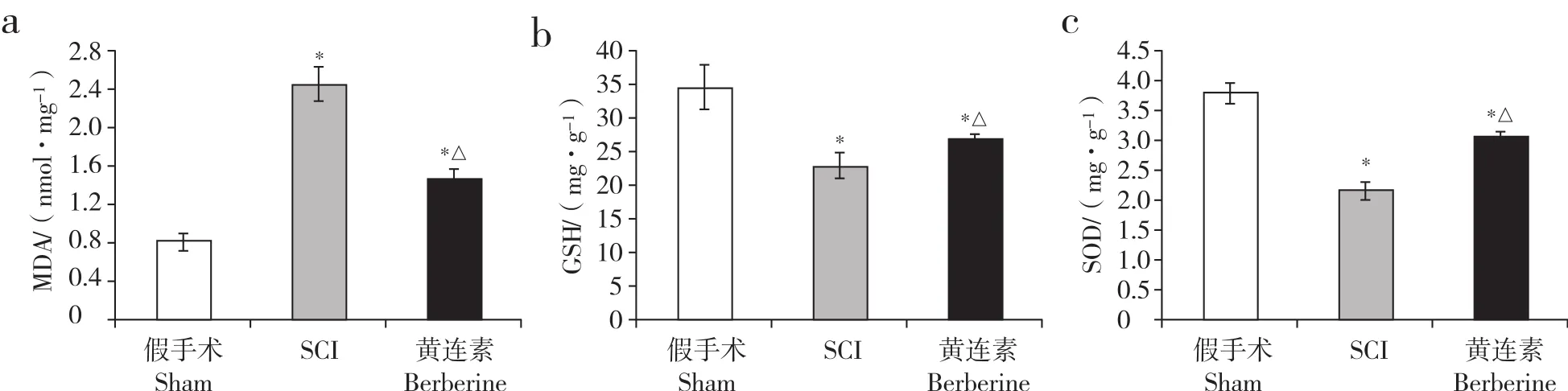
图1 各组小鼠脊髓组织线粒体内MDA、GSH和SOD水平Fig. 1 Levels of MDA,GSH and SOD in mitochondria of each group

图2 各组小鼠脊髓组织中线粒体和细胞质内Cyt C水平Fig. 2 Levels of Cyt C in mitochondria and cytoplasm of each group
2.4 各组小鼠脊髓组织中caspase-3、cleaved caspase-3表达水平
SCI组小鼠脊髓组织中凋亡关键分子caspase-3的表达量较假手术组增多(P < 0.05);黄连素组caspase-3表达量与SCI组相比降低(P < 0.05),与假手术组相比增高(P < 0.05)。各组cleaved caspase-3表达趋势与caspase-3一致。见图3。
与假手术组相比,SCI组、黄连素组小鼠脊髓组织中caspase-3、cleaved caspase-3表达水平增高;与SCI组相比,黄连素组小鼠脊髓组织中caspase-3、cleaved caspase-3表达水平降低;差异均有统计学意义(P < 0.05,图3)。

图3 各组小鼠脊髓组织中caspase-3和cleaved caspase-3表达量Fig. 3 Expressions of caspase-3 and cleaved caspase-3 in each group
2.5 神经元凋亡免疫荧光双标记染色
图4a中蓝色荧光的DAPI标记细胞核,绿色荧光的NeuN标记神经细胞,红色荧光的TUNEL法标记凋亡小体,绿色与红色荧光共同定位的细胞为凋亡神经细胞。与假手术组相比,SCI组与黄连素组小鼠脊髓组织中神经细胞凋亡数量增多;与SCI组相比,黄连素组神经细胞凋亡数量减少;差异均有统计学意义(P < 0.05,图4b)。
3 讨 论
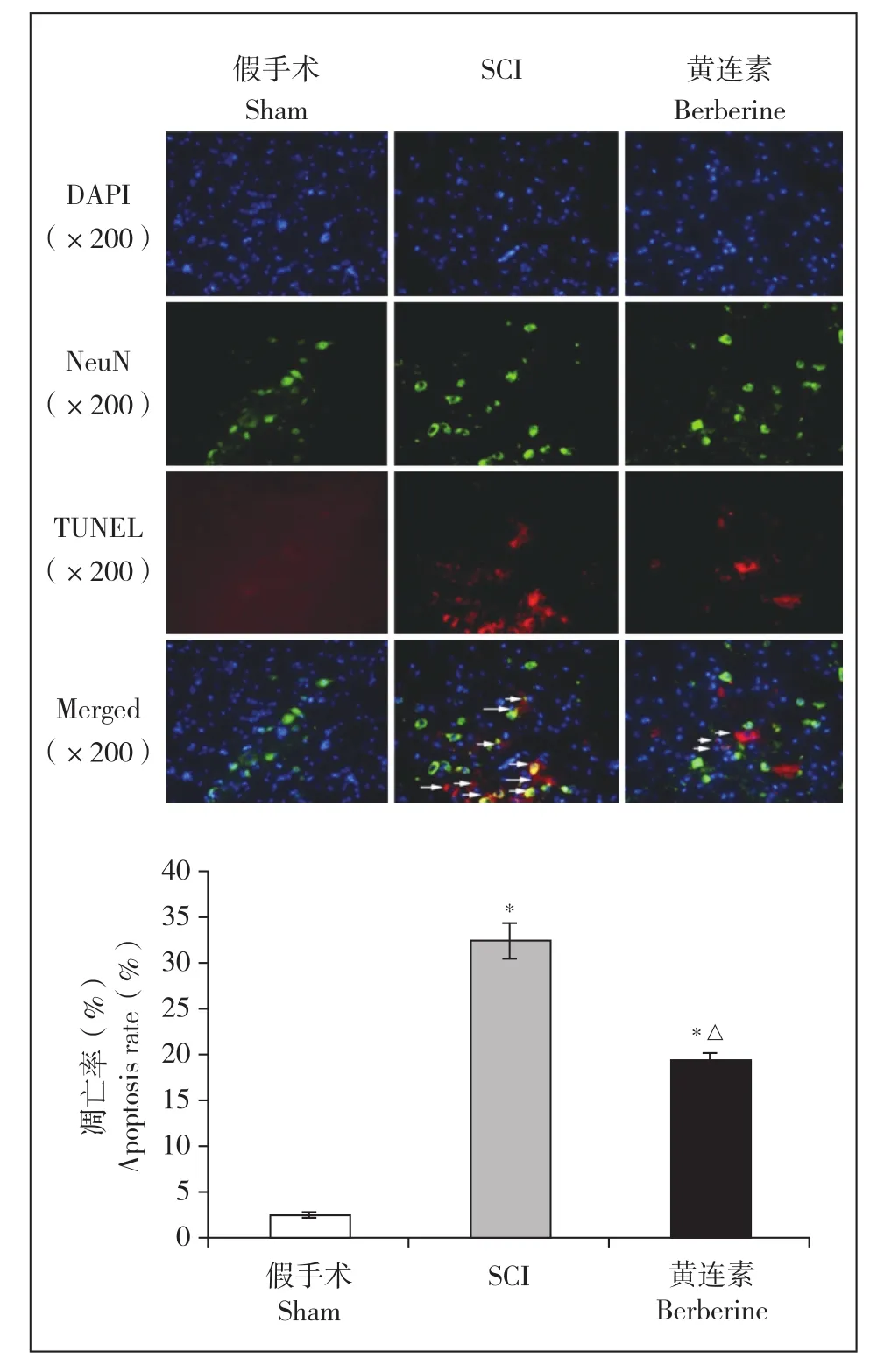
图4 各组小鼠脊髓组织中神经元凋亡情况Fig. 4 Neural apoptosis in each group
近年研究表明,SCI后脊髓神经元的死亡和缺失主要是由细胞凋亡导致,并非缘于原发性直接损伤,因此,如何有效抑制SCI后细胞凋亡是预防或减轻继发损伤、促进相关功能恢复的关键。细胞凋亡是在生理或病理情况下,细胞主动激活并按照特定方式进行的一种由遗传信息调控的细胞死亡途径,与继发性SCI的重要环节——氧化应激密切相关。SCI后体内氧化与抗氧化作用失衡,内环境更倾向于氧化状态,产生大量氧化中间产物,超过机体的清除能力,导致组织中的氧自由基大量堆积,使包括线粒体膜在内的各种生物膜性结构完整性及通透性遭到破坏,多种细胞器功能异常,产生更多的氧自由基,形成氧化应激恶性循环[15],对能量代谢丰富的脊髓组织中线粒体损伤极为显著。
线粒体损伤会导致脂质过氧化物积聚。本研究选取MDA、GSH、SOD作为检测氧化损伤的指标。MDA是一种脂质过氧化的终产物,是常用的反映组织氧化损伤程度的指标;GSH作为一种脂质过氧化物清除剂,其含量是衡量机体抗氧化能力的重要标准;SOD是机体内清除氧自由基的重要保护性物质,是反映机体抗氧化能力的经典指标。本研究发现,SCI后脊髓组织线粒体中MDA水平升高,SOD、GSH水平降低,说明SCI可以诱导氧化损伤和线粒体损伤,与本研究预实验及其他研究相符[15-16]。而在SCI模型建立后24 h,应用黄连素能明显抑制线粒体MDA的产生,同时促进SOD、GSH的产生,说明黄连素能够抑制SCI后线粒体的氧化应激反应,对线粒体起到保护作用。此外,Hsu等[8]发现黄连素通过抗氧化损伤和PI3K/Akt通路发挥神经细胞保护作用。Yu等[17]证实黄连素可以通过保护线粒体减轻肾小管细胞的低氧再灌注损伤。Yan等[6]证实黄连素与线粒体存在密切关系。在肿瘤细胞中,中毒剂量的黄连素可以抑制线粒体的功能,从而抑制肿瘤细胞的增殖,说明线粒体可能是黄连素的药理作用靶点之一。
线粒体氧化应激反应可以激活线粒体凋亡通路,从而导致神经元的缺失。Cyt C是生物氧化过程中的重要电子传递体,其对组织的氧化、还原有迅速的酶促作用。在神经系统中,Cyt C通常定位于神经细胞线粒体内,参与氧化呼吸链反应,为细胞供给能量。但在氧化应激、炎症等损伤情况下,线粒体膜结构发生破坏,Cyt C从线粒体释放到细胞质中,与一系列凋亡因子或蛋白相互作用,最终导致细胞凋亡关键执行者caspase-3激活为cleaved caspase-3,从而介导caspase家族依赖性细胞凋亡途径。本研究发现,SCI后脊髓组织细胞线粒体内Cyt C降低,释放进入细胞质。结合生物化学的检测结果,印证了SCI可以介导线粒体氧化应激、促进Cyt C的释放。注射黄连素后Cyt C从线粒体中的释放减少,说明黄连素可以通过抗氧化损伤保护线粒体。本研究进一步检测了各组小鼠脊髓组织内caspase-3及cleaved caspase-3的表达水平,发现SCI引起caspase-3、cleaved caspase-3表达升高,激活凋亡途径,而黄连素可以抑制caspase凋亡途径。因此,推测黄连素可能通过抗氧化损伤及抑制线粒体凋亡通路保护线粒体,在SCI中起到神经保护作用。
由于脊髓组织中存在神经细胞、胶质细胞等多种细胞,为了进一步明确黄连素对神经元的作用并排除其他细胞的影响,本研究采用免疫荧光双标染色,分别选取了细胞核标记物DAPI、神经元特异性标记物NeuN和TUNEL法进行共染色,结果显示,与SCI组相比,黄连素组神经细胞凋亡数量减少,说明黄连素可以保护SCI后脊髓神经元、抑制神经元凋亡。
综上所述,黄连素可减轻SCI小鼠脊髓组织中神经细胞凋亡,这可能与其抑制线粒体氧化损伤、减少Cyt C释放、降低凋亡蛋白表达有关。黄连素作为传统中药的主要成分,其作用与机制是多方面的。Yu等[17]发现黄连素对于肾小管缺氧损伤的保护作用一方面来源于保护线粒体,另一方面与抑制内质网应激也密切相关。Hsu等[8]指出黄连素的神经保护功能与激活Nrf2核转移以及PI3K/Akt通路相关,此外,抗氧化损伤和抑制相关凋亡蛋白表达也是黄连素在神经系统中的可能机制之一。Lu等[18]发现黄连素可能通过激活AMPK通路、减少能量储备而抑制神经轴突的生长。因此,虽然本研究从细胞器水平、线粒体方面解读了黄连素对于SCI的作用,但其在神经等系统中的机制尚有待进一步研究。

